牙乳头细胞促进大鼠牙髓干细胞中Wnt信号分子的表达
张忠提,张雪,李瑞武
(中国医科大学1.口腔医学院干诊科;2.口腔医学院中心实验室;3.辽宁省口腔医学研究所;4.口腔医学院口腔颌面外科,沈阳110002)
牙髓干细胞(dental pulp stem cell,DPSC)在牙齿的修复再生研究中扮演重要角色[1]。Notch、Wnt等多种信号转导通路可调节DPSC的增殖及分化。其中Wnt信号通路在牙齿发育的信号调控和牙齿再生等医学工程研究中发挥重要作用。Wnt信号途径中的重要因子Wnt1、腺瘤样息肉蛋白(adenomatous polyposis coli,APC)、β-连环蛋白(β-catenin)可影响牙上皮和间充质的相互作用及牙本质与牙根的发育、增殖和分化[2]。我们前期实验[3]发现大鼠牙乳头细胞在体外与DPSC分层共培养可促进DPSC的增殖能力,为探讨这一生物学过程的细胞内分子机制,我们检测了牙乳头细胞和DPSC分层共培养后Wnt通路的表达情况。
本研究拟用原代培养大鼠DPSC与牙乳头细胞建立DPSC和牙乳头细胞的分层共培养体系,探讨牙乳头细胞对大鼠DPSC中Wnt信号分子表达的影响,为DPSC增殖方面的研究提供新的实验依据。
1 材料与方法
1.1 材料
Sprague-Dawley健康雄性4周龄大鼠和Sprague-Dawley出生后1 d大鼠,由中国医科大学实验动物中心提供。DMEM、胰蛋白酶、胎牛血清购自Gibco 公司;Wnt1、APC、β-catenin 一抗 购自 Santa Cruz公司。二抗购自北京中山生物技术公司。
1.2 方法
1.2.1 DPSC和牙乳头细胞分层共培养体系建立:参照文献[4,5]原代培养大鼠DPSC和牙乳头细胞,取对数生长期的细胞用于实验。PBS清洗3次,0.25%胰蛋白酶消化细胞,加入含血清培养基,将细胞从培养瓶壁上吹落并分散成单细胞悬液。将Transwell小室放入24孔板中,分层培养组下室接种DPSC,上室接种牙乳头细胞,培养基为10%胎牛血清的DMEM/F12,置于37℃、5%CO2的细胞培养箱中培养。实验随机分为DPSC培养对照组、DPSC+牙乳头细胞分层培养体系组、分层培养体系组+DKK-1组(DKK-1终浓度为50 ng/mL,作用48 h)。
1.2.2 DPSC及牙乳头细胞免疫组化鉴定:24孔板内细胞经PBS清洗后,4%多聚甲醛中4℃固定24 h。PBS漂洗3次。滴加0.1%Triton X-10050 μL,室温放置8 min。PBS漂洗3次。3%H2O2室温孵育15 min,山羊血清封闭,室温孵育15 min。一抗孵育:兔抗鼠牙本质涎蛋白(dentin sialoprotein,DSP)1∶100,兔抗鼠波形丝蛋白(vimentin)1∶100,兔抗鼠角蛋白(cytokeratin)1∶150。生物素标记山羊抗兔二抗孵育后。辣根酶标记,DAB显色,苏木素复染、镜检。
1.2.3 RT-PCR 法 检 测 DPSC 中 Wnt1、APC、βcateninmRNA的表达:各组细胞培养5 d后,提取细胞总RNA,将得到的RNA样本进行反转录,以得到对应的cDNA。建立PCR反应体系,引物信息如表1,PCR 反应程序如下:95℃变性5 min,95℃20 s,60℃20 s,72℃30 s共30个循环,72℃延长5 min。然后琼脂糖凝胶电泳,利用Bio-Rad凝胶成像仪成像和Fluor Chen V2.0 Stand Alone软件对图像进行分析,以β-actin为内参照,结果以整合光密度值(integrated density value,IDV)比值表示。
1.2.4 Western blot方法检测 DPSC中 Wnt1、APC、β-catenin蛋白的表达:各组细胞培养5 d后,PBS冲洗,加入RIPA裂解液收集细胞,4℃、12000 r/min离心10 min,取上清液采用BCA蛋白浓度测定试剂盒进行蛋白定量。取各组的等量蛋白进行SDSPAGE电泳后,转移至硝酸纤维素膜上。5%的脱脂奶粉封闭2 h后,按不同比例稀释的一抗中4℃孵育过夜。经TTBS充分洗膜后,二抗孵育45 min。ECL底物发光显色。以β-actin为内对照,所得图像扫描后,采用Fluor Chen2.0软件进行定量分析,测得IDV值。

1.3 统计学分析
2 结果
2.1 DPSC及牙乳头细胞的培养及鉴定
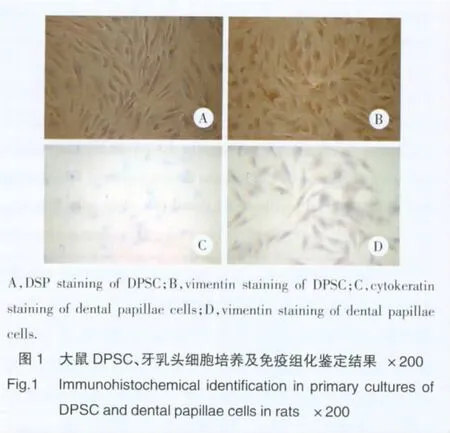
大鼠DPSC为成纤维细胞样细胞,多数呈长梭形,细胞核较大。牙乳头细胞,形态可呈多角形、三角形等,细胞体积较小。牙乳头细胞胞质中Cytokeratin染色阴性、Vimentin染色阳性。DPSC中DSP染色阴性、Vimentin染色阳性,见图1。
2.2 RT-PCR结果
结果显示:分层共培养组较DPSC培养对照组Wnt1、β-cateninmRNA 的表达显著增强(P<0.01)。DPSC和牙乳头细胞分层培养下,给予Wnt信号通路抑制剂DKK-1干预DPSC,结果显示DPSC中Wnt1、β-cateninmRNA的表达与未干预组比较均显著降低(P<0.01)。而分层共培养组中APCmRNA与DPSC培养组或给予DKK-1组比较均无统计学意义(P>0.05)。见图2。
2.3 Western blot结果
与DPSC培养对照组比较,分层共培养组Wnt1、β-catenin蛋白的表达显著增强(P<0.01)。给予DKK-1干预DPSC后,分层共培养组DPSC中Wnt1、β-catenin蛋白的表达较未给予抑制剂组显著降低(P<0.01)。分层共培养组中APC蛋白与DPSC培养对照组或给予DKK-1组比较均无统计学差异(P>0.05),见图3。

3 讨论
本研究RT-PCR和Western blot实验结果显示大鼠牙乳头细胞和DPSC分层共培养5 d后,牙乳头细胞和DPSC分层共培养可显著增加DPSC中Wnt信号分子Wnt1、β-catenin基因和蛋白的表达,提示Wnt信号通路的激活可能参与了牙乳头细胞促进DPSC的增殖作用。
目前各种义齿仍然是缺失牙齿的主要修复方法,但它们也存在各种问题[6],而牙齿的再生是目前口腔医学中面临的难题之一,它对于口腔医学研究领域的发展具有划时代的意义。尽管人们利用生物组织工程技术进行器官再造、组织再生及牙齿再生已经多年,但是目前全球牙齿再生的研究现状还远远达不到能够提供组织工程牙齿供临床应用[7]。种子细胞是牙齿组织工程的重要条件,可用于牙齿组织工程的细胞来源有DPSC、牙源性外胚间充质细胞等。DPSC位于牙髓组织内,具有自我更新的能力,可分化为成牙本质细胞。研究表明,影响DPSC增殖分化的因素包括碱性成纤维生长因子、转化生长因子、骨形成蛋白、β-磷酸甘油、Dentonin 等[8,9]。有文献报道[10]牙乳头中存在能分化为成牙本质细胞的干细胞。将牙乳头细胞在体外进行培养,不仅可以分化为成牙本质细胞,还可以诱导形成牙本质基质。我们前期实验[3]证实大鼠牙乳头细胞和DPSC分层共培养,牙乳头可能分泌一些可溶性因子促进DPSC的增殖、矿化,并增加一些重要成牙标志性蛋白的表达。提示牙乳头细胞可能通过某种作用机制促进了DPSC的增殖、分化程度。
为了进一步探讨Wnt信号分子是否参与了牙乳头细胞促进DPSC增殖作用的这一生物学过程,我们检测了一些重要Wnt信号分子。Wnt基因家族编码一类结构相似的分泌型蛋白,Wnt信号蛋白与细胞表面Frizzled受体作用,启动下游信号级联反应,实现细胞内外的信息传递,Wnt基因调控的信号转导系统在胚胎发育、器官形成、牙齿发育中均起重要作用。Wnt信号通路的主要成员包括Wnt蛋白配体、Wnt受体、β-catenin、糖原合成酶激酶、轴蛋白、APC。β-catenin是Wnt信号转导的重要中介物,APC在Wnt信号转导途径中亦起重要作用。Wnt/βcatenin属于典型Wnt通路的胞内信号通路。研究发现在牙上皮和间充质的相互作用以及牙本质、牙根的发育过程中,Wnt信号都发挥着不可替代的作用[11,12]。本研究利用RT-PCR方法检测牙乳头细胞和DPSC分层共培养组中Wnt1、APC和β-catenin mRNA的表达,发现Wnt1、β-catenin基因表达在共培养组中显著增强,我们又应用Western blot方法检测了分层共培养组中Wnt1、APC和β-catenin蛋白的表达,Western blot结果与RT-PCR结果一致。
综上所述,DPSC和牙乳头细胞分层共培养时可能通过激活Wnt信号通路中Wnt1、β-catenin促进DPSC的增殖作用。但确切的细胞内分子机制有待进一步研究。
[1]丁刚,刘怡,王松灵.牙髓干细胞研究现状[J].首都医科大学学报,2008,29(5):660-663.
[2]Chen J,Lan Y,Baek JA,et al.Wnt/beta-catenin signaling plays an essential role in activation of odontogenic mesenchyme during early tooth development[J].Dev Biol,2009,334(1):174-185.
[3]张忠提.牙乳头细胞对大鼠牙髓干细胞增殖及分化的影响及机制研究[D].沈阳:中国医科大学,2012.
[4]Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells (DPSCs)in vitro and in vivo[J].Natl Acad Sci USA,2000,97(25):13625-13630.
[5]Sculean A,Berakdar M,Windisch P,et al.Immunohistochemical investigation on the pattern of vimentin expression in regenerated and intact monkey and human periodontal ligament[J].Arch Oral Biol,2003,48(1):77-86.
[6]刘洪臣.全口义齿常见问题及处理[J].中国实用口腔科杂志,2009,2(12):721-723.
[7]Chai Y,Slavkin HC.Prospects for tooth regeneration in the21st century:a perspective[J].Microsc Res Tech,2003,60(5):469-479.
[8]Liu M,Sun Y,Liu Y,et al.Modulation of the differentiation of dental pulp stem cells by different concentrations of β-glycerophosphate[J].Molecules,2012,31,17(2):1219-1232.
[9]路娟英,高杰,麻丹丹,等.干细胞因子促进人乳牙牙髓干细胞增殖与向成骨方向分化[J].南方医科大学学报,2011,31(3):531-534.
[10]Kikuchi H,Suzuki K,Sakai N,et al.Odontoblasts induced from mensenchymal cells of murine dental papillae in three-dimensional cell culture[J].Cell Tissue Res,2004,317(2):173-185.
[11]Liu F,Chu EY,Watt B,et al.Wnt/β-catenin signaling directs multiplestagesoftoothmorphogenesis[J].Dev Biol,2008,313(1):210-224.
[12]Suomalainen M,Thesleff I.Patterns of Wnt pathway activity in the mouse incisor indicate absence of Wnt/beta-catenin signaling in the epithelial stem cells[J].Dev Dyn,2010,239(1):364-372.

