盐酸格拉司琼鼻腔喷雾剂的稳定性研究
王东兴,钱秋玉,孙建绪,高永良,张振清 (. 北京军区总医院63临床部药械科,北京 049;. 军事医学科学院毒物药物研究所,北京 00850)
用于全身系统疾病的治疗,鼻腔给药具有起效快、无首过消除作用、无损伤、使用方便等特点[1-2],近年来发展迅速。呕吐患者常常因恶心、呕吐而不适合口服给药,影响止吐药物口服给药的疗效,因此,止吐药物的鼻腔给药日益受到重视[3]。盐酸格拉司琼是选择性5-羟色胺3受体拮抗剂,目前国内外已上市剂型有片剂、口服溶液剂和注射剂,用于预防和治疗放化疗引起的恶心和呕吐以及各种手术后的恶心和呕吐[4]。根据止吐药物适合通过鼻腔给药的特点[3],我们开发了具有自主知识产权的国家二类新药—盐酸格拉司琼鼻腔喷雾剂,并已申请中国发明专利并获得授权[5],目前正在进行临床试验。在该制剂开发过程中,我们按照国家新药研究的有关规定对其稳定性进行了研究,现报道如下。
1 材料
1.1 仪器
UV-160A紫外可见分光光度计(SHIMADZU);tspP2000型高效液相色谱仪,tspUV1000型紫外检测器,tsp4600型积分仪;pH计(HANNA HI931410);万分之一电子分析天平(Sartorius)。
1.2 药品与试剂
盐酸格拉司琼原料药(太极集团,纯度99.9%,批号000815005);羟苯乙酯(分析纯,Sigma,批号54H3472);盐酸格拉司琼鼻腔喷雾剂(自制,批号010416、010417、010418);甲醇(色谱纯,邯郸四友生物科技有限公司);无水乙酸钠(分析纯,温州市试剂化工厂,批号961105);三乙胺(分析纯,天津市化学试剂六厂,批号980715)。
2 方法
2.1 稳定性分析方法的建立
2.1.1 含量测定方法 色谱条件:Phenomenex prodigy ODS(3)色谱柱(250 mm×4.6 mm, 5 μm),流动相为甲醇-0.05 mol·L-1醋酸钠缓冲液(50∶50,含0.25%三乙胺,冰醋酸调pH值至6);流速 1 mL·min-1;检测波长 301 nm;进样量 20 μL; 柱温为30 ℃。
方法精密度:分别配制盐酸格拉司琼的低(1 μg·mL-1)、中(5 μg·mL-1)、高(10 μg·mL-1)浓度溶液,分别连续进样5次,记录色谱峰面积,分别计算三种浓度的色谱峰面积的RSD值。
盐酸格拉司琼工作液的稳定性:分别配制盐酸格拉司琼的低(1 μg·mL-1)、中(5 μg·mL-1)、高(10 μg·mL-1)浓度溶液,分别在不同时间间隔进样,记录色谱峰面积,分别计算三种浓度的色谱峰面积的日内差、日间差。
线性范围:配制100 μg·mL-1的盐酸格拉司琼储备液,分别稀释成0.2、1.0、5.0、10.0、15.0、20.0 μg·mL-1的浓度,进样并记录峰面积,以浓度对峰面积进行线性回归,求得回归方程和相关系数。
方法的回收率实验:按照盐酸格拉司琼鼻腔喷雾剂的处方,以102 μg·mL-1的盐酸格拉司琼储备液和3.1 μg·mL-1的防腐剂储备液制备低(1 μg·mL-1)、中(5 μg·mL-1)、高(10 μg·mL-1)三个浓度的盐酸格拉司琼溶液,其中防腐剂含量均为0.155 μg·mL-1,按含量测定方法测定盐酸格拉司琼含量,计算回收率。
2.1.2 盐酸格拉司琼鼻腔喷雾剂有关物质检查 盐酸格拉司琼分解产物干扰试验:分别以水、0.1 mol·L-1HCl、0.1 mol·L-1NaOH和3%H2O2为溶剂配制200 μg·mL-1的盐酸格拉司琼溶液,灌封于2 mL安瓿中,其中,3%H2O2为溶剂者置于40 ℃烘箱中,其余放入100 ℃烘箱中,分别于不同时间取样,按照含量测定的HPLC方法进样,考察其分解情况及分解产物与盐酸格拉司琼色谱峰的分离情况。
盐酸格拉司琼鼻腔喷雾剂有关物质检查:按中国药典2000版(二部)附录V D中主成分自身对照法进行。
2.2 盐酸格拉司琼鼻腔喷雾剂稳定性实验
2.2.1 盐酸格拉司琼鼻腔喷雾剂稳定性样品的制备制备批号分别为010416、010417、010418的盐酸格拉司琼鼻腔喷雾剂各100瓶,用于稳定性实验,检测各批样品的pH值、外观、含量及有关物质。
2.2.2 加速实验 将三个批号的盐酸格拉司琼鼻腔喷雾剂置于40 ℃烘箱中,分别于第1、2、3、6月取样,进行稳定性实验各考察指标的检测。
2.2.3 室温长期留样 将三个批号的盐酸格拉司琼鼻腔喷雾剂置于室温环境中,分别于第3、6、9、12、18、24、36月取样,进行稳定性实验各考察指标的检测。
3 结果
3.1 稳定性分析方法的建立
3.1.1 含量测定方法 方法精密度:盐酸格拉司琼的低(1 μg·mL-1)、中(5 μg·mL-1)、高(10 μg·mL-1)浓度溶液分别进样后的色谱峰面积平均RSD值为0.61%(n = 15),方法的精密度良好。
盐酸格拉司琼工作液的稳定性:盐酸格拉司琼的低(1 μg·mL-1)、中(5 μg·mL-1)、高(10 μg·mL-1)浓度溶液分别进样后的色谱峰面积日内差RSD值< 1.17%,日间差RSD值 < 1.67%,工作液稳定性良好。
线性范围:盐酸格拉司琼溶液在0.2 ~ 20.0 μg·mL-1的浓度范围内对色谱峰面积的回归方程如下:Y = 89 061.701 7X – 4 686.669 7,r = 0.999 96(n = 3),药物浓度与色谱峰面积之间线性关系良好。
方法的回收率实验:低(1 μg·mL-1)、中(5 μg·mL-1)、高(10 μg·mL-1)三个浓度的盐酸格拉司琼溶液的回收率分别为(100.98±1.25)%、(100.43±0.82)%、(100.83±0.71)%,表明该测定方法准确,回收率符合含量测定的要求。
盐酸格拉司琼鼻腔喷雾剂的含量测定方法:精密吸取盐酸格拉司琼鼻腔喷雾剂溶液1 mL于50 mL容量瓶中,加水至刻度,摇匀,精密吸取该溶液1 mL于10 mL容量瓶中,加水至刻度,摇匀,作为供试品溶液;另取盐酸格拉司琼对照品,精密称取适量,用水溶解并定量稀释成每1 mL中约含5 μg(以格拉司琼游离碱计)的溶液,作为对照品溶液。分别取供试品溶液和对照品溶液20 μL注入液相色谱仪,记录色谱图,按外标法以峰面积计算,即得。
3.1.2 盐酸格拉司琼鼻腔喷雾剂有关物质检查 盐酸格拉司琼分解产物干扰实验:在中性、酸性、碱性和氧化条件下,盐酸格拉司琼均产生一个分解产物,其色谱峰在色谱图中的保留时间均相同,并且与盐酸格拉司琼色谱峰分离良好。盐酸格拉司琼在3%H2O2中分解最快,其次为0.1 mol·L-1NaOH溶液和0.1 mol·L-1HCl溶液,在水中最稳定。盐酸格拉司琼在0.1 mol·L-1NaOH溶液中的分解产物色谱图见图1。因此,在该色谱条件下,盐酸格拉司琼分解产物不会干扰盐酸格拉司琼的含量测定,该方法适合于盐酸格拉司琼鼻腔喷雾剂的稳定性分析。
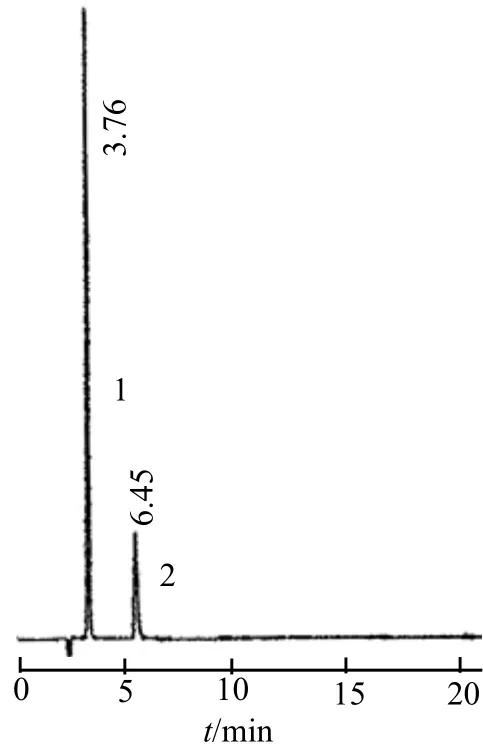
图1 盐酸格拉司琼在0.1 mol·L-1NaOH溶液中的分解产物色谱图1 – 分解产物;2 – 盐酸格拉司琼Fig 1 Chromatogram of degradation products of granisetron hydrochloride in 0.1 mol·L-1NaOH solution1 – degradation products; 2 – granisetron hydrochloride
盐酸格拉司琼鼻腔喷雾剂有关物质检查:精密吸取盐酸格拉司琼鼻腔喷雾剂溶液0.5 mL于25 mL容量瓶中,加水至刻度,摇匀,作为样品溶液;精密吸取样品溶液1 mL于100 mL容量瓶中,加水至刻度,摇匀,作为对照溶液;在盐酸格拉司琼鼻腔喷雾剂稳定性分析方法的色谱条件下,首先取上述对照溶液进样,记录盐酸格拉司琼色谱峰的峰面积,再取上述样品溶液进样,记录色谱峰至盐酸格拉司琼色谱峰保留时间的两倍,除溶剂峰和盐酸格拉司琼色谱峰外的杂峰峰面积之和应小于对照溶液的盐酸格拉司琼色谱峰的峰面积。
3.2 盐酸格拉司琼鼻腔喷雾剂稳定性实验
3.2.1 稳定性样品的检测结果 具体见表1。
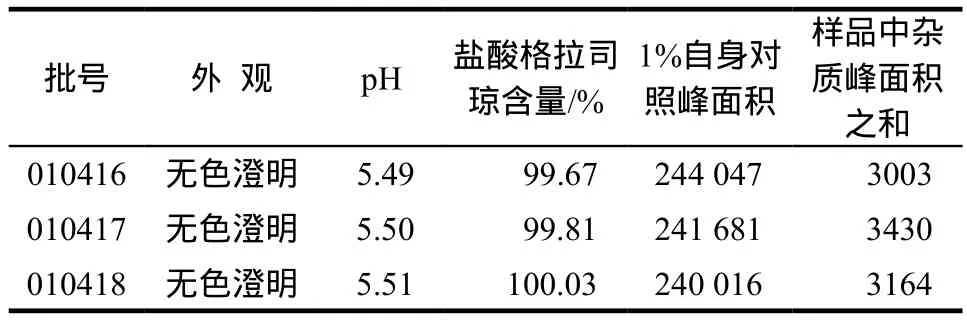
表1 盐酸格拉司琼鼻腔喷雾剂稳定性样品测定结果Tab 1 Test results of granisetron hydrochloride nasal spray samples for stability study
3.2.2 加速实验 加速实验结果表明:三批样品在40℃、RH75%下放置6个月,外观、pH值、主药含量、有关物质检查等均符合规定。 0天和6个月的结果见表2。
3.2.3 室温长期留样观察 室温长期留样36个月的实验结果表明:三批样品外观、pH值、主药含量、有关物质检查等均符合规定。0天和36个月的结果见表3。
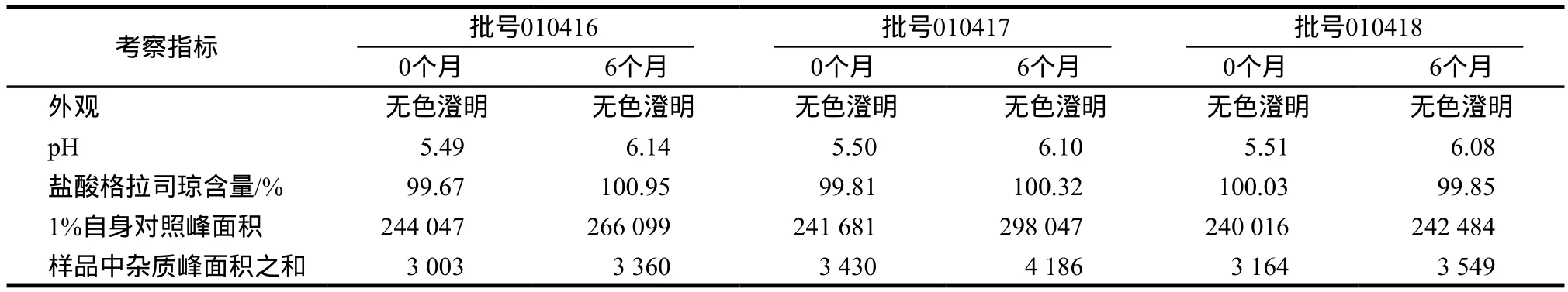
表2 盐酸格拉司琼鼻腔喷雾剂加速实验结果Tab 2 Results of accelerated test on granisetron hydrochloride nasal spray
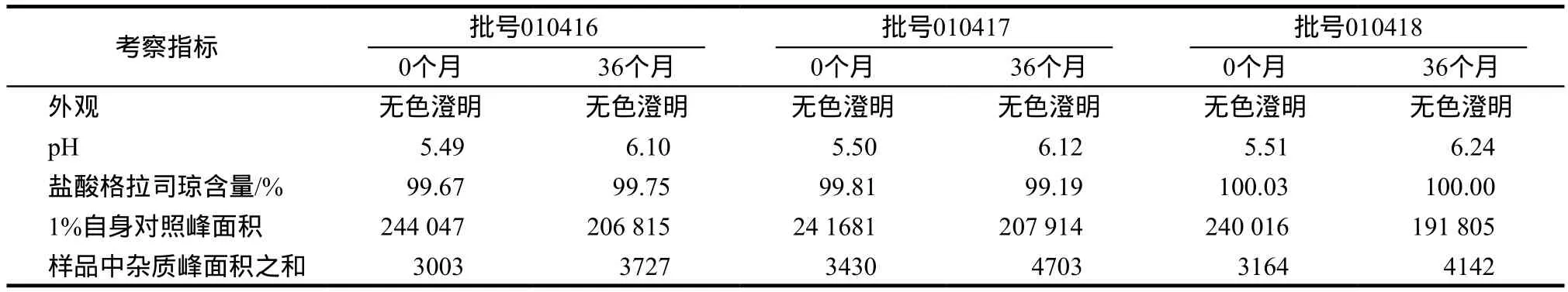
表3 盐酸格拉司琼鼻腔喷雾剂室温长期留样实验结果Tab 3 Results of long term observation on granisetron hydrochloride nasal spray
4 讨论
对于呕吐患者来说,口服给药依从性较差,而注射给药不仅需要专业的人员和特定的环境,对人体还会产生一定的损伤,因此,止吐药的新给药途径研究日益受到重视,其中,鼻腔给药途径尤为引人注目[3]。盐酸格拉司琼的新给药途径研究有鼻腔给药[6-10]和透皮给药[11]的文献报道,以鼻腔给药的报道居多。
上述报道多为盐酸格拉司琼鼻腔给药的药物动力学及药效学方面的研究,而要将其开发成新药并应用于临床,制剂学的研究不可或缺。稳定性研究作为新药研究中制剂学研究的重要内容之一,对于保证药品质量具有重要意义,故而我们对盐酸格拉司琼鼻腔喷雾剂的稳定性进行了系统研究。经过6个月的加速实验和36个月的长期留样观察,盐酸格拉司琼鼻腔喷雾剂的外观、pH值、主药含量、有关物质等各项考察指标均符合规定,该制剂稳定性良好。盐酸格拉司琼鼻腔喷雾剂的稳定性研究国内外尚未见报道,本研究可为同类研究提供参考。本文结果还可为将来盐酸格拉司琼鼻腔喷雾剂之上市产品的有效期制定提供参考,但上市产品的有效期仍要以实际大生产的产品进行稳定性研究后确定。

