不同种类食物中葛根素含量的测定
刘阳,韦京豫,蒲玲玲,吴健全,杨继军,郭长江
(军事医学科学院卫生学环境医学研究所,天津 300050)
葛根素(puerarin)是从豆科植物野葛、甘葛藤的干燥根中提取出来的一种异黄酮成分,其化学名称为7,4’-二羟基异黄酮-8β-D-葡萄吡喃糖,呈白色针状结晶,能溶于水,但溶解度小,其水溶液为无色或微黄色。它具有改善心脑血管循环、降低血糖、防止高血压及动脉硬化、提高机体免疫力、抗菌、抗病毒等多种药理作用,并具有明显的解酒和改善学习记忆功效[1-4]。葛根素因毒性小,安全范围广,疗效好而极具临床应用价值。它常见的测定方法有:紫外分光光度法(UV)[5]、高效液相色谱法(HPLC)[6]、薄层色谱法(TLC)[7]和毛细管电泳(CE)[8]等。但应用范围最广的是HPLC,本实验采用HPLC方法测定不同种类食物中葛根素的含量,进一步了解葛根素在不同种属植物中的分布情况。
1 材料与方法
1.1 试剂与仪器
葛根素标准品(中国药品生物制品检定所)。主要仪器包括2695型高效液相色谱仪、2998型二极管阵列检测器:Waters公司;ALPHA1-4/LD-2型冷冻干燥机:德国Martin Christ公司。
1.2 样品采集与处理
1.2.1 样品采集
共采集60种食物样品,分别由重庆、广州、天津、武汉4个不同地区提供,主要包括蔬菜、水果及干豆类食物。蔬菜水果样品用自来水、蒸馏水反复冲洗干净,晾干,按我国居民食用习惯将可食用部分(不少于300 g)切成丁块并混合均匀,冷冻干燥24 h后取出,分装入铝箔袋中,抽真空后封口,放入-50℃低温冰箱中保存,同时测算每种样品的水分含量。干豆类样品直接用打碎机研成粉末,分装入铝箔袋中,抽真空后保存备用。
1.2.2 样品前处理
分别取食物样品,将其研制成粉末,精密称取0.25 g,置于容量为50 mL的离心管内,加入水-甲醇(1∶1)混合液20 mL,置于85℃水浴30 min,冷却后3000 r/min离心10 min,将上清液移置50 mL容量瓶中,残渣再用水-甲醇(1∶1)混合液提取两次,每次加入 15 mL,涡旋震荡3 min,离心分离,将其上清液并入上述容量瓶中,加水-甲醇(1∶1)混合液至刻度线,作为样品溶液。每种食物样品平行取样处理测定3次。
1.2.3 标准溶液的制备
精确称取葛根素对照品 5 mg,加水-甲醇(1∶1)混合液溶解后配制成10 mL储存溶液。准确量取该液1 mL,置入 25 mL 容量瓶中,加水-甲醇(1∶1)混合液至刻度,作为标准品应用液。
1.3 色谱条件
方法[9],结合本实验室条件确定如下:色谱柱:Waters Nova-Pak C18(4μm,3.9 mm×150 mm);流动相:水-乙腈-磷酸(900∶100∶1);流速:1.0 mL/min;检测波长:254 nm;柱温:35℃;测定时取10μL进样,按上述色谱条件进行分析,测定各溶液中葛根素的峰面积,并由此计算出样品中葛根素的含量,测定结果(以干重计)以mg/100 g(dry weight,DW)表示。
2 结果
2.1 葛根素色谱峰的定性
分别取葛根素标准品溶液和葛根样品溶液,按上述色谱条件进样分析,结果显示,标准葛根素的保留时间为6.2 min左右,将葛根素标准品与葛根样品的HPLC图谱进行叠加,如图1。
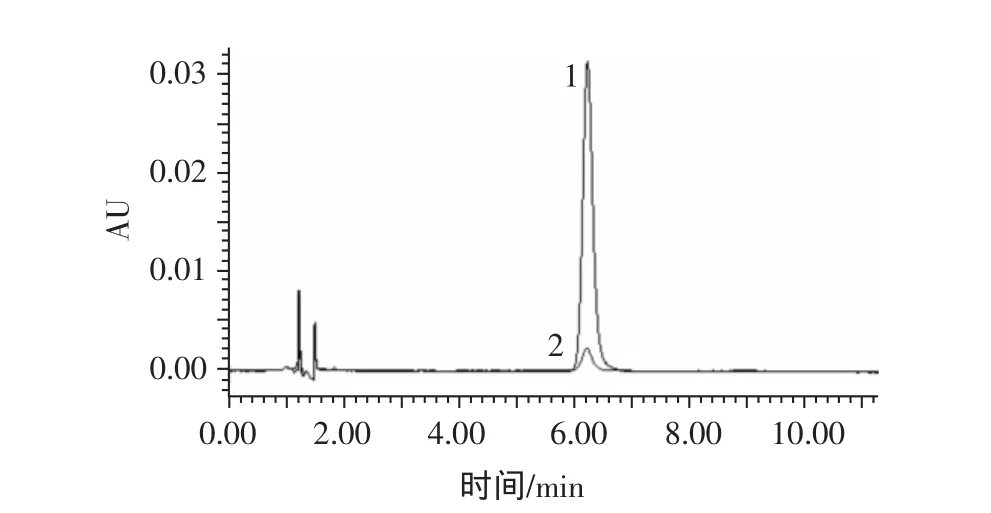
图1 葛根素标准品与葛根样品HPLC图谱叠加Fig.1 HPLC chromatogram map overlay of puerarin radix puerariae sample
样品中葛根素的出峰时间与其完全吻合,表明样品中葛根素得到很好的分离,色谱峰形佳,干扰峰少且无拖尾现象。
2.2 标准曲线的建立
取葛根素标准品适量,精密称定,加水-甲醇(1∶1)混合液溶解后,配制成浓度为 3.125、6.25、12.5、25、50、100μg/mL的溶液,分别取上述溶液各10μL进样,在上述色谱条件下分析,记录色谱峰面积,在3.125μg/mL~100μg/mL的浓度范围内,色谱峰面积与葛根素浓度呈良好的线性关系,见图2。回归方程为y=39796x-5306.9,R2=0.9998。
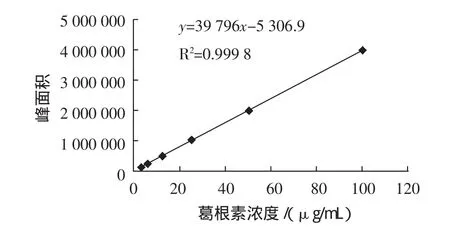
图2 葛根素标准曲线Fig.2 The standard curve of puerarin
2.3 样品含量的测定
2.3.1 葛根中葛根素含量的测定
按照样品前处理方法配制葛根样品溶液,取10μL进样,平行测定3次,按外标法以峰面积计算葛根素含量。经测定,产自天津的葛根样品中葛根素含量(以干重计)为(170.30±1.13)mg/100 g。
2.3.2 蔬菜中葛根素含量的测定
共测定了采集于不同地区的40种蔬菜样品,包括鲜豌豆、蜜豆、花豆角、刀豆、四季豆、豌豆苗、黄豆苗、藕、红薯、粉莲藕、红心番薯、紫甘薯、红甘薯、南瓜、生姜、豇豆、扁豆、毛豆、荷兰豆、绿豆芽、黄豆芽、芋头、山药、土豆、白萝卜等。测定结果显示,只在6种蔬菜中检出葛根素,其余样品均未检出。其中芋头中葛根素含量最高,为18.60 mg/100 g(以干重计),远高于其它蔬菜;重庆地区共有4种蔬菜检出葛根素,而武汉地区蔬菜样品均未检出。不同地区绿豆芽中均检出葛根素,其中广州地区绿豆芽中葛根素含量(以干重计)为0.79 mg/100 g,而重庆地区绿豆芽中葛根素含量(以干重计)为 0.58 mg/100 g(表 1)。
表1 不同地区蔬菜(干重)中葛根素含量(mg/100 g,,n=3)Table 1 Puerarin content in vegetables from different areas
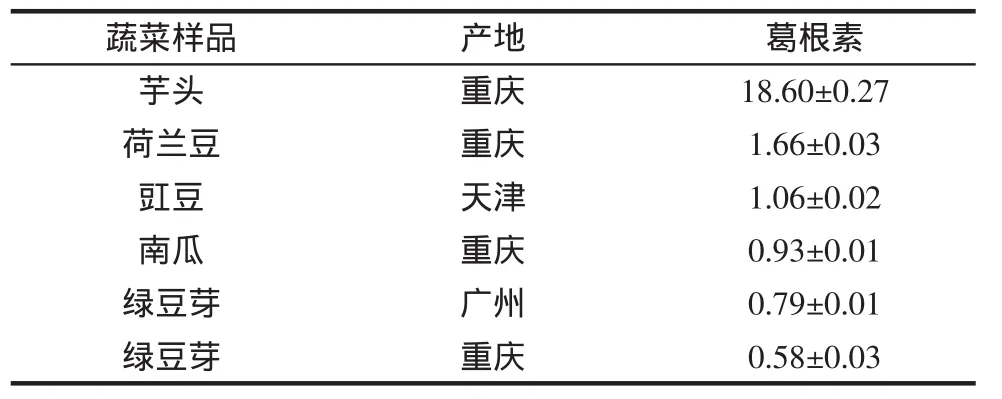
表1 不同地区蔬菜(干重)中葛根素含量(mg/100 g,,n=3)Table 1 Puerarin content in vegetables from different areas
2.3.3 水果中葛根素含量的测定
共检测了10种水果样品,包括苹果、梨、脐橙、西瓜、水蜜桃、草莓、芒果、猕猴桃、香蕉、巨峰葡萄,但只在重庆芒果中检出葛根素,含量(以干重计)为(0.97±0.09)mg/100 g。说明葛根素在水果中分布较少,含量也偏低。
2.3.4 干豆类食物中葛根素含量的测定
共测定了10种干豆类食物样品,包括花豆、黄豆、绿豆、青豆、蚕豆、豌豆、黑豆、白芸豆、红芸豆、赤小豆。结果显示,葛根素在干豆类食物中分布也较少,只在天津绿豆中检出葛根素,含量(以干重计)为(1.99±0.07)mg/100 g。
3 结论
根据《中国药典》2005年版,关于葛根药材中葛根素的含量测定方法是以甲醇-水(25∶75)作为流动相[10],其葛根素的吸收峰与随后的小杂峰的分离效果不好,出现尖峰还有拖尾现象,且出峰时间较晚[11]。本实验参考文献方法[9],流动相采用水-乙腈-磷酸(900∶100∶1)体系,结果在此条件下葛根素峰形尖锐且对称,原因可能是葛根素含有酚羟基,容易解离,加入酸可以抑制酚羟基的解离,也有效防止了拖尾现象。本实验方法操作简便,可应用于食物或中药材中葛根素含量的测定。
以往文献多是对中药材及饮片中葛根素含量的报道,而未见对食物中葛根素含量测定的报道,本研究丰富了这方面的数据。实验结果显示,除葛根中含有丰富的葛根素外,一些食物中也含有一定量的葛根素,如芋头,含量(以干重计)达18.60 mg/100 g,远高于其它样品;广州、重庆地区绿豆芽均检出葛根素,含量(以干重计)范围在0.58 mg/100 g~0.79 mg/100 g。水果样品只在芒果中检出葛根素,含量(以干重计)为0.97 mg/100 g。干豆类样品也只在绿豆中检出葛根素,含量(以干重计)为1.99 mg/100 g。总体上看,葛根素在不同种类食物中分布范围不广,主要分布在豆科类植物中,且含量也普遍较低。
参考文献:
[1]Lamlertkittikul S,Chandeying V.Efficacy and safety of Pueraria mirifica(Kwao Kruea Khao)for the treatment of vasomotor symptoms in perimenopausal women:phase II study[J].J Med Assoc Thai,2004,87:33-40
[2]姚新生,赵守训,潘得济,等.天然药物化学[M].北京:人民卫生出版社,1996:191-195
[3]久保道德.葛根的化学成分[J].国外医学中医中药分册,1995,15(3):23-25
[4]孙长颢.营养与食品卫生学[M].6版.北京:人民卫生出版社,2007:110-121
[5]中华人民共和国卫生部药品标准(试行)[S].WS-257(X-207)-92[6]颜军,胡静,陈启蒙.HPLC法测定注射用葛根素中葛根素含量[J].天津药学,2008,20(4):26-28
[7]李云霞.薄层扫描法测定葛根药材中葛根素含量[J].中成药,2001,23(6):444
[8]Han S.Determination of puerarin by capillary electrophoresis with chemiluminescence detection[J].J Chromatogr B,2009,877:1591-1594
[9]王慕邹.常用中草药高效液相色谱分析[M].北京:科学出版社,1999:354-357
[10]国家药典委员会编.中华人民共和国药典(2005年版一部)[S].北京:化学工业出版社,2005:233-234
[11]阮洪生.高效液相色谱法测定葛根素注射液中葛根素的含量[J].现代中药研究与实践,2006,20(4):46-47

