锁阳多糖CSP-D1的分离纯化与表征
王风霞,张继,,*,高义霞,王云普
(1.天水师范学院生命科学与化学学院,天水市农产品深加工工程技术研究中心,甘肃 天水 741001;2.西北师范大学生命科学学院,甘肃特色植物有效成分制品工程技术研究中心,甘肃 兰州 730070)
锁阳(Cynomorium songaricum Rupr.)是多年生草本植物锁阳的肉质茎,喜生于荒漠草原带与荒漠带的干旱或含盐碱的沙地上,常寄生于白刺的的根部。锁阳具有补肾阳、益精血、润肠通便[1]和提高免疫力[2]的功效,在民间常作为食物蒸食,也作为补药广泛使用。研究发现多糖类物质有可能是锁阳重要的有效成分[3]。近年来,尽管锁阳逐渐受到了医药界的广泛关注,但与其他的植物多糖相比,锁阳多糖的研究并不广泛。现有的研究也多以粗糖的提取工艺[4-5]、药理活性[6-8]为主,对锁阳多糖结构[9-10]的研究报道极少。本工作从具有抗氧化活性的锁阳多糖复合物中分离出2个多糖组分,本文仅对其中得到的新的可溶性多糖(Polysaccharide isolated from Cynomorium songaricum Rupr.,CSP-D1)的理化性质、单糖组成等的研究进行报道,为锁阳药用资源的研究开发及植物多糖的研究应用提供实验参考。
1 材料与方法
1.1 材料与试剂
锁阳购自甘肃省黄河药材市场。DEAE-纤维素柱填料为 Cellulose DE-52(solarbio);木瓜蛋白酶(sigma)、各种标准单糖、D-半乳糖醛酸(sigma)、H2O2、CHCl3、正丁醇、咔唑、乙酸酐、吡啶等其他试剂均为分析纯:天津化学试剂一厂。
1.2 仪器与设备
HL-2恒流泵、BSZ-100自动收集器:上海青浦沪西仪器厂;GPC2000高温凝胶渗透色谱仪:美国waters公司;FTS3000型傅里叶红外光谱仪:美国PE公司;GC-MS 联用仪[配有 HP-5(30 m×0.25 mm×0.25μm)弹性石英毛细管柱及美国NIST02L质谱数据库]:美国安捷伦公司;UV1100紫外分光光度计:北京莱伯泰科科技有限公司;DT-40 TG-DTA热分析系统:日本岛津。
1.3 方法
1.3.1 锁阳多糖CSP-D1的分离纯化
锁阳多糖的提取:锁阳低温真空烘干后,粉碎,100目过筛。70%乙醇浸泡粉末除脂,热水浸提,滤液浓缩后乙醇沉淀,离心收集沉淀,冷冻干燥得锁阳粗多糖。粗多糖用木瓜蛋白酶和sevag法[11-12]脱蛋白,H2O2法脱色[9]得到锁阳精多糖。
锁阳多糖CSP-D1的纯化[13](采用DEAE-纤维素柱纯化):100 g Cellulose DE-52,蒸馏水浸泡,再用0.5 mol/L NaOH-0.5 mol/L NaCl溶液处理30 min,抽干后用蒸馏水洗涤至中性。用磷酸缓冲液处理后装柱(1.6 cm×51 cm)。分别用蒸馏水及0~0.2 mol/L的NaOH进行梯度洗脱,恒流泵控制流速为0.6 mL/min,自动收集器收集,每管收集8 min,隔管苯酚硫酸法于A490检测糖分布。
1.3.2 GPC(高温凝胶渗透色谱)纯度检测
测定条件为 Laser wavelength:690.0 nm;Solvent:water;Flow rate:0.500 mL/min。
1.3.3 红外吸收光谱的测定
样品KBr压片处理,于400 nm-1~4000 nm-1波长扫描。
1.3.4 GC-MS(气相-质谱法联用)测定单糖组成
色谱柱:HP-5弹性石英毛细管柱(30 m×0.25 mm×0.25μm);升温程序:160 ℃保持 3 min,以 2 ℃/min 程序升温升至210℃,保持1 min;检测器温度:250℃;进样口温度:250℃;载气(N2)流速 1.0 mL/min,进样量0.2μL;分流比:50 mL/min。
完全酸水解及衍生化[14]:10 mg多糖加入4 mol/L三乙氟酸(TFA)4 mL,120℃氮气保护反应 10 h,产物蒸干后加入40 mg盐酸羟铵,2 mL吡啶,90℃反应30 min得到乙酰化产物。标准单糖同样做衍生化处理。减压蒸干乙酰化产物,氯仿溶解后进行GC-MS分析,并根据气质各峰的面积比算出百分含量。
1.3.5 TG-DTA(差热-热重)分析
取CSP-D1粉末2 mg左右,参比物为Al2O3,气氛为氮气,升温速率:10℃/min,升温范围:25℃~750℃。
1.3.6 糖醛酸含量的测定
糖醛酸含量的测定[14]:以半乳糖醛酸为对照品制作标准曲线(溶液浓度范围为 10μg/mL~100μg/mL),采用咔唑法,依照文献处理后使用紫外分光光度计在400 nm~800 nm扫描(以蒸馏水同法操作为参比)得最佳波长为526 nm。取CSP-D1溶液0.1 mL,同时做3个重复,按标准曲线的测定法分别测定其吸光值,并利用线性回归方程计算糖醛酸含量。
2 结果与分析
2.1 锁阳多糖CSP-D1的纯度分析
锁阳多糖经过 Cellulose DE-52(1.6×51 cm)柱层析,用苯酚硫酸法测定洗脱曲线如图1。

图1 锁阳多糖Cellulose DE-52纤维素柱洗脱曲线Fig.1 Chromatogram of Cynomorium songaricum Rupr.polysaccharide on Cellulose DE-52
由图1可知,用蒸馏水洗脱时可得1种组分,NaOH进行梯度洗脱得另一组分。峰一收集得到的锁阳多糖命名为CSP-D1,此组分峰形对称。峰二的峰形较峰一偏斜程度大,本文仅做峰一的研究。
CSP-D1干燥后粉末为浅黄色,易溶于水,如图2,GPC测得其分子量(Mn)为5.5×104。从GPC激光检测得到的响应曲线可见其峰形对称,表明组分均一。
2.2 锁阳多糖CSP-D1的结构表征
图3为CSP-D1的红外光谱图。

图2 CSP-D1的GPC检测(激光检测器)Fig.2 Gel permeation chromatogram(measured with laser detector)of CSP-D1

图3 CSP-D1的红外光谱图Fig.3 FTIR spectra of CSP-D1
3398.57cm-1的-OH 吸收峰,2932.25 cm-1的C-H伸缩振动峰以及1400 cm-1~1200 cm-1左右的C-H变角振动峰都是糖类化合物的特征吸收峰[11];1615.77 cm-1~1442.09 cm-1处的吸收峰为C=O振动峰和C-H弯曲振动峰;875 cm-1为β-D吡喃葡萄糖的特征吸收峰[16-17]。
以常见的8种标准单糖做对照,以逐一进样与混合进样的方法,确定每种单糖的出峰时间,得到GCMS单糖标准图谱,如图4。图5为CSP-D1的GC-MS图谱,根据各色谱峰与标准样品保留时间的对照见表1。

表1 GC-MS测定标准单糖与CSP-D1单糖组成的保留时间及含量Table 1 GC-MS analysis of the retention time and content of standards and CSP-D1
由以上图表可知,CSP-D1的色谱峰依次为鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖。各组成含量表明,其主要由葡萄糖、半乳糖、阿拉伯糖和甘露糖组成,并含有少量的鼠李糖。其中保留时间为11.14 min的峰经GC-MS数据库检索由非糖物质形成,此峰在标准糖图谱中同样存在。与已有的文献报道[9]不同,锁阳多糖单糖组成中并不含核糖,此外,含量最多的不是半乳糖而是葡萄糖。推测以上结果差异是由以下原因造成的:1)材料、提取纯化以及测定方法的差异都可能导致文献与本研究中的锁阳多糖为结构不同的糖;2)文献中的核糖是含量最少的组分,其存在与否与多糖纯度及仪器的灵敏度紧密相关,即使材料中存在少量核酸,都有可能在单糖组成分析时出现核糖。
图6(A、B)中分别为CSP-D1的DTA以及TG曲线。
由图6A可知,CSP-D1的分解反应[18]主要集中在290℃~520℃,分多步发生。100℃以下的失重由吸附水分的蒸发引起,之后的失重为多糖本身的分解。其结果分析见表2、3。从图6B可知,CSP-D1的起始分解温度为206.9℃,外推始点277.8℃。
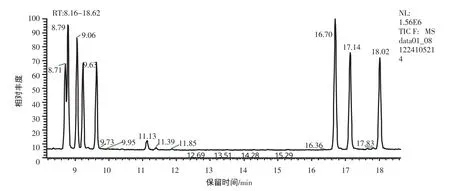
图4 标准单糖的GC-MS图谱Fig.4 GC-MS spectra of Standards
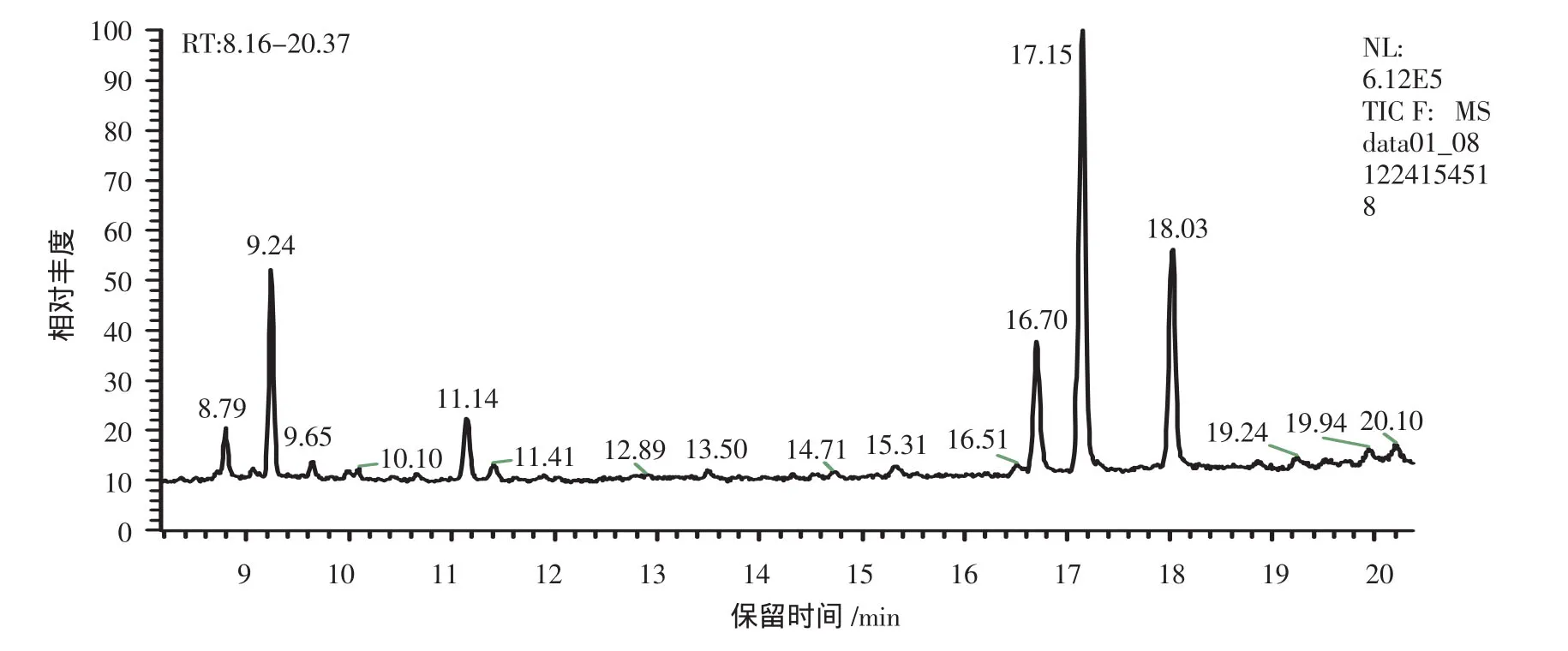
图5 CSP-D1单糖组成的GC-MS图谱Fig.5 GC-MS spectra of monosaccharide composition of CSP-D1

表2 CSP-D1差热分析表Table 2 The differential thermal date of CSP-D1

表3 CSP-D1热重分析表Table 3 The initial decomposition temperature and weight loss of CSP-D1 and CSP-D1
2.3 锁阳多糖CSP-D1糖醛酸含量的确定
按照1.3.5方法,对样品中糖醛酸含量进行测定,得出CSP-D1中的糖醛酸含量为27.9%,与文献中[7]报道的两种锁阳多糖的糖醛酸含量相比,平均高出了17.3%。
3 结论
1)锁阳经水提醇沉分离、脱蛋白脱色后,柱层析可以得到组分均一,分子量为5.5×104的CSP-D1多糖。2)锁阳多糖CSP-D1是含糖醛酸(其糖醛酸种类目前还不确定)27.9%的酸性杂多糖,其单糖组成为:鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖,其中含量最多的糖为葡萄糖,其次为半乳糖。百分含量分别为44.26%和23.30%。红外光谱证实其具有多糖类特征吸收峰,单糖连接方式中存在β连接,热分析表明CSP-D1为无定形粉末。3)综合以上结果,CSP-D1是锁阳中提取得到的一种新的多糖,与已经发现的锁阳多糖相比,其单糖组成相对单一,并且具有较高的糖醛酸含量,该糖与已发现的锁阳多糖不同的结构对应的药理优势还有待进一步研究。
[1]刘媖心,杨喜林,姚育英.中国沙漠植物志[M].北京:科学出版社,1987:407-408
[2]Ma C,Nakamura N,Miyashiro H,et al.Inhibitory effects of constituents from Cyonmorium songaricum and related triterpene derivativesonHIV-1protease[J].Chemical Pharmacy Bull,1999(47):141-145
[3]常艳旭,苏格尔.锁阳的有效成分及指标性成分的探讨[J].现代中药研究与实践,2005,19(3):55-59
[4]常艳旭,李晋,苏格尔,等.锁阳不同生育期多糖含量的动态研究[J].内蒙古大学学报:自然科学版,2007,38(2):237-240
[5]刘晔玮,邸多隆,葛斌,等.锁阳多糖提取工艺的研究[J].天然产物研究与开发,2006(18):1007-1009
[6]张汝学,贾正平,李茂星,等.锁阳PartⅢ对环磷酰胺致免疫抑制小鼠免疫功能的影响[J].中药材,2008,31(3):407-409
[7]罗军德,张汝学,贾正平,等.锁阳抗缺氧活性部位的药理作用及机制研究[J].中药新药与临床药理,2007,18(4):275-279
[8]焦扬,李彩霞,倪丽芳,等.锁阳多糖抗氧化性研究[J].食品科技,2007,32(11):113-115
[9]张思巨,张淑运,扈继萍.锁阳多糖的研究[J].中国中药杂志,2001(26):407-411
[10]WANG Jun-long,ZHANG Ji,Zhao Bao-tang,et al.Structural features and hypoglycaemic effects of Cynomorium songaricum polysac-charides on STZ-induced rats[J].Food chemistry,2010(120):443-451
[11]张惟杰.糖复合物生化研究技术[M].浙江:浙江大学出版社,1994:128-312
[12]Chen X M,Tian G Y.Structural elucidation and antitumor activity of a fructan from Cyathula Officinalis Kuan[J].Carbohydrate research,2003(338):1235-1241
[13]任凤霞,乔善义,赵毅民,等.六味地黄汤中三个多糖组分的化学结构研究[J].2010,12(4):1904-1907
[14]GOUBET F.Analysis of methylated and unmethylated polygal acturonic acid structure bypolysaccharide analysis using carbohydrate gel electrophoresis[J].Analytical biochemistry,2003,321(2):174-182
[15]王文平,郭祀远,李琳,等.野木瓜多糖中糖醛酸含量测定[J].食品科技,2007,10(3):84-86
[16]吴东儒.糖类的生物化学[M].北京:高等教育出版社,1987:882-885
[17]FERREIRA D,BARROS M A,COIMBRA M A,et al.Use of FT-IR spectroscopy to folow the effect of processing in cell wall polysaccharide extracts if a sun-dried pear [J].Carbohydrate polymer,2001,45(2):175-182
[18]刘振海.分析化学手册IX:热分析[M].北京:化学工业出版社,2000:120-142

