转移因子胶囊对自身免疫性甲状腺病的免疫调节作用
李丽 金倩 刘苗 靳小静 黄燕红 李静
自身免疫性甲状腺病(Autoimmune Thyroid Disease,AITD)包括Graves病(GD)、Graves眼病(GO)、自身免疫性甲状腺炎(AIT)和原发性甲状腺功能减退症等,是一组复杂的多基因遗传相关的器官特异性自身免疫病[1]。遗传、环境及内源性因素之间复杂的相互作用决定了其发生、发展的复杂性,其关键因素是自身免疫。患者体内存在高滴度甲状腺自身抗体(TAA):抗甲状腺过氧化物酶抗体(antithyroperoxidase antibodies,TPOAb)和甲状腺球蛋白抗体(antithyroglobulin antibodies,TgAb),参与甲状腺滤泡细胞的自身免疫紊乱过程,对甲状腺细胞产生不同程度的损伤和破坏[2,3]。应用免疫调节治疗来提高药物治疗的效果,减少复发,减缓甚至阻止AITD的进展是近年来AITD治疗上的新进展[4,5]。转移因子胶囊为临床上常用的免疫调节药,可增强或抑制体液免疫和细胞免疫功能。本研究的目的是探讨免疫调节剂转移因子胶囊是否可降低AITD患者TAA的浓度。
1 材料与方法
1.1 病例选择 选取2010年4月至2011年7月在中国医科大学附属一院内分泌科门诊及病房确诊的年龄>18周岁的AITD患者62例做为AITD组。对所有患者进行AITD的相关知识讲解并按患者意愿分为:A组33例,其中男10例,女23例,按甲状腺激素水平给予ATDS或L-T4治疗,甲功正常者仅观察。B组29例,其中男8例,女21例,在上述治疗基础上加转移因子胶囊口服(成都利尔药业有限公司,国药准字 H20013365)6 mg,3次/d。所有患者均自愿参加研究并签署知情同意书。AITD诊断标准:TPOAb>50 IU/ml或TgAb>40IU/ml。排除标准:有其他自身免疫性疾病(例如1型糖尿病)或慢性疾病,或正在应用其他免疫制剂者。
设立正常对照组77例,其中男21例,女56例,无甲状腺疾病史,甲状腺功能及TAA检测均正常。
1.2 检测指标及方法 治疗前检测患者甲状腺功能(FT3、FT4、TSH)、TAA(TPOAb、TgAb),治疗 3 个月后再次检测上述全部指标。应用雅培i2000SR全自动免疫化学发光分析仪,化学发光微粒子免疫分析法检测,试剂盒由Abbott Ireland Diagnostics Division提供。正常参考值范围为:TgAb 0~5.61 IU/ml,TPOAb 0 ~ 4.11 IU/ml,FT32.63-5.70 pmol/L,FT49.01 ~19.05 pmo l/L,TSH 0.35~ 4.94 mU/L。
2 结果
正常对照组平均年龄(45±19)岁(19~70岁),AITD患者平均年龄(42±18)岁(19 ~68岁),其中A组(47±16)岁(19~68岁),B组(43±13)岁(21 ~65岁)。各组年龄无明显差异,具有较好的可比性。AITD组(包括 A组及B组)与正常对照组TAA滴度比较见表1。可见AITD组的TPOAb及TgAb滴度显著高于正常对照组(P<0.05),尤其是TPOAb滴度升高更加明显。A组与B组治疗前后TAA的比较见表2,组内治疗前后比较:与同组治疗前相比,A组治疗后TPOAb及TgAb滴度均无明显下降(P值均>0.05),在资料收集中也可见到一些患者的TPOAb及TgAb滴度在治疗后有所上升,甚至是明显升高;B组治疗后与治疗前相比,TPOAb及TgAb滴度均显著下降(P值<0.05),尤其是TPOAb滴度下降更加明显(P值<0.01)。组间比较:治疗前两组间TPOAb及TgAb滴度均无显著差异(P值均>0.05);治疗后两组的TPOAb及TgAb滴度均呈下降趋势,下降幅度B组显著大于A组(P<0.01),治疗后两组间TPOAb及TgAb滴度均有显著差异(P值均<0.05)。
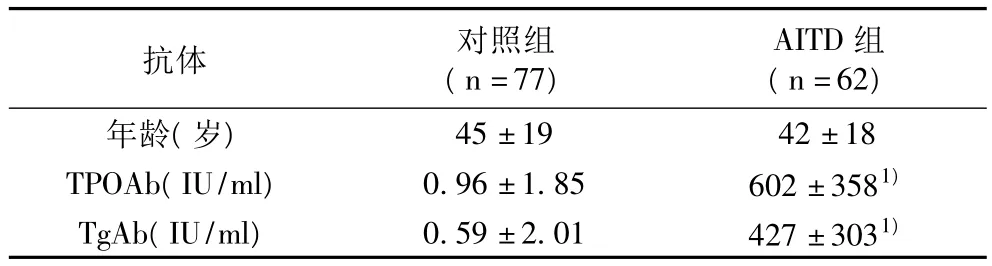
表1 AITD患者与正常对照组TAA滴度的比较
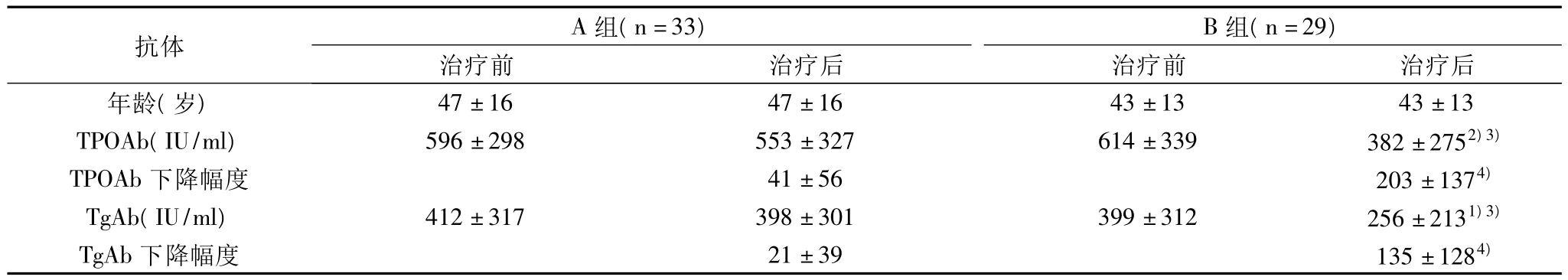
表2 A组与B组治疗前后TAA滴度的比较
3 讨论
AITD患者根据甲状腺激素(FT3,FT4)及促甲状腺激素(TSH)的水平不同可分为甲功正常期,甲亢期及甲减期。对AITD的甲亢期,由于131I治疗和手术治疗有相对应的适应证且之后发生甲状腺功能减退的机率较大,很多患者尚不能接受。而AITD的甲减期只能应用甲状腺激素替代治疗,因此目前药物治疗AITD患者的甲状腺功能紊乱仍然是临床上大多数患者的首选。甲亢者予抗甲状腺药物(ATDs),甲减者予左旋甲状腺素(L-T4)替代。这两种疗法只能暂时纠正失常的甲状腺功能,对自身免疫反应本身不具有明显的免疫调节作用,患者抗体浓度不能恢复正常,自身免疫反应未得到有效和持续的控制。但是在临床上也经常观察到在药物治疗中患者的甲状腺功能有较大波动以及甲状腺功能恢复正常后较高的复发率,表明TAA在AITD的发生、发展及预后中起重要作用。研究揭示,AITD的发病机制与患者甲状腺自身抗原暴露关系密切[6]。TPOAb水平与甲状腺组织中的淋巴细胞浸润和 TSH水平相关,与 AITD发展密切相关[7]。TPOAb在AITD中的致病作用包括介导抗体依赖细胞介导的细胞毒性作用(ADCC)的主要抗体及补体依赖的细胞毒性作用(CDC)等[8]。TgAb 在AITD 中的致病机制包括[9,10]: ①参与 ADCC。②TgAb可以影响甲状腺球蛋白(Tg)抗原的摄取、加工,增强或抑制非显性致病性T细胞抗原决定簇的产生及递呈,进而影响AITD时的细胞免疫。③TgAb对致病性甲状腺球蛋白T细胞抗原决定簇的产生可以呈现中性、抑制或增强效应,取决于TgAb所识别的抗原决定簇和个体遗传背景。具有修饰机体免疫功能的药物统称为免疫调节剂,因此可以应用免疫调节剂来调节AITD的免疫反应过程。免疫调节治疗已成为AITD治疗的重要手段,转移因子胶囊系用健康猪或牛脾脏提取的多肽、氨基酸和多核苷酸等,可增强或抑制体液免疫和细胞免疫功能。为临床常用的免疫调节剂,临床应用时间较长,不良反应少且价格相对便宜。本研究观察到应用转移因子胶囊治疗后AITD患者的TAA滴度显著下降,其原因可能是它作用于细胞或体液免疫应答的某一个环节来阻断TAA的产生,或有活性物质可以与TAA特异结合,打断免疫反应的连锁效应,具体机制还有待进一步研究。本研究也观察到B组患者对ATDs或L-T4治疗的反应较好,甲状腺功能处于平稳的恢复中,但因甲亢期及甲减期各自的病例数较少,时间较短,尚无法进行相关统计分析。而且在临床上还观察到对转移因子治疗3个月后TAA滴度无下降的AITD患者改用香菇菌多糖或甘露聚糖肽治疗后TAA有下降趋势,同样因为病例较少,留待下一步统计分析。
[1]Vaidya B,Kendall-Taylor P,Pearce SH.The genetics of autoimmune thyroid disease. Clin EndocrinolMetab, 2002,87:5385-5397.
[2]Knudsen N,Jorgensen T,Rasmussen S,et al.The prevalence of thyroid dysfunction in a population with borderlineiodine deficiency.Clin Endocrinol(Oxf),1999,51:361-367.
[3]Yang R,Shan Z,Li Y,Prevalence of Thyroid Autoantibodies in Hepatitis Cand Hepatits B Infection in China.Intern Med,2011,50(8):811-815.
[4]Mazokopakis,E.E.,Papadakis,J.A.,Papadomanolaki,M.G.Effects of 12 months treatment with L-selenomethionine on serum anti-TPO levels in patients with Hashimoto's thyroiditis.Thyroid,2007,17:609-612.
[5]Kahara T,Iwaki N,Kaya H.Transition of thyroid autoantibodies by rituximab treatment for thyroid MALT lymphoma.Scientific World-Journal,2010,Jun(10):990-996.
[6]汪新宇,王桂兰,田志.Th1/Th2亚群与自身免疫性甲状腺疾病.中华内分泌代谢杂志,2001,17(2):124-126.
[7]Hollowell JG,Staehling NW,Flanders WD,et al.Serum TSH,T4,and thyroid antibodies in the united states population(1988 to 1994):national health and nutrition examination survey(NHANESⅢ).Clin Endocrinol Metab,2002,87(2):489-499.
[8]Betterle C,Lazzarotto F,Presotto F.Autoimmune polyglandular syndrome Type 2:the tip of an iceberg.Clin Exp Immunol,2004,137(2):225-233.
[9]Sinclair D.Analytical aspects of thyroid antibodies estimation.Autoimmunity,2008,41(1):46-54.
[10]Sinclair D,Ann Clin Biochem.Clinical and laboratory aspects of thyroid autoantibodies,2006,43(3):173-183.

