中医骨折三期治疗对家兔骨折愈合中VEGF与BMP-2表达影响的实验研究*
毕 锴,温建民△,孙永生,桑志成,徐颖鹏,孙卫东,高国庆,胡海威,董 颖
(1.中国中医科学院望京医院,北京 100102;2.中国中医科学院广安门医院,北京 100053;3.怀柔区卫生局,北京 110000;4.怀柔区社区康复中心,北京 101400)
中医骨折三期治疗原则是中医药治疗骨折的指导原则[1],其治则历史悠久,临床疗效确切,但目前对其作用机制仍存在诸多争论。
本课题组既往研究发现,在家兔骨痂愈合过程中分期治疗组在骨痂形成时间及质量明显优于不分期治疗组,骨折三期治疗组在外骨膜、内骨膜和骨髓组织的VEGF和VEGF mRNA表达的促进作用明显优 于 一 期 治 疗 组[2]。VEGF(Vascular endothelial growth factor血管内皮生长因子)是目前公认最强的促血管形成因子,它可促进新生血管的形成,维持软骨细胞的存活和加快骨转换,其他因子的促血管生成作用是全部或部分通过VEGF的作用得以实现的[3]。而骨的愈合过程中,不可或缺的因子是BMPs(Bone morphogenetic proteins骨形成蛋白),其具有诱导成骨作用。首先是间充质细胞发生化学趋向、聚集、分化形成软骨和骨,最终形成骨髓[4],被公认为是目前最强的骨诱导分化因子,对骨折愈合具有极其重要的调节作用[5],而实验研究较多的是BMP-2。因此,为更进一步从分子生物水平探讨中医骨折分期治疗的作用机制,研究骨折分期的合理方法,本实验对中医分期治疗将VEGF和BMP-2两个因子同时进行分析。
1 材料与方法
1.1 实验设计
动物实验采用随机分组、对照实验研究。
1.2 动物实验
新西兰白兔:健康雄性新西兰家兔(n=132),体质量2kg±0.5kg,由武汉小桂医疗器械有限公司提供(许可证编号SCXK(沪)2007_0003)。动物实验在北京诺赛基因组研究中心有限公司进行,免疫组化检查在北京诺赛基因组研究中心完成。
1.3 分组
用计算机产生随机数字的方法将132只家兔先随机取出6只作为正常对准组,其余家兔(n=126)随机分为3组(n=42/组),分别为中药三期治疗组、中药一期治疗组、模型对照组。每个小组再随机分 7 个小组(n=6/组),分别为第 3、6、9、14、28、42、56天组。
1.4 药物
本实验所用中药方剂由北京嘉事堂连锁药店有限责任公司提供,制成含生药5g/ml的浓缩口服液,灭菌后装瓶冷藏备用。
1.5 试剂
多聚甲醛、戊巴比妥钠:北京市化学试剂公司提供;焦碳酸二乙醋(DEPC,美国 Promega公司生产,天津市颧洋生物制品科技有限责任公司分装);VEGF、BMP-2生物素标记免疫组化试剂盒:美国SANTA CLAUS公司。
1.6 造模
于造模前48h双上肢常规脱毛。以0.3%戊巴比妥钠30mg/kg体重,耳缘静脉注射麻醉。在无菌手术下施术,双上肢常规消毒,于双侧桡骨中下1/3处纵行切开皮肤皮下组织,暴露双侧桡骨中下1/3部位。在旋前圆肌肌止远端用锯造成3mm横断骨折,不做任何固定,生理盐水冲洗切口,逐层缝合切口。术后分笼饲养,常规饲料及饮水。术后肌肉注射青霉素3d,每次40IU,每天1次。
1.7 干预方法
1.7.1 基本方剂组成 本实验三期治疗组所用方剂是基于高等中医药院校统编教材《中医正骨学》中的肢伤一方、二方及三方。①肢伤一方加减:桃仁 10g,红花 6g,当归 12g,赤芍 12g,川芎 12g,黄柏 10g,防风 10g,川萆薢 12g,枳壳 10g,乳香 5g,生地黄12g,生甘草6g;②肢伤二方加减:当归12g,赤芍 12g,续断12g,威灵仙 12g,生薏苡仁 30g,桑寄生30g,骨碎补 12g,五加皮 12g等;③肢伤三方加减:当归 12g,赤芍 12g,续断 12g,威灵仙 12g,骨碎补12g,川木瓜12g,黄芪15g,熟地黄 15g,煅自然铜10g(先煎),土鳖10g等。
1.7.2 分期 将家兔桡骨骨折愈合过程分为三期:早期即血肿机化演进期,骨折后1~7d;中期即原始骨痂形成期,骨折后8-28d;后期即改建塑形期,骨折后28d以后。
1.7.3 三期治疗组 根据中医骨折三期治疗原则,早期活血化瘀、行气止痛,选用加减肢伤一方;中期接骨续筋、舒筋活络,选用加减肢伤二方;后期补益肝肾、强筋壮骨,选用加减肢伤三方。按等效量计算公式5计算(人体体重按照 60 kg),计算模型组给予等量蒸馏水灌胃。

1.7.4 一期治疗组 将骨折早期、中期和后期合并为一期,活血化瘀、行气止痛、接骨续筋、补益肝肾、强筋壮骨,选用加减肢伤一方、二方与三方综合方治疗。
1.7.5 模型对照组 给予与实验组等量的蒸馏水灌胃,每日2次。
1.7.6 模型处理 观察指标与方法:术后第3、6、9、14、28、42、56 天每个实验组随机抽取 1 小组家兔用空气栓塞法处死。取左侧桡骨标本为观察对象,在无菌手术下取出双侧桡骨,用质量分数为40g/L的多聚甲醛在4℃下固定24min。再置于质量分数为15%的 EDTA-Na2(含0.5%多聚甲醛,3%葡聚糖)脱钙28d(每4d更换1次脱钙液)。以骨折为中心取长15mm的骨段,将其置于质量分数为10%的 EDTA-Na2(含1%DEPC)中脱钙(每4d更换1次脱钙液)。脱钙完成后纵行剖开骨段,系列酒精脱水、透明、浸蜡,剖面向下,低熔点石蜡包埋。用Reichert-Jung Histocut 820-Ⅱ病理切片机切成厚度6μm的腊片,将蜡片分别展于经过蛋清甘油或多聚赖氨酸处理的载玻片上,标明相应的号码置于细胞培养箱中,42℃烤片48min。免疫组织化学染色(SP2法)严格按照说明书操作,进行免疫组化染色,观察骨折愈合不同时间点外骨膜、内骨膜和骨髓组织VEGF与BMP-2的表达情况。
1.8 结果判断
细胞浆被染成棕黄色为 VEGF与BMP-2表达阳性,细胞核清晰,外部形状规则,周围轮廓界限分明,具有这些条件的细胞为阳性细胞,未显棕色为阴性。
1.9 免疫组化检查的图像分析
在骨折中心以及两断端附近相同位置采用显微图像采集系统,对免疫组化切片骨折断端附近的外骨膜、内骨膜和骨髓组织各取2个高倍镜视野,并用ImagePro plus 5.0图像分析软件对骨VEGF与BMP-2表达阳性细胞进行光密度(MOD)测定。
1.10 统计学处理
采用 SPSS 16.0统计软件对实验数据进行统计分析,采用一般线性模型的重复测量过程对骨折愈合过程中每种组织 MOD值组间差异进行比较,并应用LSD法对每个时间点组间差异进行比较,结果采用均数±标准差(±s),表示检验水准α=0.05。
2 结果
2.1 骨折愈后不同时间点VEGF表达结果
骨折愈合不同时间点,各组标本VEGF表达测定结果见表1、2、3,骨外膜、骨内膜、骨髓腔的 VEGF表达,在2个中药治疗组术后大部分时间 VEGF表达均高于模型对照组,2个中药治疗组平均 VEGF表达强度均高于模型对照组,且大部分时间点三期组的最高,三期组与一期组和模型对照组比较,差异有统计学意义(P<0.05)。
表1 骨折愈合过程不同时间点各组标本骨外膜VEGF表达(MOD,±s,n=6)

表1 骨折愈合过程不同时间点各组标本骨外膜VEGF表达(MOD,±s,n=6)
注:与模型组比较:*P<0.05,**P<0.01;与一期组比较:◇P<0.05,◇◇P<0.01;与三期组比较:☆P <0.05,☆☆P<0.01
时间 模型组 一期治疗组 三期治疗组3d 0.0649±0.0094 0.0754±0.0062*0.0664±0.0100 6d 0.0611 ±0.0072 0.0611 ±0.0043☆ 0.0716 ±0.0059**◇9d 0.0659 ±0.0021 0.0588 ±0.0033**☆☆ 0.0660±0.0055◇◇14d 0.0585 ±0.0028 0.0591 ±0.0052☆☆ 0.0666±0.0057**◇◇28d 0.0552 ±0.0029 0.0631 ±0.0051**☆ 0.0697 ±0.0079**◇42d 0.0579 ±0.0073 0.0673 ±0.0020* 0.0699±0.0080**56d 0.0603±0.0039 0.0643±0.0062 0.0601±0.0042均值 0.0603±0.0064 0.0642±0.0070**☆ 0.0672±0.0074**◇
表2 骨折愈合过程不同时间点各组标本骨内膜VEGF表达(MOD,±s,n=6)

表2 骨折愈合过程不同时间点各组标本骨内膜VEGF表达(MOD,±s,n=6)
注:与模型组比较:*P<0.05,**P <0.01;与一期组比较:◇P <0.05,◇◇P <0.01;与三期组比较:☆P <0.05,☆☆P<0.01
时间 模型组 一期治疗组 三期治疗组3d 0.0658±0.0068 0.0731±0.0082 0.0859±0.0209**6d 0.0683 ±0.0121 0.0647 ±0.0021☆☆ 0.0841±0.0081**◇◇9d 0.0700±0.0056 0.0672±0.0040 0.0734±0.0077 14d 0.0556± 0.0020 0.0630±0.0062*☆☆ 0.0717±0.0019**◇◇28d 0.0612 ± 0.0047 0.0724 ±0.0091** 0.0769 ±0.0077**42d 0.0649± 0.0032 0.0696±0.0052* 0.0726±0.0044**56d 0.0672± 0.0047 0.0698±0.0052 0.0667±0.0056均值 0.0646±0.0074 0.0686±0.0067**☆☆ 0.0759±0.0112**◇◇
表3 骨折愈合过程不同时间点各组标本骨髓腔VEGF表达(MOD,±s,n=6)

表3 骨折愈合过程不同时间点各组标本骨髓腔VEGF表达(MOD,±s,n=6)
注:与模型组比较:*P<0.05,**P <0.01;与一期组比较:◇P <0.05,◇◇P <0.01;与三期组比较:☆P <0.05,☆☆P<0.01
时间 模型组 一期治疗组 三期治疗组3d 0.0698±0.0064 0.0800±0.0076* 0.0795±0.0048*6d 0.0655 ±0.0095 0.0760 ±0.0071 0.0818±0.0076**9d 0.0721±0.0079 0.0672±0.0054☆ 0.0780±0.0062◇14d 0.0723±0.0087 0.0672±0.0040 0.0718±0.0060 28d 0.0602 ±0.0065 0.0686 ±0.0101* 0.0734±0.0034**42d 0.0643 ±0.0016 0.0663 ±0.0074☆ 0.0729 ±0.0033**◇56d 0.0658±0.0016 0.0688±0.0035☆☆ 0.0632±0.0031◇◇均值 0.0668±0.0076 0.0705±0.0079*☆☆ 0.0744±0.0075**◇◇
2.2 骨折愈合不同时间点BMP-2表达结果
表4~6显示,骨外膜、骨干细胞、骨小梁等组织BMP-2免疫组化染色结果显示,2个中药治疗组术后大部分时间,BMP-2表达均高于模型对照组,2个中药治疗组平均 VEGF表达强度均高于模型对照组,而大部分时间点三期组最高,三期组、一期组和模型对照组比较差异有统计学意义(P<0.05)。
3 讨论
3.1 对中医骨折三期分治的不同观点
中医骨折分治的疗效在临床中早已证实,在作用机制方面的研究较为少见,而部分学者将骨折三期改为一期治疗,取得了较为突出的疗效。如单味药物或者单方加减实验研究。也有学者将骨折中期和后期合并为一期用药,也能促进生长因子的表达,进而促进骨折愈合作用,因而认为三期分治过于复杂,没有必要辨证论治。从而骨折三期治疗出现骨折一二三期治疗混乱的情况,这使得骨折三期治则受到严重考验,对中医骨伤科学的发展也是不利的局面。目前较为多见的实验也多为临床疗效评价及观察,并没有多阶段的动物实验研究。即使是动物试验往往多于单生长因子的表达,且往往都是试验组与空白对照组之间比较,这样只能说明药物组对骨折有促进作用,但不能充分说明骨折三期的治疗机制及分期的必要性。
表4 骨折愈合过程不同时间点各组标本骨外膜BMP-2表达(MOD,±s,n=6)
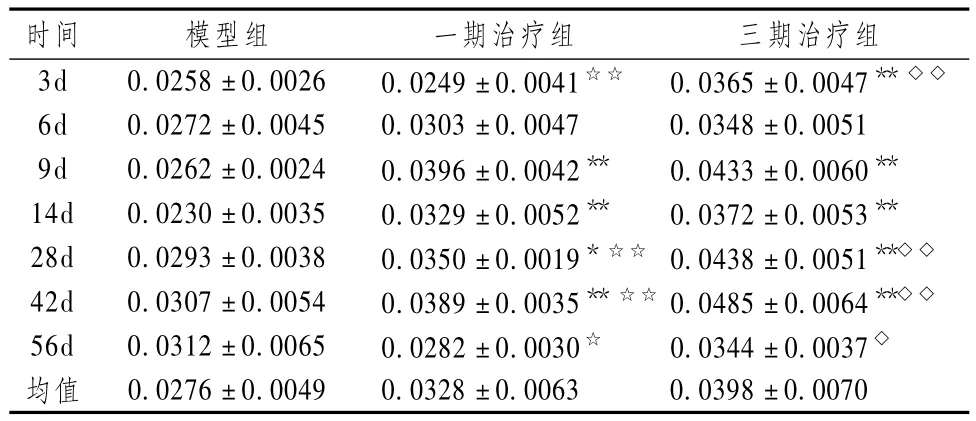
表4 骨折愈合过程不同时间点各组标本骨外膜BMP-2表达(MOD,±s,n=6)
注:与模型组比较:*P <0.05,**P <0.01;与一期组比较:◇P <0.05,◇◇P <0.01;与三期组比较:☆P<0.05,☆☆P<0.01
时间 模型组 一期治疗组 三期治疗组3d 0.0258±0.0026 0.0249±0.0041☆☆ 0.0365±0.0047**◇◇0.0276±0.0049 0.0328±0.0063 0.0398±0.0070
表5 骨折愈合过程不同时间点各组标本骨内膜BMP-2表达(MOD,±s,n=6)
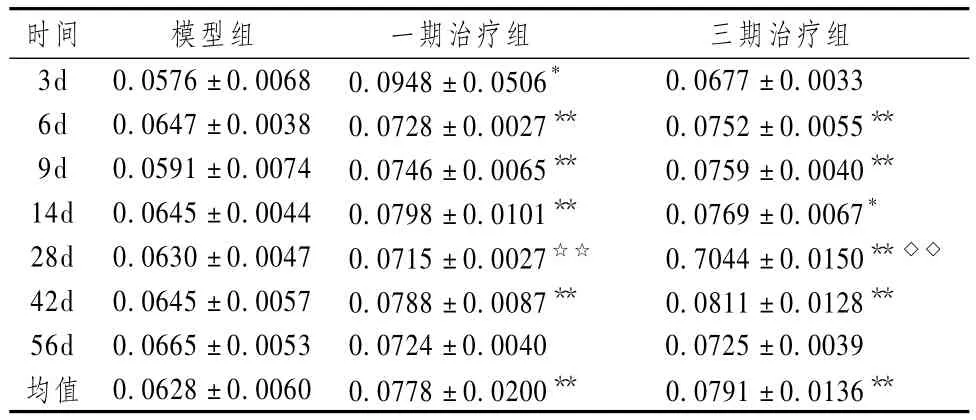
表5 骨折愈合过程不同时间点各组标本骨内膜BMP-2表达(MOD,±s,n=6)
注:与模型组比较:*P <0.05,**P <0.01;与一期组比较:◇P <0.05,◇◇P <0.01;与三期组比较:☆P<0.05,☆☆P<0.01
?
表6 骨折愈合过程不同时间点各组标本骨髓腔骨BMP-2表达(MOD,±s,n=6)

表6 骨折愈合过程不同时间点各组标本骨髓腔骨BMP-2表达(MOD,±s,n=6)
注:与模型组比较:*P <0.05,**P <0.01;与一期组比较:◇P <0.05,◇◇P <0.01;与三期组比较:☆P<0.05,☆☆P<0.01
时间 模型组 一期治疗组 三期治疗组3d 0.1035±0.0171 0.1440±0.0190** 0.1528±0.0102**6d 0.1417±0.0042 0.1546±0.0163 0.1517±0.0118 9d 0.1585±0.0056 0.1485±0.0236 0.1669±0.0187 14d 0.1360±0.0172 0.1680±0.0149* 0.1838±0.0341**28d 0.1512±0.0212 0.1564±0.0191☆ 0.2008±0.0630*◇42d 0.1673±0.0055 0.1855±0.0145 0.2110±0.0811 56d 0.1547±0.0168 0.1779±0.0122 0.1704±0.0262均值 0.1447±0.0236 0.1621±0.0216**☆ 0.1768±0.0452**◇
3.2 中医骨折分期治疗的必要性
现在医学研究表明,不同中药在骨折愈合过程中促进骨折愈合的机制不同。海螵蛸、水蛭对血管形成有促进作用,阿胶、骨碎补和海螵蛸对骨折软骨形成早期具有促进骨诱导的作用,并对成骨细胞的增殖及合成活性有较大影响[6]。
骨折愈合早期即炎症反应期的主要病理变化是骨折端血肿形成,炎性细胞的浸润,骨折端血肿大小将直接影响来自软组织新生血管形成及完成机化的时间。骨折愈合早期给予活血化瘀药物,如桃仁、红花、当归、赤芍、川芎等均有明显的抗血小板凝聚、抗血栓形成的作用,可以改善骨折断端局部血液供应状态,加快软组织的损伤修复和水肿的吸收,从而促进了骨折的愈合[7]。
本实验的2种分期方法中,在促进骨折局部VEGF表达方面,无论是VEGF表达总体平均水平、峰值持续时间,三期组都明显强于一期组。而在促进骨折愈合的BMP-2表达影响方面,三期组也明显强于一期组,说明三期治疗在VEGF和BMP-2表达较一期治疗更具优势。针对骨折不同阶段进行辨证施治,选用不同中药进行干预,对于骨折的愈合起到促进作用,使其发挥有效作用的,主要是针对骨折愈合过程中促进VEGF和BMP-2基因表达影响起到了关键作用,所以骨折分期治疗是非常必要的。
3.3 中医三期分治的作用机制
现代研究表明,骨折愈合是一种复杂的生理过程,骨组织的愈合是骨折或者骨缺损的修复过程,骨质的完全修复需要局部生长因子的调控。局部骨生长因子调控着骨折的整个修复过程,决定着骨折修复的速度与质量[8,9]。
VEGF是Ferrara等[10]在牛垂体星状细胞体外培养分离出的一种糖蛋白,它在体内外均可特异性地促进血管内皮的生长并诱导血管生成,故此得名。VEGF是目前公认最强的促血管形成因子,是促血管再生的最终通道[2]。
而BMPs为骨折愈合的启动因子,能诱导血管周围游走的、未分化的间充质细胞分化增殖为成骨细胞或成软骨细胞,决定着间充质细胞的分化方向,诱导间充质细胞不可逆地向软骨细胞和骨细胞方向分化,被公认为是目前最强的骨诱导分化因子[11],促进成骨细胞分化和刺激胶原合成,以软骨内骨化方式促使新骨形成。
从实验结果来看,首先,VEGF表达在骨折愈合早期-外骨膜VEGF术后第3天迅速升高,术后第6天VEGF表达有所下降,而三期治疗组成术后第3天较低,第6天呈升高趋势,说明活血化瘀使血脉通畅,改善了骨折端外骨膜的血供状态,从而使VEGF表达峰值提前。但是在骨内膜和骨髓腔表现出VEGF表达三期治疗组明显高于一期治疗组和模型组,可能由于三期治疗促进血管再生、间充质细胞分化等因素所致。骨折愈合中期,无论内骨膜还是外骨膜VEGF表达三期组均强于其他组,可能因为此时为血管重建的重要时期,三期治疗促进了VEGF表达,进而促进了骨折愈合。骨折愈合后期,骨外膜、骨内膜及骨髓腔VEGF表达有所下降,此期为骨痂改建塑形期,虽然VEGF表达有所下降,但三期治疗组仍为最高值到56d后才降至最低。其次,BMP-2表达在骨折愈合早期,外骨膜BMP-2表达第3天较低,但第6天升高,而三期组在第3天升高,第6天有所下降,但在骨内膜和骨髓腔,三期治疗组却呈起步高的趋势,可能是活血化瘀较强对骨折端外部诱导不明显,而对骨内部的诱导分化影响显著。骨折中期为骨痂形成初期,无论骨外膜、骨内膜还是骨髓腔,BMP-2表达中药治疗组均强于模型组,可能间充质细胞发生化学趋向、聚集,进而形成骨和软骨的过程,正是接骨续筋的时期。骨折后期,骨外膜、骨内膜及骨髓腔的BMP-2表达三期组仍优于其他2组,且三期组出现峰值阶段,可能由于强筋壮骨中药促进BMP-2表达,进而促使了骨髓形成。
综上所述,三期治疗组通过对骨折的分期辨证施治,即早期活血化瘀、行气止痛,中期接骨续筋、舒筋活络,后期补益肝肾、强筋壮骨。而一期组将三期组分治为一期,虽然也能促进骨折愈合,但对于骨折的整个过程略显机械化。而对于骨折愈合过程中,各阶段促进血管形成及骨诱导分化两大因子VEGF及BMP-2表达的影响也不及三期组,因此更充分地说明了骨折分期治疗骨折的必要性。
[1]孙永生,徐颖鹏,温建民,等.中药不同分期对实验性SD大鼠骨折愈合过程中成纤维细胞生长因子-2表达的作用[J].中华中医药杂志,2010,25(9):1472-1476.
[2]徐颖鹏,温建民,董建文,等.中医骨折三期治疗对家兔骨折骨膜组织中 VEGF及 VEGFmRNA表达的影响[J].中国骨伤,2010,23(2):120-124.
[3]Farso Nielsen F,Karring T,Gogolewski S.Biodegradable guide for bone regeneration.Polyurethane membranes tested in rabbit radius defects[J].Acta Orthop Scand,1992,63(1):66.
[4]张永刚,卢世璧,王继芳.骨引导与骨诱导[J].中华创伤杂志,1996,12:332-333.
[5]Sykaras N,Opperman LA.Bone morphogenefic proteins(BMPs):how do they function and what can they offer the clinician[J].J Oral Sci,2003,45(2):57-73.
[6]董福慧,金宗濂,郑军,等.4种中药对骨愈合过程中相关基因表达的影响[J].中国骨伤,2006,19(10):595.
[7]温建民,徐颖鹏,孙永生,等.中医骨折分期治疗对骨折愈合作用的 X线与组织学研究[J].中国骨伤,2006,10(19):604-607.
[8]孙永生,温建民,吴林生,等.骨折三期治疗对骨生长因子FGF-2表达影响的实验研究[J].中国骨伤,2004,17(4):222-226.
[9]孙永生,温建民,吴林生.血小板源性生长因子在骨修复中的作用及应用研究[J].中国骨伤,2004,17(6):382-384.
[10]Ferrara N,Henzel WJ.Pituitary follicular cells secrete a novel heparinbinding growth factor specific for vascular endothelial cells[J].Biochem Biophys Res Commun,1989,161:851-858.
[11]SykarasN, Opperman LA. Bone morphogenetic proteins(BMPs):how do they function and what can they offer the clinician[J].Oral Sci,2003,45(2):57-73.

