微透析法研究针刺后中缝背核单*胺类神经递质含量的动态变化
王 慧,王 旭,唐卉凌,白丽敏
(1.贵州省贵阳中医学院基础部,贵阳 550002;2.北京中医药大学基础医学院科研实验中心,北京 100029)
睡眠占据人类生命1/3左右的时间,睡眠障碍常导致中枢神经系统功能活动与内脏功能活动紊乱,严重影响人类的健康和工作能力。脑内的单胺类神经递质包括5-羟色胺(5-HT)、去甲肾上腺素(NE)和多巴胺(DA)已经被证明与睡眠和觉醒具有密切关系。临床研究已证实,针刺对睡眠障碍具有良好的治疗作用[1-2],但针刺如何影响活体中枢单胺类递质活动变化目前尚未明确,故我们采用微透析法研究针刺“神门”穴及“命门”穴后中缝背核单胺类神经递质活动变化,比较针刺不同经穴脑内单胺类递质含量变化的差异,为针刺治疗失眠症的临床运用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级SD雄性大鼠21只,体重160g±20g,由北京维通利华动物有限公司提供(动物许可证号SCXK(京)2006-0009)。
1.1.2 仪器和设备 脑立体定位仪(Small Animal Stereotaxic Frame,美国 ASI INSTRUMENTS);色谱仪(1100LC型,美国 Agilent);色谱泵(G1311A型,美国 Agilent);自动进样器(G1313A型,美国 Agilent);色 谱 柱:HPLC ColumnC18(2.1mm ×100mm,3μm,德国 SYKAM);电化学检测器(DECADEⅡSDC型,荷兰 ANTEC),铂金电极,动物微透析系统(美国BAS);微透析管(Microdialysis Probe,瑞典 CMA),微透析灌注泵(Baby Bee,美国BAS),冷却微量收集器(Honey Comb,美国 BAS)。针具:0.40mm×25mm环球牌无菌针灸针。
1.1.3 药品与试剂 5-HT、NE、DA和Homovanillic acid(HVA)标准品购自 Sigma公司。色谱级甲醇(Fisher)、磷酸二氢钠、辛烷磺酸钠、乙二胺四乙酸、氯化钾均为分析纯(Alfa Aesar)。实验用水为超纯水。
1.2 方法
1.2.1 动物分组及针刺方法 雄性SD大鼠21只随机分为空白对照组、针刺“神门”组和针刺“命门”组,每组7只。根据郭义主编的《实验针灸学》[3],并以比较解剖和骨度分寸法取穴,用0.35×25mm规格毫针,手针刺激“神门”穴位,直刺约1mm;“命门”穴位,直刺约5mm~6mm;持续20min。
1.2.2 微透析管的埋置和微透析液的收集动物用20%氨基甲酸乙酯(1g/kg)腹腔注射麻醉后,俯卧位固定于立体定位仪上。用颅骨钻钻开一直径为2mm的颅窗,仔细挑破硬脑膜,按照Paxinos和watson大鼠脑立体定位图谱将微透析管插入DRN(AP: -7.3mm,L/R 0.0 mm、H:6.4mm)。微透析管膜长3mm,外径为0.5mm。用Ringer氏液以2μl/min的速度灌流,每 20 min收集一管透析液(40μl)。微透析管置入60min后正式收集微透析液,以取得稳定的基础值。针刺前40min收集2次作为对照,然后收集针刺结束后 20、40、60、80、100、120min,共2h各时相点的透析液,用于测定5-HT、NE、DA和HVA的含量。样本收集器的温度设定为4℃。收集完毕后的微透析液样品置于-80℃冰箱保存。
1.2.3 单胺类神经递质的测定 利用Agilent 1100LC型高效液相色谱仪系统测定透析液中5-HT、NE、DA和 HVA。流动相:磷酸二氢钠:100mM,辛烷磺酸钠:0.74mM,乙二胺四乙酸:0.027mM,氯化钾:8mM,甲醇 10%,流速0.2ml/min。
1.2.4 探针回收率的测定 将探针置入0.34ng/μl的混合对照品液中,以与脑内微透析相同的灌流液、流速和间隔时间收集体外透析液,并按前述色谱条件进行测定,计算各物质的相对回收率分别为5-HT:11.99%、NE:13.06%、HVA:13.19%、DA:14.23%。
1.2.5 组织学鉴定 大鼠在实验结束后,用外径为0.3mm的单级不锈钢电极插入引导管通以3 mA阳极直流电10s电损毁中缝背核,取脑置于4%多聚甲醛溶液,2d后做脑组织切片,观察引导管轨迹顶部是否位于DRN,仅对定位准确的大鼠实验数据进行统计。
2 结果
2.1 针刺“神门”和“命门”穴对中缝背核5-HT含量的影响
表1显示,针刺“神门”穴和“命门”穴后 20 min,中缝背核5-HT含量明显下降,与对照组相比,针刺后各时相点之间5-HT含量差异有统计学意义(P<0.001)。与针刺前的基础水平相比,针刺“神门”穴和“命门”穴后20min 5-HT水平显著下降(P<0.01),在其后的2h维持在低水平,针刺“神门”穴与“命门”穴所引起的中缝背核5-HT含量变化之间并无显著性差异,提示针刺“神门”穴和“命门”穴能降低中缝背核5-HT含量,且持续时间长于2h。
表1 各组大鼠不同时间点中缝背核5-HT含量变化比较(pg/μl,±s)
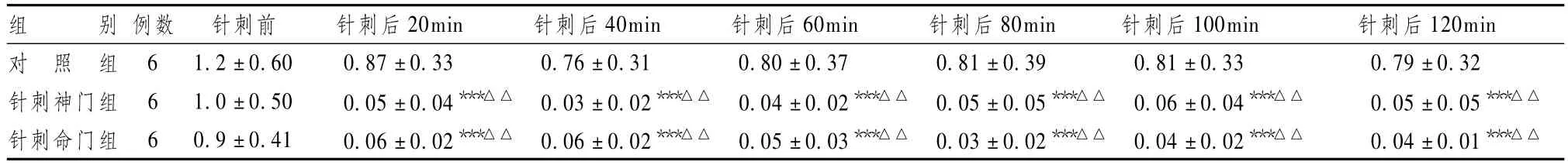
表1 各组大鼠不同时间点中缝背核5-HT含量变化比较(pg/μl,±s)
注:与对照组同一时间点比较:***P<0.001;与本组刺激前比较:△△P<0.01
组 别 例数 针刺前 针刺后20min 针刺后40min 针刺后60min 针刺后80min 针刺后100min 针刺后120min对 照 组 6 1.2±0.60 0.87±0.33 0.76±0.31 0.80±0.37 0.81±0.39 0.81±0.33 0.79±0.32针刺神门组 6 1.0 ±0.50 0.05 ±0.04***△△ 0.03 ±0.02***△△ 0.04 ±0.02***△△ 0.05 ±0.05***△△ 0.06 ±0.04***△△ 0.05 ±0.05***△△针刺命门组 6 0.9 ±0.41 0.06 ±0.02***△△ 0.06 ±0.02***△△ 0.05 ±0.03***△△ 0.03 ±0.02***△△ 0.04 ±0.02***△△ 0.04 ±0.01***△△
2.2 针刺“神门”和“命门”穴对中缝背核 NE含量的影响
表2显示,针刺“神门”穴后 20min,中缝背核NE含量明显下降,与对照组相比,针刺后20、40、60、80、100min各时相点之间NE含量差异有统计学意义,但针刺“神门”120min时相点NE含量差异无统计学意义。针刺“命门”穴后20min,中缝背核NE含量明显下降,与对照组相比,针刺后各时相点之间NE含量差异有统计学意义。与针刺前的基础水平相比,针刺“神门”穴和“命门”穴后20minNE水平显著下降(P<0.01),在其后的2h维持在低水平。针刺“神门”穴与“命门”穴所引起的中缝背核 NE含量变化之间在针刺40min时相点处(针刺神门穴后NE含量较低)具有显著性差异(P<0.05),其余各时相点无显著性差异。提示针刺“神门”穴和“命门”穴能降低中缝背核 NE含量,针刺“神门”穴降低NE含量的作用在针刺1h内可能强于“命门”穴,但持续的时间较“命门”穴短。
表2 各组大鼠不同时间点中缝背核NE含量变化比较(pg/μl,±s)
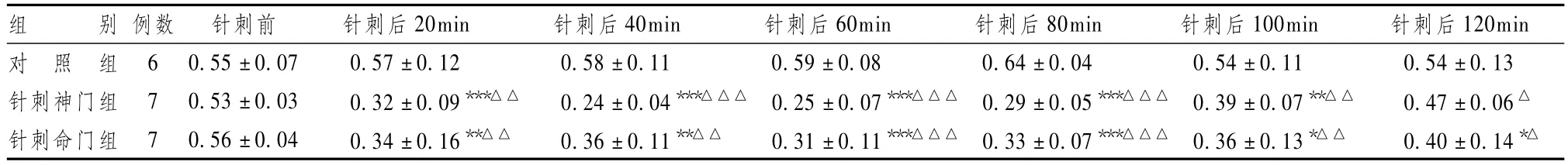
表2 各组大鼠不同时间点中缝背核NE含量变化比较(pg/μl,±s)
注:与对照组同一时间点比较:*P <0.05,**P <0.01,***P <0.001; 与本组刺激前比较:△P <0.05,△△P <0.01,△△△P <0.001
组 别 例数 针刺前 针刺后20min 针刺后40min 针刺后60min 针刺后80min 针刺后100min 针刺后120min对 照 组 6 0.55±0.07 0.57±0.12 0.58±0.11 0.59±0.08 0.64±0.04 0.54±0.11 0.54±0.13针刺神门组 7 0.53 ±0.03 0.32 ±0.09***△△ 0.24 ±0.04***△△△ 0.25 ±0.07***△△△ 0.29 ±0.05***△△△ 0.39 ±0.07**△△ 0.47 ±0.06△针刺命门组 7 0.56±0.04 0.34±0.16**△△ 0.36±0.11**△△ 0.31±0.11***△△△ 0.33±0.07***△△△ 0.36±0.13*△△ 0.40±0.14*△
2.3 针刺“神门”和“命门”穴对中缝背核HVA含量的影响
表3显示,本研究在中缝背核未检测出DA,但我们检测到DA的代谢产物 HVA。针刺“神门”穴和“命门”穴后20min,中缝背核 HVA含量明显下降,与对照组相比,针刺后各时相点之间含量差异有统计学意义。与针刺前的基础水平相比,针刺“神门”穴和“命门”穴后20min HVA水平显著下降(P<0.01),在其后的2h维持在低水平,针刺“神门”穴与“命门”穴所引起的中缝背核HVA含量变化之间并无显著性差异,提示针刺“神门”穴和“命门”穴能降低中缝背核HVA含量,且持续时间长于2h。
表3 各组大鼠不同时间点中缝背核HVA含量变化比较(pg/μl,±s)

表3 各组大鼠不同时间点中缝背核HVA含量变化比较(pg/μl,±s)
注:与对照组同一时间点比较:*P <0.05,**P <0.01,***P <0.001; 与本组刺激前比较:△△P <0.01
组 别 例数 针刺前40min 针刺后20min 针刺后40min 针刺后60min 针刺后80min 针刺后100min 针刺后120min对 照 组 6 18.95±4.11 17.97±4.01 17.31±3.20 17.64±4.24 17.13±3.95 18.86±4.13 18.09±4.54针刺神门组 7 18.64 ±2.50 12.63 ±2.10**△△ 11.44 ±3.51**△△ 11.09 ±2.56**△△ 10.44 ±2.20**△△ 10.45 ±3.23***△△ 9.96 ±2.38***△△针刺命门组 7 18.65±4.47 13.30±2.43*△△ 12.90±2.28**△△ 10.64±2.61**△△ 10.06±2.10***△△ 10.48±1.29***△△ 9.97±3.01**△△
3 讨论
睡眠障碍严重影响人类的身心健康[4]。大量的临床及实验研究已经证明,针刺治疗睡眠障碍类疾病具有较好的疗效,但是其作用机制目前尚未明确。中枢神经系统中的单胺类神经递质在睡眠与觉醒的调节中发挥着重要的作用。以往的研究通常采用分析脑匀浆或脑脊液中生化物质的含量来进行,这些方法不能直接反映活体细胞外液中生化物质的动态变化,从而限制了对脑细胞直接生存的微环境的研究。微透析技术能在脑组织损伤极小的情况下,准确地监测生理及病理状态下细胞外液中化学物质浓度的动态改变[5],故本研究运用微透析法连续2h观察了针刺大鼠“神门”穴及“命门”穴后中缝背核单胺类神经递质的动态变化。研究结果显示,针刺“神门”及“命门”穴可明显降低大鼠中缝背核细胞外液中5-HT、NE和HVA含量。
5-HT是一种重要的神经递质,在睡眠调节中起到重要作用。实验证明,在觉醒时5-HT神经元的兴奋性最高,进入非快速眼动睡眠期(NREM)后其兴奋性下降,在快速眼动睡眠期(REM)其兴奋性最低[6]。DRN是中枢神经系统中富含5-HT能神经元的一个重要核团,其纤维投射到丘脑、下丘脑、海马、基底神经节和大脑皮层,DRN的神经元投射到上位中枢主要形成慢波睡眠(SWS)和触发快波睡眠(FWS)[4]。目前已经明确中脑蓝斑核(LC)的去甲肾上腺素能神经元的纤维投射到DRN,从而影响5-HT神经元的活动[7-8]。LC是脑内最重要的 NE能神经中枢,一般来说,LC的神经元放电活动在SWS时减少,在REM时放电停止。REM睡眠被剥夺时,LC放电活动仍然持续;α1受体激动剂可减少大鼠REM睡眠,LC局部注射α2受体激动剂能非常显著地减少REM睡眠,说明LC的NE能神经元与REM的产生密切相关[9]。实验证实,去甲肾上腺素能传入纤维通过α1受体从而激活DRN的5-HT能神经元放电活动[10],α2受体被激活则减少 DRN5-HT的合成[11]。我们以往的实验证实,针刺能降低 LC神经元的放电活动[12]。本实验发现,针刺能降低DRN内5-HT和NE的含量,提示针刺可能通过改变LC神经元的活动,从而影响DRN内NE神经递质,进而改变DRN内5-HT的含量,影响到其投射区皮层的活动。
目前已明确,黑质的DA递质系统在维持行为觉醒机制中的重要作用[7],中枢神经系统的 DA神经元主要集中在黑质致密区和中脑腹侧被盖区,其末梢分别投射到纹状体、边缘系统和大脑皮层,许多精神运动兴奋剂引起的觉醒效应主要是通过多巴胺及其受体而发挥作用。本次实验中我们在中缝背核未能检出DA,可能是活体对该神经递质的灭活与再摄取使其在DRN含量过低,由于DA可在单胺氧化酶的作用下最终转化为高香草酸(HVA),本实验在DRN检出了DA的代谢产物HVA,且针刺后该物质含量显著下降,说明中缝背核神经元的活动与DA也有一定关系。但由于递质作用的复杂性,DA与5-HT能神经元之间如何相互协同,还有待于我们进一步了解。
中医理论称失眠症为不寐,其病因病机乃各种原因导致的阴阳失调,治疗的关键在于调节阴阳、疏通经络,恢复正常功能。神门具有宁心安神、通经活络的作用,是临床常用的治疗失眠症的穴位。命门穴属督脉,督脉因其“总督诸阳”,具有整体调整作用而多被使用。本研究结果提示,针刺神门和命门穴能通过改变中脑中缝背核神经递质含量,从而起到调节睡眠的作用,针刺神门和命门穴引起的单胺类递质含量变化差异不大。该结果为针刺治疗睡眠障碍类疾病提供了科学的依据。
[1]白 妍,金春玉,东贵荣.神门穴为主针刺治疗失眠症56例临床观察[J].针灸临床杂志,2004,20(4):41-42.
[2]王如杰.针刺申脉照海治疗顽固性失眠40例临床观察[J].四川中医,2008,26(4):123.
[3]郭 义.实验针灸学[M].北京:中国中医药出版社,2008:417.
[4]李国彰.神经生理学[M].北京:人民卫生出版社,2007:329-335.
[5]刘明芳,东贵荣,阎成海.微透析技术及其在中医药研究中的应用[J].中医药信息,2007,24(4):1-3.
[6]Carlson,N.R.Foundations of Physiological Psychology(Sixth Edition)[M].北京:中国轻工业出版社,2007:181.
[7]Luppi PH,Aston-Jones G,Akaoka H,et al.Afferent projections to the ratlocuscoeruleusdemonstrated by retrograde and anterograde tracing with cholera-toxin B subunit and Phaseolus vulgaris leucoagglutinin[J].Neuroscience,1995,65:119-160.
[8]Kim MA,Lee HS,Lee BY,et al.Reciprocal connections between subdivisions of the dorsal raphe and the nuclear core of the locus coeruleus in the rat[J].Brain Res 2004,1026:56-67.
[9]Mallick,BN, Majumdar, S, Faisal, M, etal. Roleof norepinephrine in the regulation of rapid eye movement sleep[J].J.Biosci.,2002,27(5):539-551.
[10]AdellA, Artigas F. Regulation of the release of 5-hydroxytryptamine in the median raphe nucleus of the rat by catecholaminergic afferents[J].Eur J Neurosci.,1999,11(7):2305-11.
[11]Yoshioka M, MatsumotoM, TogashiH, etal. Alpha 2-adrenoceptor modulation of 5-HT biosynthesis in the rat brain[J].Neurosci.Lett.,1992,139:53-56.
[12]Wang H,Tanaka Y,Seki H,et al.Acupuncture stimulation to the sacral segent affects state of vigilance in rats[J].Neurosci.Res.,2007,57(4):531-537.

