一种果胶酶生产菌株的分离及其产酶条件优化
苏腾甲,朱雄伟,张佑红,刘 芬,刘婷婷,徐智鹏,李卫朋
(武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北武汉 430074)
一种果胶酶生产菌株的分离及其产酶条件优化
苏腾甲,朱雄伟,张佑红*,刘 芬,刘婷婷,徐智鹏,李卫朋
(武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北武汉 430074)
为了从自然界中寻找一种果胶酶生产菌株,在果胶平板上经过筛选、复筛,分离出产果胶酶生产菌株,并将分离得到的菌株在摇瓶发酵培养、测定其酶活力,其发酵培养基的初始pH、最适温度、最适接种量及发酵周期进行初步研究.结果表明:经过筛选得到的产果胶酶菌株在发酵培养基的初始pH为7.0、培养温度为33℃、接种量为30%、发酵周期为56 h时,此菌株产酶的酶活力最高,优化后的条件大大提高了菌株的产酶能力.
果胶酶生产菌株;纯化;发酵;产酶条件优化;酶活力
0引言
果胶酶是指分解果胶的一种多酶复合物,通常包括原果胶酶、果胶甲酯水解酶、果胶酸酶,通过它们的联合作用使果胶质得以完全分解[1].天然的果胶质在原果胶酶作用下,转化成水溶性的果胶;果胶被果胶甲酯水解酶催化去掉甲酯基团,生成果胶酸;果胶酸经果胶酸水解酶类和果胶酸裂合酶类降解生成半乳糖醛酸,果胶酶广泛应用于食品工业、饲料工业、造纸工业和纺织工业中[2].
尽管自然界中天然果胶酶广泛存在于动植物体内,但其产量较低、难以大规模提取,所以寻求果胶酶的生产方法意义重大.其中,采用微生物发酵的方法,从微生物的代谢产物中提取果胶酶的方法,受到越来越多的关注[3].本研究从自然界中采样,筛选出可以产生果胶酶的菌株,经过摇瓶发酵产果胶酶,并通过对发酵条件的优化,使果胶酶的产量得到提高.筛选得到的菌株发酵产生的果胶酶可以直接应用于生物脱胶技术.
1 实验部分
1.1 材料
1.1.1 样品 从咸宁瑞丰苎麻有限公司3号污水处理池采集土样.
1.1.2 试剂与仪器 果胶(美国Sigma公司生产),DNS,pH计,电子天平,2001型振荡愠温培养
箱,水平离心机,立式压力蒸汽灭菌锅,岛津紫外UV-1800分光光度计.
1.1.3 培养基 富集培养基:蛋白胨质量分数2.0%,氯化钠质量分数0.5%,牛肉膏质量分数0.5%,果胶质量分数0.5%,琼脂质量分数2%;选择培养基A:果胶质量分数0.5%,蛋白胨质量分数1%,氯化钠质量分数0.5%,琼脂质量分数2%;选择培养基B:磷酸氢二钾质量分数0.1%,硫酸镁质量分数0.5%,硝酸钠质量分数3%,硫酸亚铁质量分数0.01%,果胶质量分数5%,琼脂质量分数2%;种子培养基:果胶质量分数0.5%,蛋白胨质量分数1%,氯化钠质量分数0.5%;发酵培养基:果胶质量分数0.5%,蛋白胨质量分数1%,氯化钠质量分数0.5%.
1.2 方法
1.2.1 筛选路线 采样土样→富集培养→初筛培养→复筛培养→种子罐培养→发酵罐培养→菌种保存.
1.2.2 筛选方法 a.富集培养:将采集到的土样取样10 g,放入盛90 mL无菌水并带有玻璃珠的三角烧瓶中,振荡摇约20 min,使土样与水充分混合,配制成土壤悬液.用一支1 mL无菌吸管吸取1 mL土壤悬液加入到9 mL无菌水的大试管中充分混匀,此为 10-1稀释液,以此类推配制成 10-2、10-3、10-4、10-5、10-6几种稀释度的土壤溶液.将以上的几种稀释度的土壤溶液,分别置于含有富集培养基的平板中进行培养.35℃培养1~2 d,进行多次富集培养,筛选出生长良好的菌株[3].
b.初筛培养:取在富集培养基生长良好的菌株,用无菌水稀释后涂布于选择培养基 A中,35℃培养1~2 d,选取生长良好的菌株,进行复筛培养.
c.复筛培养:取在选择性培养基A生长良好的菌株,用无菌水稀释后涂布于选择培养基B中,35℃培养1~2 d,选取生长良好的菌株,并进行多次复筛培养,筛选出优良菌株.
d.种子罐培养:经过复筛得到的菌株,置于250 mL摇瓶中35℃培养2~3 d,摇床转速为120 r/min.种子罐培养的目的是使菌种量最大化,进而有足够的菌种进行发酵罐培养.
e.发酵罐培养:种子罐得到的菌种液按8%的菌种量接种于发酵培养基中,进行菌株的发酵培养.
1.2.3 酶活力的测定 a.葡萄糖标准曲线的绘制:采用标准曲线法,配制已知浓度的标准葡萄糖溶液,用分光光度计在540 nm处测定其吸光度,以吸光度(A)为横坐标、每毫升溶液葡萄糖毫克数(C)为纵坐标,作A与C标准曲线.
b.菌株发酵液中酶液的提取:取适量发酵液置于15 mL离心管中,5 000 r/min离心15 min,上清液即为酶液.
c.酶活力的测定:取一个15 mL离心管加入l% 的果胶溶液1.0 mL,50℃预热3 min、加酶液0.2 mL、混合、50 ℃ 水解 10 min,加 DNS 试剂3 mL,混合后于沸水浴中10 min,冷却定容至15 mL,并用等量的发酵培养基0.2 mL空白调零,540 nm下测定吸光度值.
酶活力E=(194/180×C×1 000)/(0.2×10)
通过测定上述发酵上清液对果胶的降解液的吸光度A,再由葡萄糖标准曲线得到标准方程,得到果胶酶分解果胶得到的半乳糖醛酸的量经过换算得到的葡萄糖的量C.
194/180为葡萄糖换算成半乳糖醛酸的量.
在以上测定条件下,1 min水解果胶产生1 μg还原糖(以半乳糖醛酸计),所需酶量定义为1个酶活力单位(U).
d.产酶条件的研究:将筛选得到的产果胶酶菌株进行发酵培养,并对其发酵培养基的初始pH、培养温度、接种量和发酵周期的研究,从而可以得到使此菌株产果胶酶的最佳产酶培养条件.
2 结果与分析
2.1 葡萄糖标准曲线
葡萄糖量与吸光度的关系曲线:横坐标为每毫升溶液葡萄糖毫克数(mg/mL),纵坐标为吸光度(A).如图1所示.

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 酶活力测定
经摇瓶发酵得到的酶液测定其吸光度A0,相对应的半乳糖醛酸量G,经过计算得到的酶活力E.如表1所示.
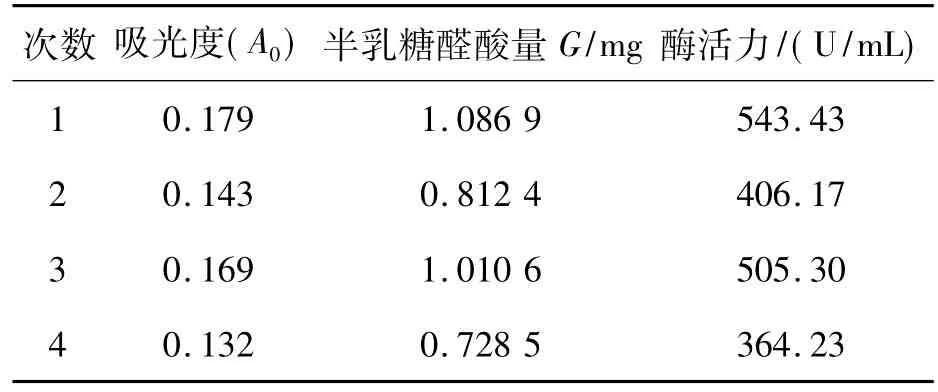
表1 酶液的吸光度A0、半乳糖醛酸量G和酶活力E Table 1 Absorbance A0,galactose uronic acid amount G,enzyme activity E of pectinase
由表1结果表明经过筛选得到的菌株有产果胶酶的能力,此菌株呈梭形短杆状,菌落边缘光滑,为革兰氏阴性,属细菌类.
2.3 产果胶菌株发酵培养条件的优化
2.3.1 发酵培养基初始pH对产酶的影响 在培养时间48 h、培养温度30℃、接种量相同的条件下,转速为120 r/min时,测定不同发酵培养基初始pH对菌株产果胶酶的酶活力变化.由图2可知,发酵培养基初始pH为7.0左右,即中性pH条件下,菌株产酶效率高.pH值可以影响发酵培养基中某些成分解离,同时也影响着酶的活性,pH过高或者过低都会影响酶的产量.
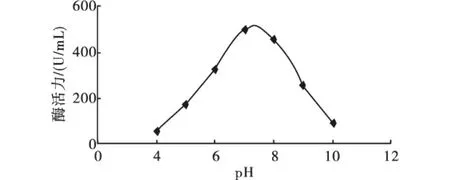
图2 发酵培养基初始pH对产酶的影响Fig.2 Effect of fermentation medium initial pH on enzyme producing
2.3.2 培养温度对酶活力的影响 在发酵培养基初始pH为7.0、转速12 r/min、接种量相同的情况下,培养48 h时,测定不同培养温度对菌株产果胶酶的酶活力变化,见图3.

图3 培养温度对发酵的影响Fig.3 Effect of culture temperature on enzyme producing
如图3所示,菌株培养温度在33℃左右时,菌株产酶效率高.温度过高或过低,都会影响酶活力,温度影响着菌株的繁殖和酶的产量.
2.3.3 接种量对产酶的影响 在发酵培养基初始pH为7.0、培养温度30℃、转速120 r/min、培养48 h的条件下,控制接种量为平时的10%,20%,30%,40%,50%,60%测定菌株的产酶效果变化,见图4.
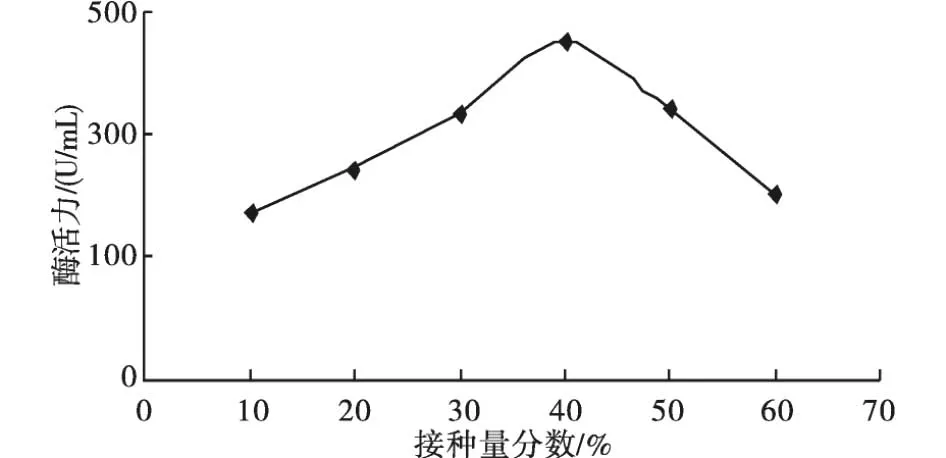
图4 接种量对产酶的影响Fig.4 Effect of inoculation amount on enzyme producing
如图4所示,接种量为平时接种量的40%时,酶活力达到最高.接种量过低,菌株的生长时间较长,酶活较低;接种量过大时,造成短时间积累大量次级代谢产物而影响产酶效果.
2.3.4 发酵培养周期对产酶的影响 在发酵培养基初始 pH为 7.0、培养温度 30℃、转速120 r/min、接种量相同的条件下,调节菌株发酵周期的时间,测定菌株的产酶效果变化.
如图5所示,菌株的发酵周期为56 h左右时,果胶酶的酶活力达到最大.发酵周期短,酶可能没有最大化分泌到细胞外,从而使酶活力较低;发酵周期过长时,积累大量次级代谢产物而影响产酶效果,甚至会影响已经产生的酶的活性.
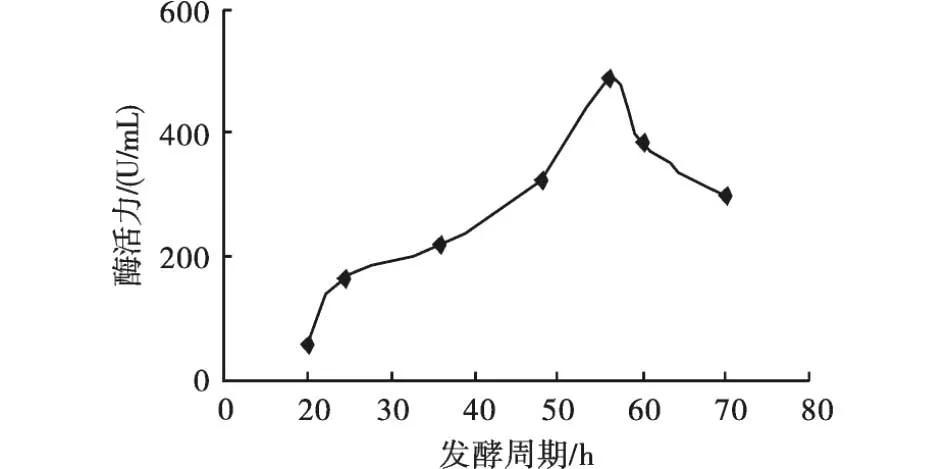
图5 发酵周期对产酶的影响Fig.5 Effect of fermentation period on enzyme producing
3结论
通过从苎麻池的厌氧池中采样,经过驯化筛选,得到了一种菌株,通过研究此菌株,证明其有产果胶酶的能力,为革兰氏阴性细菌;通过对菌株发酵培养基初始pH、最适温度、最适接种量和最佳发酵周期的实验研究.结果表明,此菌株的最佳发酵条件为发酵培养基初始pH为7.0、最适培养温度33℃、最适接种量为平时接种量的40%、最佳的发酵周期为56 h.
[1] 张树政.酶制剂工业[M].下册.北京:科学出版社,1984:233-236.
[2] 王军,黄秀琴,王洁,等.一株高产果胶酶菌的分离及其产酶条件的优化研究[J].安徽农业科学,2009,37(36):17902-17904.
[3] 裘纪莹,王未名,陈建爱,等.微生物果胶酶的研究进展[J].中国食品添加剂,2010,1(4):238 -241.
[4] 沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:28-34.
[5] 毛炜坤,张振中,王向东,等.野生苎麻微生物脱胶优势菌的选育及其应用[J].纺织学报,2010,31(11):66-72.
[6] 张浩森,缪静,余晓斌,等.果胶酶高产菌株的筛选及产酶条件的研究[J].生物学杂志,2008,25(1):28-30.
[7] QU Er Jun,LI Wen Jian,LIU Yun Xiao,et al.Inducing and Screening of High Producing Pectinase Aspergillus niger Strain[J].Agricultural Science and Technology,2010,11(4):22 -29.
[8] Reid W W.The pectic enzymes of the fungus Byssochlamys fulva[J].Biochem J,1952,50(3):289 -292.
[9] Sivakumar D,Wijeratnam W R S,Wijesundera R L C.Effect of GRAS compounds on mycelial growth,pectic enzyme activity and disease severity of postharvest pathogens on rambutan[J].Biomedical and Life Sciences,2001,29(2):135 -141.
[10] Brien P,Zamani M.Production of pectic enzymes by barepatch isolates of Rhizoctonia solani AG 8[J].Australasian Plant Pathology,2003,32(1):65 -72.
[11] Neate S M,Cruickshank R H,Rovira A D.Pectic enzyme patterns of Rhizoctonia solani isolates from agricultural soils in South Australia[J].1988,90(1):37-42.
[12] Volpi C,Janni M,Lionetti V,et al.The Ectopic Expression of a Pectin Methyl Esterase Inhibitor Increases Pectin Methyl Esterification and Limits Fungal Diseases in Wheat[J].Molecular Plant-Microbe Interactions,2011,24(9):1012 -1019.
[13] Conde E,Moure A,Dominguez H,et al.Purified Phenolics from Hydrothermal Treatments of Biomass:Ability To Protect Sunflower Bulk Oil and Model Food Emulsions from Oxidation[J].J Agric Food Chem,2011,59(17):9158 -9165.
[14] Romero-Cascales I,Ros-García J M,López-Roca J M,et al.The effect of a commercial pectolytic enzyme on grape skin cell wall degradation and colour evolution during the maceration process[J].Food Chemistry,2012,130(3):626 -631.
Separation of one pectinase strain and optimization for it’s production of enzymes
SU Teng-jia,ZHU Xiong-wei,ZHANG You-hong,LIU Fen,LIU Ting-ting,XU Zhi-peng,LI Wei-peng
(Key Laboratory for Green Chemical Process of Ministry of Education,School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Wuhan 430074,China)
A pectinase strain from the nature would was screened and rescreened on the culture dishes,and cultivated in the shake flask for fermentation.The enzyme activity of pectinase strain was also detected in the cultivation process.The initial pH value of fermentation medium,fermentation temperature,optimum innoculation amount and the fermentation period were studied preliminarily.The results show that the pectinase strain has the best enzyme activity when the initial pH value of fermentation medium is 7.0,the culture temperature is 33 ℃,the innoculation amount is 30%and fermentation period is 56 h.The optimized conditions can greatly improve the enzyme activity.
pectinase strain;purification;fermentation optimization for enzyme production;enzyme activity
Q93-33
A
10.3969/j.issn.1674-2869.2012.04.004
1674-2869(2012)04-0015-04
2012-03-15
苏腾甲(1989-),男,安徽宣城人,硕士研究生.研究方向:生物工程与技术.
指导老师:张佑红,男,教授,博士,博士研究生导师.研究方向:生物技术.*通信联系人
张 瑞

