LiTi2(PO4)3/C复合材料的制备及电化学性能
袁 铮 崔永丽 沈明芳 强颖怀 庄全超
(中国矿业大学材料科学与工程学院,锂离子电池实验室,江苏徐州221116)
LiTi2(PO4)3/C复合材料的制备及电化学性能
袁 铮 崔永丽 沈明芳 强颖怀 庄全超*
(中国矿业大学材料科学与工程学院,锂离子电池实验室,江苏徐州221116)
采用聚乙烯醇(PVA)辅助溶胶-凝胶法合成了具有Na+超离子导体(NASICON)结构的LiTi2(PO4)3/C复合材料.运用X射线衍射(XRD)、扫描电子显微镜(SEM)、充放电测试、循环伏安(CV)、电化学阻抗谱(EIS)等对其结构形貌和电化学性能进行表征.实验结果表明:合成的LiTi2(PO4)3/C具有良好的NASICON结构,首次放电容量为144 mAh·g-1.电化学阻抗谱测试结果显示,LiTi2(PO4)3/C复合材料电极在首次嵌锂过程中分别出现了代表固体电解质相界面(SEI)膜及接触阻抗、电荷传递阻抗和相变阻抗的圆弧,并详细分析了它们的变化规律.计算了Li+在LiTi2(PO4)3中嵌入/脱出时的扩散系数,分别为2.40×10-5和1.07×10-5cm2·s-1.
LiTi2(PO4)3/C复合材料;电化学阻抗谱;固体电解质界面膜;接触阻抗;相变;扩散系数
1 引言
自20世纪90年代以来,锂离子电池以其较高的工作电压、较大的比容量以及绿色安全等优点引起了企业和研究机构的广泛关注.锂离子电池正极材料占锂离子电池总成本的40%左右,也是制约其容量的主要因素,因此开发理想的正极材料,是今后锂离子电池研究的热点和发展电动交通工具的关键.1
磷基材料以其较高的能量密度和良好的散热性能受到了研究学者的广泛关注.2-7在过去的研究中,人们把注意力大都集中在橄榄石型结构的LiMPO4(M=Mn,Fe,Co,Ni)系列材料上,特别是具有较高的理论容量(170 mAh·g-1),适中的电位(Li/ Li+为3.4 V),以及对环境友好等特点的LiFePO4材料.2近年来,除了传统的橄榄石型的磷酸盐外,其他晶体结构的磷酸盐也逐渐受到重视.LiM2(PO4)3(M=Fe,V,Ti)是一类Na+超离子导体(NASICON)结构的材料,不仅可以用于固体电解质,也可用于锂离子电池电极材料.8-11
NASICON结构是带负电的三维骨架,结构式为Ti2P3O12,是由PO4四面体和TiO6八面体相连接,每个TiO6八面体与6个PO4四面体相连接,Li+在晶体结构的三维通道中迁移.12LiTi2(PO4)3属于NASICON型超离子导体材料,有两种不同的Li+位(M1和M2), M1被完全填充,而M2都是空位.在放电过程中,有两个Li+嵌入LiTi2(PO4)3中形成Li3Ti2(PO4)3,充电的过程两个Li+从Li3Ti2(PO4)3中脱出形成LiTi2(PO4)3.13,14目前关于用LiTi2(PO4)3作为锂离子电池电极材料的研究报道并不多,而且LiTi2(PO4)3多采用高温固相法制得.本文采用溶胶-凝胶法替代传统的高温固相法制备了LiTi2(PO4)3/C复合材料,并研究其电化学性能.
2 实验部分
聚乙烯醇(PVA,含量高于97%)、NH4H2PO4(含量高于99%,分析纯)均为天津福晨化学试剂厂产品,Li2CO3(含量高于98%,分析纯)、TiO2(含量高于98%,化学纯)均为国药集团化学试剂公司产品.
采用溶胶-凝胶法制备LiTi2(PO4)3/C.具体过程为:先将PVA溶于去离子水中,然后加入摩尔计量比的Li2CO3、NH4H2PO4、TiO2,使其在去离子水中充分溶解.混合物在80°C水浴搅拌器内搅干形成固体,然后在鼓风干燥箱内80°C下干燥24 h,研磨后得到前驱体.将前驱体移入瓷舟内并放入管式炉内,在Ar气氛保护下,以10°C·min-1升温速率加热到900°C,保温12 h,即得到LiTi2(PO4)3/C样品.反应方程式为:

物相测试在D/Max-3B型X射线衍射仪(日本理学Rigaku)上完成.测量条件为Cu靶,Kα射线,石墨单色器,管电压35 kV,管电流30 mA,扫描速率为3 (°)·min-1,采样间隔为0.02°.样品形貌用美国FEI公司生产的Quanta250环境扫描电子显微镜进行观察.
LiTi2(PO4)3/C复合材料电极按70%(w)的活性材料,20%(w)的聚偏二氟乙烯-六氟丙烯(PVDF-HFP)粘合剂(99%,Kynar HSV910,Elf-atochem,USA), 10%(w)的炭黑(99%,上海杉杉科技有限公司)组成,以铝箔作为集流体.电解液为1 mol·L-1LiPF6-碳酸乙烯酯(EC)/碳酸二乙酯(DEC)/碳酸二甲酯(DMC) (体积比1:1:1)(张家港国泰华荣化工新材料公司).
所有电化学实验均采用2032扣式电池体系,金属锂片为对电极.充放电实验在2XZ-2B电池检测系统(深圳新威电子仪器公司)上完成.充放电电压范围为1.50-3.50 V,充放电倍率为0.1C(1C=138 mAh·g-1).循环伏安(CV)及电化学阻抗谱(EIS)测试在CHI660D电化学工作站(上海辰华仪器有限公司)上完成.CV的扫描速率为10-4-10-3V·s-1不等,电压范围为1.50-3.50 V.EIS测试频率范围为105Hz,交流信号振幅为5 mV,测试中获得的阻抗数据用Zview软件进行拟合.
3 结果与讨论
3.1 XRD及SEM结果
图1为LiTi2(PO4)3/C复合材料的XRD图谱.对照JCPDS(#35-0754)卡片可知,各个衍射峰与标准卡片上一致,图谱衍射峰尖锐,峰强较高,说明材料具有良好的NASICON结构晶型.11此外,XRD图谱中出现3个低强度P2O5的杂质衍射峰,很可能在合成过程中由于未反应的(NH4)H2PO4在高温时分解引入的.

图1 LiTi2(PO4)3/C复合材料XRD的图谱Fig.1 XRD pattern of LiTi2(PO4)3/C composite material
图2为LiTi2(PO4)3/C复合材料的SEM图像.从图中可以看出,LiTi2(PO4)3/C复合材料的颗粒比较大,在10 μm左右,这可能是因为在烧结的过程中,温度过高发生颗粒的团聚造成的.在LiTi2(PO4)3/C复合材料中,颗粒的表面存在一些孔洞,这些孔洞的存在有利于Li+的脱出和嵌入,可提高活性物质的利用率.
3.2 CV及充放电实验结果
图3为LiTi2(PO4)3/C电极的循环伏安曲线.可以看出,在1.50-3.50 V的充放电电压范围内,LiTi2(PO4)3/ C.只存在一对氧化还原峰,氧化脱锂峰在2.60 V附近,还原嵌锂峰在2.40 V附近,说明NASICON结构的LiTi2(PO4)3中的锂离子脱嵌是一步进行的.氧化还原电位差ΔV为0.20 V,略大于充放电平台差(ΔV= 0.05 V),这是因为循环伏安模拟电池充放电过程时会存在极化现象,使ΔV略有增加.从图中可以发现,第一周扫描过程中,还原嵌锂峰的峰值电流Ip1为0.69 mA,氧化脱锂峰值电流Ip2为0.47 mA,说明首次脱/嵌锂时的电化学动力学存在差异.在以后的几周中,还原峰值和氧化峰值基本一致,重合性也较第一周好,说明材料在经过第一周充放电后,结构的稳定性有所增加.15

图2 LiTi2(PO4)3/C复合材料不同放大倍数的SEM图像Fig.2 SEM photographs of LiTi2(PO4)3/C composite material with different magnifications

图3 LiTi2(PO4)3/C电极循环伏安曲线Fig.3 Cyclic voltammetry curves of LiTi2(PO4)3/C electrode
图4(a)为LiTi2(PO4)3/C电极在第1和2周的充放电曲线,其中放电平台为2.45 V,充电平台为2.50 V,与理论充放电平台一致,16且平台较平,说明材料具有良好的电化学性能.第一周充放电容量分别为137和144 mAh·g-1.Wang等11指出,NASICON结构的LiTi2(PO4)3在锂离子嵌入/脱出时,除了Ti4+/Ti3+得到/失去电子外,[PO4]3-也可以得失电子,这样理论上每1 mol LiTi2(PO4)3反应会有5.2 mol的Li+嵌入/脱出.而在本研究中,1 mol LiTi2(PO4)3中大约有2 mol的Li+嵌入/脱出(138 mAh·g-1),这说明在此电压范围内,锂离子的嵌入/脱出是由Ti4+/Ti3+的氧化还原造成的,并没有PO3-4参加反应.
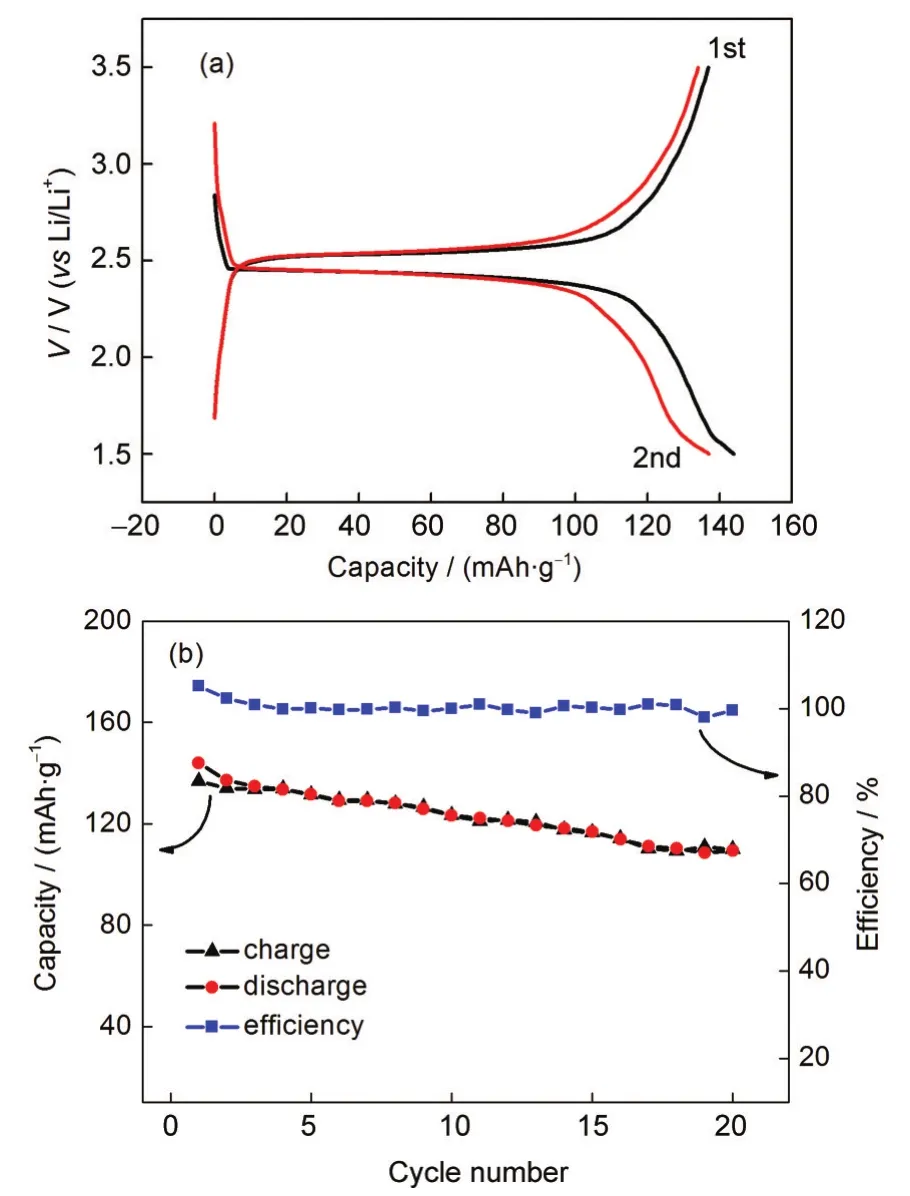
图4 (a)LiTi2(PO4)3/C电极充放电曲线(第1、2周);(b)LiTi2 (PO4)3/C电极循环效率曲线Fig.4 (a)Charge/discharge curves of LiTi2(PO4)3/C electrode(1st,2nd cycles);(b)cycling property curves of LiTi2(PO4)3/C electrode range of voltage:1.50-3.50 V
LiTi2(PO4)3/C电极的循环性能曲线如图4(b)所示,除首次充放电过程中存在一定的不可逆容量衰减外,充放电容量基本保持一致,充放电效率基本上保持在100%.但是材料容量的衰减比较快,循环20周后充放电容量分别为109和110 mAh·g-1,其容量保持率分别为79.56%和76.39%.容量衰减较快可能是因为材料在反复脱嵌锂的过程中体积有所变化,使活性物质与导电剂接触不理想,复合材料的导电性能下降造成的.
3.3 EIS研究
3.3.1 LiTi2(PO4)3/C电极在首次放电过程中的EIS谱基本特征
图5为LiTi2(PO4)3/C电极首次放电过程中的阻抗谱变化图.从图中可以看出,在开路电位2.90 V时,LiTi2(PO4)3/C电极的Nyquist图在整个测试频率范围内主要由三个部分组成,即高频区域的一个半圆、中频区的一个半圆及低频区域的一段斜线.依据经典的锂离子嵌入脱出机制模型,17,18高频区半圆(HFS)是与SEI膜相关的半圆,但是考虑高频区的半圆在开路电位下(2.90 V)就存在,且阻值很大,因而高频区的半圆除了与SEI膜有关外,可能也与接触阻抗有关.中频区域半圆(MFS)是与电荷传递过程相关的半圆,而低频区部分的斜线(LFL)则反映了锂离子在电极材料固体中的扩散过程.在电极极化电位降低至2.40 V的过程中,Nyquist图的基本特征与开路电位时相似.2.30 V时,Nyquist图的一个重要特征为低频区域的斜线演变为一段斜线和一段圆弧,此时Nyquist图由四部分组成,即高频区域与SEI膜和接触阻抗相关的半圆,中频区域与电荷传递过程相关的半圆,低频区域与固态扩散相关的斜线以及更低频区域的一段圆弧.根据Barsoukov等19的观点,更低频区域的半圆是与锂离子嵌入过程中材料本体发生相变有关的半圆,即LiTi2(PO4)3在反应电位时,锂离子大量嵌入,LiTi2(PO4)3转变为Li3Ti2(PO4)3,并由于体积的膨胀,产生了一个新的相界面.新的相界面使锂离子在两相中传输速率发生变化,在Nyquist图上表现为一个新的半圆.先前我们运用EIS研究Cu6Sn5合金的嵌锂过程时,也观察到了类似的现象.20-22
根据EIS谱的基本特征,本文选取的等效电路如图6所示,其中Rs代表溶液电阻,R1、R2、R3分别代表高频半圆、中频区半圆和相变相关的电阻,高频半圆电容、中频半圆电容、低频扩散阻抗和相变电容分别用恒相角元件(CPE)Q1、Q2、Q3、Q4表示,CPE的导纳响应表达式如下:


图5 LiTi2(PO4)3/C电极首次放电过程中EIS随电极极化电位的变化Fig.5 Variationsof EIS with the electrodepolarizationpotentialsforLiTi2(PO4)3/Celectrodeduring thefirstdischargeprocessHFS:high frequency semicircle;MFS:middle frequency semicircle;LFL:low frequency line
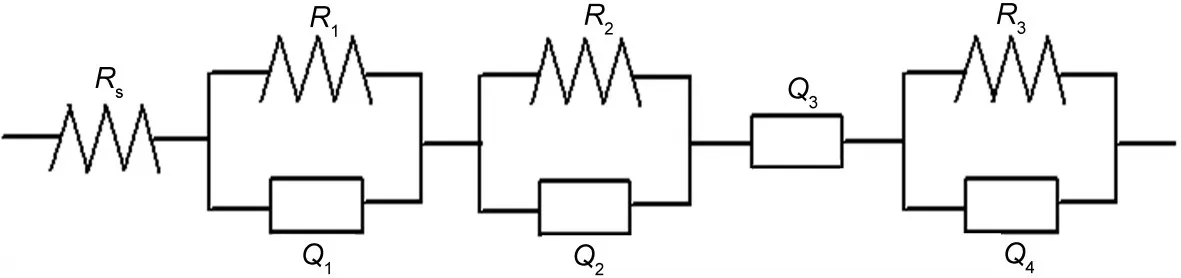
图6 LiTi2(PO4)3/C电极的EIS拟合等效电路Fig.6 Equivalent circuit proposed for EIS fitting of LiTi2(PO4)3/C electrodeRs:solutionresistance;R1:resistanceof highfrequencysemicircle;R2:resistanceof middlefrequencysemicircle;R3:resistanceof phasetransformation; Q1:capacitanceof highfrequencysemicircle;Q2:capacitanceof middlefrequencysemicircle;Q4:capacitanceof phasetransformation; Q3:impedance of diffusion

图7 LiTi2(PO4)3/C电极首次放电过程中EIS的模拟结果Fig.7 Simulating results of EIS for LiTi2(PO4)3/C electrode in initial discharge process
其中ω为角频率,j为虚数单位 -1.当n=0时,CPE相当于一个电阻;n=1,CPE相当于一个电容;n=0.5, CPE相当于Warburg阻抗.根据该等效电路对实验结果进行拟合.在拟合过程中,根据EIS低频区域是否存在与扩散相关的斜线和与相变相关的圆弧,通过添减Q3和R3/Q4等效电路元件实现对不同电位下EIS的拟合.
拟合结果见图7.由此可见图6所示的等效电路能满意地拟合不同电位下的EIS实验数据,实验数据曲线与拟合曲线实现很好的重叠,各等效电路参数拟合误差小于15%.

图8 LiTi2(PO4)3/C电极在首次放电过程中R1随电极电位变化的数值分析结果Fig.8 Variations of R1obtained from fitting the experimental impedance spectra of LiTi2(PO4)3/C electrode during the first discharge process
3.3.2 各频率区间内数值变化及分析
图8为LiTi2(PO4)3/C电极在首次放电过程中R1随电极电位变化关系.可以看出在放电过程中, 2.90-2.50 V之间,R1随电极极化电位的降低缓慢增大,表明LiTi2(PO4)3/C电极的SEI膜随电极极化电位的降低缓慢增厚,同时接触阻抗逐渐增大.2.50-2.40 V之间,R1随电极极化电位的降低迅速增大.图9为Li1+xTi2(PO4)3首次放电过程中嵌锂度x随电极极化电位的变化.可以看出首次放电过程中,随着电极极化电位的下降,嵌锂度不断增加.当电极极化电位降低到2.50 V时,锂离子的嵌入量为1.96%.从2.50 V到2.40 V时,嵌锂量突增到60.47%,说明此过程中有大量锂离子的嵌入.锂离子的大量嵌入会使颗粒体积膨胀,导致颗粒内部的应力增大.考虑到本研究中所制备的活性材料颗粒较大,颗粒内部的应力增大,会引起活性材料颗粒的破碎,导致活性材料表面积增大,进而使SEI膜阻抗增大.同时颗粒的破碎也会使材料的接触变差,致使接触阻抗增大,这与文献报道15的一致.2.40 V以下,R1随电极极化电位的降低缓慢增大,与2.90-2.50 V范围内R1的变化规律类似.
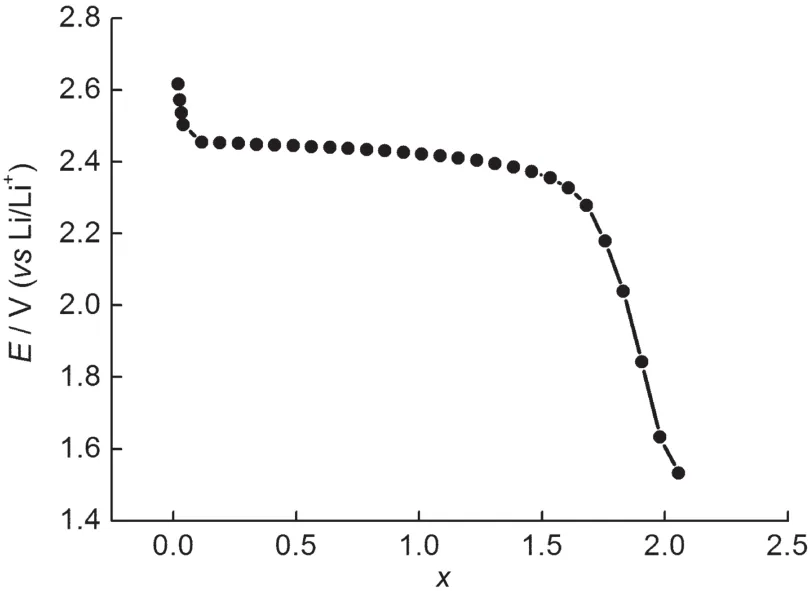
图9 Li1+xTi2(PO4)3电极首次放电过程中嵌锂度x随电位的变化Fig.9 Potential in Li1+xTi2(PO4)3electrode as a function of the stoichiometry x in the first discharge process
图10为LiTi2(PO4)3/C在首次放电过程中电荷传递电阻R2随电极电位变化的关系.可以看出,R2值随着电极电位的变化先减小后增大.如果假设不存在嵌入电极的锂离子之间和锂离子与嵌锂空位之间的相互作用,电荷传递电阻Rct与嵌锂度x满足如下关系:23

其中f=F/RT(F为法拉第常数,R为气体常数,T为热力学温度),ks为标准速率交换常数,A为电极表面积.可以得出:当x→0或1时,Rct快速增大,当x→0.5时,Rct减小,即在放电的过程中,Rct随电极电位的关系表现为先减小后增大.这与R2随电极电位变化规律一致,证实中频区的半圆是与电荷传递过程相关的半圆.

图10 LiTi2(PO4)3/C电极在首次放电过程中R2随电极电位变化的数值分析结果Fig.10 Variations of R2obtained from fitting the experimental impedance spectra of LiTi2(PO4)3/C electrode during the first discharge process

图11 LiTi2(PO4)3/C电极在首次放电过程中lnR2随电极电位的变化Fig.11 Variations of the logarithm of R2of LiTi2(PO4)3/C electrode during the first discharge process
在我们前期研究石墨电极的电化学阻抗谱中,得出当嵌锂度很小(x→0)时,lnRct和E满足公式:24

其中ne是反应过程中电子的转移数目,α为电化学反应的对称因子,E和E0分别代表电极的实际和标准电位,cmax为电极的最大嵌锂度,k0为标准反应速率常数,MLi+为电极表面溶液中的锂离子浓度.从等式(4)可以得出,当x→0时,lnRct和电极极化电位呈线性变化关系.
从图11可以看出,LiTi2(PO4)3/C电极首次放电过程中lnR2和电极电位E成线性关系,这和式(4)是相吻合的,进一步说明中频区的半圆是与电荷传递相关的半圆.
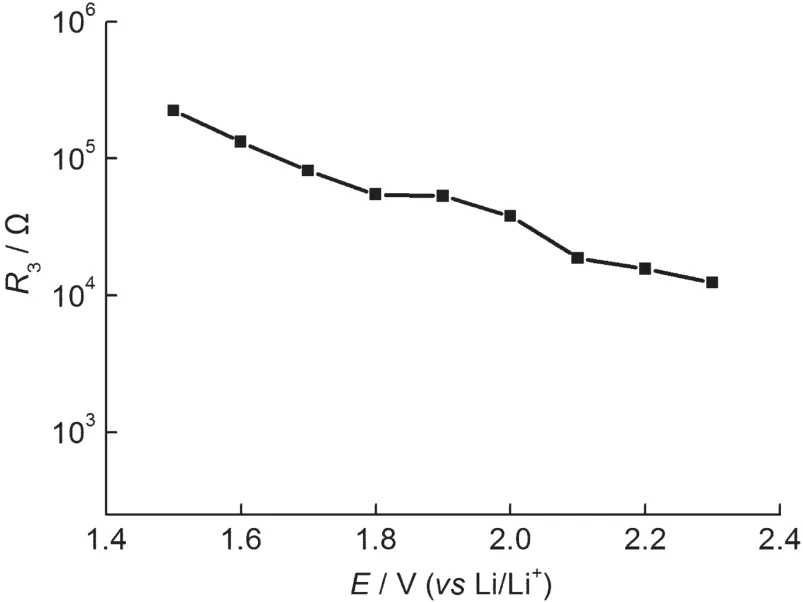
图12 LiTi2(PO4)3/C电极在首次放电过程中R3随电极电位变化的数值分析结果Fig.12 Variations of R3obtained from fitting theexperimental impedance spectra of LiTi2(PO4)3/C electrode during the first discharge process
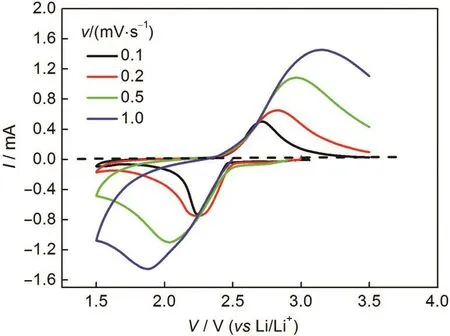
图13 不同扫描速率下的LiTi2(PO4)3/C循环伏安曲线Fig.13 Cyclic voltammograms of the LiTi2(PO4)3/C at various scan rates
图12为LiTi2(PO4)3/C电极在首次放电过程中相变电阻R3随电极极化电位变化的关系.从图中可以看出,R3的值随电极电位的降低逐渐增大,这是因为随着电极电位的不断降低,LiTi2(PO4)3相转变为Li3Ti2(PO4)3相的过程变得困难,当电极电位降到1.50 V时,相变电阻R3值比在2.30 V时大了一个数量级,这与Barsoukov等19采用电化学阻抗谱研究LiCoO2相变过程的结果相似.此外,较大程度的相变会减少活性材料颗粒与颗粒之间及颗粒与整体电极之间的电接触,致使电极循环性能下降.
3.4 扩散系数的测定
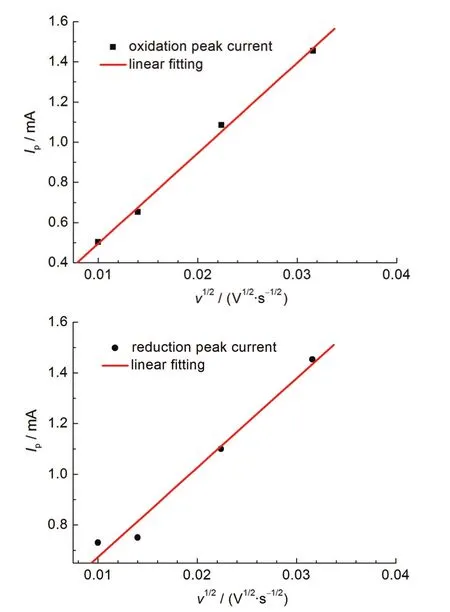
图14 峰值电流Ip与扫描速率平方根v1/2的关系Fig.14 Relationship between peak current Ipand square root of scan rate v1/2
图13为LiTi2(PO4)3/C电极在不同扫描速率下的循环伏安曲线.随着扫描速率的上升,还原峰向低电位转移,氧化峰向高电位转移,其间距ΔV增大,这是因为LiTi2(PO4)3的电导率太低,在扫描速率较快时,发生较大极化造成的.同时,峰值电流(Ip)随着扫描速率的增加而增加.峰值电流(Ip)和扫描速率的平方根存在一个线性关系,如图14所示,这是典型的扩散控制过程,说明LiTi2(PO4)3中的两相转变动力学可以近似地认为是一个扩散过程.化学扩散系数可以通过Randles-Sevcik方程25计算出:

其中,n是反应过程中转移的电子数量,C是反应物体相浓度,DCV是由CV确定出的化学扩散系数,v是扫描速率.扩散系数可以通过式(5)计算得出.(5)式可以化简为:
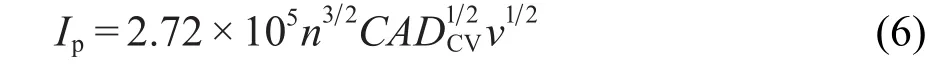
计算出LiTi2(PO4)3的嵌锂/脱锂的扩散系数分别为2.40×10-5和1.07×10-5cm2·s-1,这与文献11报道的一致.LiTi2(PO4)3的扩散系数远大于其他嵌锂材料,这是因为NASICON结构中的传输通道和间隙对锂离子的扩散起到促进作用.
4 结论
采用聚乙烯醇(PVA)辅助溶胶-凝胶法代替传统的高温固相法制备了LiTi2(PO4)3/C复合材料,并运用XRD、SEM、充放电测试、循环伏安、电化学阻抗谱对其结构形貌和电化学性能进行了表征.XRD研究结果表明,所制备的LiTi2(PO4)3/C复合材料具有良好的NASICON结构晶型.充放电结果显示,其首次放电容量为144 mAh·g-1.采用EIS对LiTi2(PO4)3/ C复合材料首次嵌锂过程进行研究,发现当锂离子大量嵌入时,颗粒内应力增大,体积膨胀,体积的膨胀会造成颗粒的破碎和相变的产生,这对其电化学性能具有重要影响.并计算出Li+在LiTi2(PO4)3中嵌入/脱出时的扩散系数,分别为2.40×10-5和1.07×10-5cm2·s-1.
(1) Wakihara,M.Mater.Sci.Eng.2001,33,109.
(2) Padhi,A.K.;Nanjundaswamy,K.S.;Goodenough,J.B. J.Electrochem.Soc.1997,144(4),1188.
(3) Padhi,A.K.;Nanjundaswamy,K.S.;Masquelier,C.;Okada,S.; Goodenough,J.B.J.Electrochem.Soc.1997,144(5),1609.
(4) Nanjundaswamy,K.S.;Padhi,A.K.;Goodenough,J.B.; Okada,S.;Ohtsuka,H.;Arai,H.;Yamaki,J.Solid State Ionics 1996,92,1.
(5)Yamada,A.;Chung,S.C.;Hinokuma,K.J.Electrochem.Soc. 2001,148(3),A224.
(6) Takahashi,M.;Tobishima,S.I.;Takei,K.;Sakurai,Y.Solid State Ionics 2002,148,283.
(7) Dahn,J.R.;Fuller,E.W.;Obrovac,M.;Sacken,U.V.Solid State Ionics 1994,69(3-4),265.
(8) Patoux,S.;Wurm,C.;Morcrette,M.;Rousse,G.;Masquelier, C.J.Power Sources 2003,119-121,278.
(9) Sato,M.;Ohkawa,H.;Yoshida,K.;Saito,M.;Uematsu,K.; Toda,K.Solid State Ionics 2000,135,137.
(10) Saidi,M.Y.;Barker,J.;Huang,H.;Swoyer,J.L.;Adamson,G. J.Power Sources 2003,119-121,266.
(11)Wang,G.X.;Bradhurst,D.H.;Dou,S.X.;Liu,H.K.J.Power Sources 2003,124,231.
(12) Delmas,C.;Nadiri,A.;Soubeyroux,J.L.Solid State Ionics 1988,28-30,419.
(13) Torardi,C.C.;Prince,E.Mater.Res.Bull.1986,21(6),719.
(14) Manthiram,A.;Goodenough,J.B.J.Solid State Chem.1987, 71,349.
(15) Wang,H,B.The Research of Electrochemical Properties of Aqueous Lithium-ion Batteries and Proton Electrolyte for Intermediate Temperature Fuel Cell.Ph.D.Dissertation, Central South University,Changsha,2008. [王海波.水溶液锂离子电池电化学性能和中温燃料电池质子电解质的研究[D].长沙:中南大学,2008.]
(16) Burba,C.M.;Frech,R.Solid State Ionics 2006,177,1489.
(17) Barsoukov,E.;Kim,D.H.;Lee,H.S.;Lee,H.;Yakovleva,M.; Gao,Y.;Engel,J.F.Solid State Ionics 2003,161,19.
(18) Levi,M.D.;Aurbach,D.J.Phys.Chem.B 1997,101,4630.
(19) Barsoukov,E.;Kim,J.H.;Kim,D.H.;Hwang,K.S.;Yoon,C. O.;Lee,H.J.New Mater.Electrochem.Syst.2000,3,301.
(20) Fan,X.Y.;Zhuang,Q.C.;Wei,G.Z.Acta Phys.-Chim.Sin. 2009,25(4),611.[樊小勇,庄全超,魏国祯.物理化学学报, 2009,25(4),611.]
(21) Fan,X.Y.;Zhuang,Q.C.;Wei,G.Z.;Huang,L.;Dong,Q.F.; Sun,S.G.J.Appl.Electrochem.2009,39,1323.
(22) Fan,X.Y.;Zhuang,Q.C.;Wei,G.Z.;Ke,F.S.;Huang,L.; Dong,Q.F.;Sun,S.G.Acta Chim.Sin.2009,67(14),1547. [樊小勇,庄全超,魏国祯,柯福生,黄 令,董全峰,孙世刚.化学学报,2009,67(14),1547.]
(23) Levi,M.D.;Gamosky,K.;Aurbach,D.Electrochim.Acta 2000, 45(11),1781.
(24) Xu,S.D.;Zhuang,Q.C.;Tian,L.L.;Qin,Y.P.;Fang,L.;Sun, S.G.J.Phys.Chem.C 2011,115,9210.
(25) Tang,K.;Yu,X.Q.;Sun,J.P.;Li,H.;Huang,X.J. Electrochim.Acta 2011,56(134),4869.
November 18,2011;Revised:February 20,2012;Published on Web:March 1,2012.
Preparation and Electrochemical Performance of LiTi2(PO4)3/C Composite Cathode for Lithium Ion Batteries
YUAN Zheng CUI Yong-Li SHEN Ming-Fang QIANG Ying-Huai ZHUANG Quan-Chao*
(Li-Ion Batteries Laboratory,School of Materials Science and Engineering,China University of Mining and Technology, Xuzhou 221116,Jiangsu Province,P.R.China)
LiTi2(PO4)3/C composite with a Na+superionic conductor(NASICON)-type structure was prepared by a sol-gel method.The LiTi2(PO4)3/C composite had a good NASICON structure and good electrochemical properties as revealed by X-ray diffraction(XRD),scanning electron microscopy(SEM),charging/discharging tests,cyclic voltammetry(CV),and electrochemical impedance spectroscopy(EIS).The first discharge capacity was 144 mAh·g-1.The EIS results indicated that there appeared semicircles respectively representing the solid electrolyte interface(SEI)film as well as the contact resistance,charge transfer resistance,and phase transformation resistance in the initial lithiation process of LiTi2(PO4)3/C composite electrode.The chemical diffusion coefficients of intercalation and de-intercalation of Li+in the LiTi2(PO4)3cathode material were calculated tobe 2.40×10-5and 1.07×10-5cm2·s-1,respectively.
LiTi2(PO4)3/C composite material;Electrochemical impedance spectroscopy;Solid electrolyte interface film; Contact resistance; Phase transformation;Diffusion coefficient
10.3866/PKU.WHXB201203012
O646
∗Corresponding author.Email:zhuangquanchao@126.com;Tel:+86-13605215324.
The project was supported by the Fundamental Research Funds for the Central Universities,China(2010LKHX03,2010QNB04,2010QNB05)and Innovation andAbility Enhancement Funds for Fostering Subject of China University of Mining and Technology(2011XK07).
中央高校基本科研业务费专项资金(2010LKHX03,2010QNB04,2010QNB05)和中国矿业大学培育学科创新能力提升基金(2011XK07)资助项目

