Al3+对尖晶石型LiMn2O4正极材料的表面掺杂包覆改性
熊礼龙 徐友龙 张 成 陶 韬
(西安交通大学,电子陶瓷与器件教育部重点实验室,国际电介质研究中心,西安710049)
Al3+对尖晶石型LiMn2O4正极材料的表面掺杂包覆改性
熊礼龙 徐友龙*张 成 陶 韬
(西安交通大学,电子陶瓷与器件教育部重点实验室,国际电介质研究中心,西安710049)
采用表面掺杂包覆改性的方法对LiMn2O4尖晶石型锂离子电池正极材料进行改性.以Al为表面掺杂元素,Al(NO3)3为原料,研究了Al3+掺杂量为7.1%(原子分数)时不同温度(300、400、500、600、700、750、800°C)下的改性效果.研究发现,随着热处理温度的升高,改性样品的最大比容量先升高后降低,在700°C达到最大值;循环衰减先增大后降低再增大;这是由于随着热处理温度的升高,包覆层逐渐分解并与LiMn2O4颗粒反应固溶,在750°C完全固溶,衰减达到极小值,而后固溶层向颗粒内部扩散,导致包覆层对颗粒免受电解液溶解的保护能力变弱,因而容量衰减增大.其中700°C热处理5 h的样品最大比容量为133.6 mAh·g-1,循环50周衰减3.4%.研究表明Al3+表面掺杂包覆改性有利于促进LiMn2O4尖晶石型锂离子电池正极材料的商业化生产,具有大规模应用的前景.
锂离子电池;正极材料;尖晶石型LiMn2O4;表面掺杂包覆改性;固溶体
1 引言
尖晶石型LiMn2O4材料以其工作电压高、可逆容量大、储量丰富、价格低廉、制备容易、生产成本低、适合于大规模工业化生产、无毒、绿色环保和安全性能高等优点,1-5成为动力型锂离子电池正极材料的最佳候选材料之一.6,7但是,由于尖晶石型LiMn2O4正极材料在充放电过程中循环性能较差,极大地阻碍了其大规模应用的进程,尤其是在动力电池领域的应用.8,9
尖晶石型LiMn2O4正极材料容量衰减主要有两方面原因:Mn在电解液中的溶解和Jahn-Teller效应.前者是由于LiMn2O4发生歧化反应以及电解液自身分解产生的少量HF腐蚀导致Mn的溶解;10,11后者是由于Mn3+离子核外eg电子的高自旋态而与O2-产生强烈的排斥作用引起的拉伸形变导致其结构不稳定性增加.12
对于尖晶石型LiMn2O4的改性研究,目前常用的方法有两类:离子掺杂和表面包覆.离子掺杂又分为阳离子掺杂和阴离子掺杂,前者主要是采用金属元素(Cr、Al、Mg、La、Ti、Zn、Cu、Ni、Co等)部分取代LiMn2O4中的Mn元素,提高Mn的平均价态,抑制Jahn-Teller效应;13-19阴离子掺杂如F部分取代LiMn2O4结构中的氧离子,由于掺杂阴离子电负性比氧大,有较强的电子吸附能力,使Mn―F键的强度比Mn―O的大,因此可以提高尖晶石型结构的稳定性.20表面包覆是用金属氧化物(MgO、CuO、Al2O3、ZnO、SiO2、ZrO2、TiO2等)包覆在尖晶石型LiMn2O4颗粒表面,阻止LiMn2O4与电解液的直接接触,降低Mn的溶解,提高循环性能.21-23
本文在课题组24-26前期研究工作的基础上,采用Al3+进行表面掺杂包覆改性研究.通过硝酸盐分解法在LiMn2O4电极表面生成金属氧化物层(Al2O3),然后进一步反应生成固溶体层(LiAlxMn2-xO4),这层固溶体壳层能够提高尖晶石型LiMn2O4正极材料的结构稳定性,减小电极的极化,抑制尖晶石型LiMn2O4颗粒表面的Jahn-Teller效应.同时它能有效地将LiMn2O4颗粒与电解液隔离,阻止它们的直接接触,降低Mn在电解液中的溶解,提高尖晶石型LiMn2O4正极材料的循环性能.此改性方案结合了两种传统改性模式的优点,首先,掺杂层是在颗粒表面,在稳定结构的同时不会对内部活性物质造成影响,因此能最大限度地保持活性物质比容量.其次,包覆固溶体层(LiAlxMn2-xO4)具有活性,与表面包覆的氧化物相比,能更好地传递Li+,利于Li+的扩散,因此表面掺杂包覆改性有望能更好地提高尖晶石型LiMn2O4正极材料的性能.
2 实验过程
2.1 改性样品制备
按照Al3+掺杂摩尔比为7.1%称取Al(NO3)3· 9H2O(99%,上海化学试剂厂)和尖晶石型LiMn2O4原粉溶于适量去离子水中,其中尖晶石型LiMn2O4原粉采用传统的固相烧结法制备.27将上述溶液加入磁子置于磁力搅拌器(AM磁力搅拌器,天津奥特赛恩斯)上搅拌12 h,继续搅拌并加热蒸发,直到混合物干燥,取出研磨,得到Al(NO3)3包覆的LiMn2O4样品.将包覆样品分为若干份,置于马弗炉(Controller P320,德国Nabertherm)中热处理(空气气氛),热处理温度分别为300、400、500、600、700、750和800°C.升温速率为2°C·min-1,保温时间为5 h.成品分别编号为A3、A4、A5、A6、A7、A75、A8,未改性LiMn2O4原粉编号为LMO,包覆未热处理样品编号为A0.
2.2 电池组装
将正极活性物质(制备的各组样品),导电剂碳黑(Vulcan XC-72,美国Colbat公司),粘结剂聚偏二氟乙烯(PVDF,分析纯,上海汇普工业)以质量比7:2: 1混合,加入适量N-甲基吡咯烷酮(NMP,化学纯,上海化学试剂厂)作为分散剂,球磨混合均匀,然后用玻璃棒在铝箔上涂成均匀的薄膜,置于60°C烘箱中烘干,后移至120°C真空烘箱中烘24 h彻底除去NMP,将涂片烘干的铝箔以30 MPa的压力压紧,使活性物质与铝箔粘合紧密.将压紧的涂敷铝箔裁剪成直径为15 mm的正极片.在无水无氧手套箱(Mikrouna Super,中国Mikrouna公司)中将正极、隔膜(Celgard 2340,美国Celgard公司)、电解液(深圳新宙邦)和负极(金属锂片,天津中能锂业)按顺序装入CR2016型扣式电池模具中,用专用电池封口机(深圳市美森机电)封口.
2.3 改性样品的表征
充放电循环测试在LAND电池测试系统(武汉金诺电子有限公司)上进行,采用恒流充放电循环测试,测试电流为0.08 mA(约0.5C),循环电压区间为3.5-4.3 V.采用日本电子株式会社(JEOL)的JSM-6700F型场发射扫描电镜(FE-SEM)来观察所得粉末试样的表面形貌,加速电压为10 kV.采用Panalytical公司的XʹPert PRO X型X射线衍射(XRD)分析仪对改性前后的尖晶石型LiMn2O4颗粒进行测试分析,辐射源为Cu的Kα源,管电流40 mA,管电压40 kV,扫描速率为10(°)·min-1.
3 实验结果与分析
3.1 循环性能分析
为了比较表面掺杂包覆改性中各热处理温度改性对尖晶石型LiMn2O4循环性能的影响,将各组样品在室温下分别进行恒流充放电循环测试,循环倍率0.5C,测试结果列于图1.
从图1(a)中可以看到,300°C下热处理的样品活化很慢,直到第33周才达到最大比容量89.1 mAh·g-1,而且从图1(b)中可以看到,A3几乎没有放电平台出现.这是由于Al(NO3)3紧密地包覆着尖晶石型LiMn2O4原粉颗粒,而300°C热处理5 h并没有使Al(NO3)3分解或与尖晶石型LiMn2O4原粉颗粒发生反应,由于Al(NO3)3紧密包覆在尖晶石型LiMn2O4颗粒表面,阻碍了Li+的嵌入和脱出通道,因此充放电过程活化很慢,循环了33周才达到最大比容量.由于Li+脱嵌的困难,不仅使得充放电过程不会产生电压平台(图1(b)),而且还会导致尖晶石型LiMn2O4颗粒内部的活性物质不能充分释放容量,因此比容量很低,只有89.1 mAh·g-1.由于Al(NO3)3的紧密包覆,将LiMn2O4颗粒与电解液隔离开,使Mn不易溶解到电解液中,所以循环容量衰减很小,从33周到100周的容量衰减小于1%.
从图1(a)中可以看到400°C热处理样品活化得比较快,在第8周就已经达到最大比容量112.8 mAh·g-1,而且在图1(b)中看到在4.12和3.95 V附近已经开始出现放电平台,推测是在400°C热处理5 h条件下,Al(NO3)3开始逐渐分解为Al2O3了,但是分解不彻底,包裹在尖晶石型LiMn2O4原粉颗粒外部分是Al2O3,部分仍然是Al(NO3)3,因此样品的比容量依然不高,而且衰减很小,第8到50周的循环活性物质容量只衰减了0.9%.
当热处理温度上升到500°C,改性样品在第6周达到最大比容量126.3 mAh·g-1,同时图1(b)中可以明显看到在4.12和3.95 V附近的放电平台,这说明Al(NO3)3已经完全分解,这使得被包覆的LiMn2O4颗粒可以较好的脱嵌Li+,因此比容量相比之前样品得到了很大提高.但是,由于温度尚不够高,分解得到的Al2O3无法与LiMn2O4颗粒形成固溶,而Al2O3颗粒无法完全包覆LiMn2O4颗粒,导致原粉颗粒与电解液接触面变大,因而循环衰减增大,这点可以从图1(a)中的比容量衰减得到印证,从第6周到第50周充放电循环,比容量衰减了3.9%.
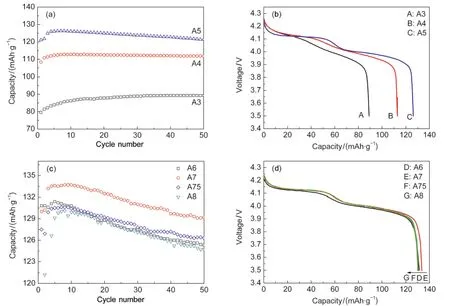
图1 0.5C倍率时热处理温度对循环性能(a,c)和最大容量时放电曲线(b,d)的影响Fig.1 Cycle performance(a,c)and discharge curves at maximum specific capacity cycle(b,d)with treated temperature under the current rate of 0.5CA3,A4,A5,A6,A7,A75,A8 indicateAl(NO3)3coated LiMn2O4samples annealing at 300,400,500,600,700,750,800°C,respectively.
从图1(d)中看到,600°C以后随着温度的升高,包覆层对放电曲线平台的影响已经不大.同时从图1(c)中看到,随着温度的升高,最大比容量先增大后降低,这是因为随着温度的增加,Al2O3逐渐与被包覆的LiMn2O4颗粒发生固溶反应,形成固溶体LiAlxMn2-xO4.反应刚开始的时候,形成的LiAlxMn2-xO4具有电化学活性,有利于Li+通过,进入被包覆的LiMn2O4颗粒,完成嵌入和脱出过程,因此比容量有一定的提升,并在700°C时达到最大值133.6 mAh· g-1,此时的50周循环衰减为3.4%.继续升高温度, Al2O3进一步与LiMn2O4颗粒反应,将会消耗掉更多的LiMn2O4,直到反应完全,包覆在LiMn2O4颗粒表面的是一层致密的固溶体层LiAlxMn2-xO4,因此750°C时样品的比容量降到了130.5 mAh·g-1,而致密的保护层也使得循环衰减降到了3.2%.这时候再升高温度,将会使固溶体层向颗粒内部扩散,表面包覆层LiAlxMn2-xO4中的x值会变小,因此保护作用也会削弱,这可以从图1(c)中的800°C放电图中看出,此时比容量已经基本不发生变化了,为130.1 mAh·g-1,但是循环衰减却增大到了4.2%.
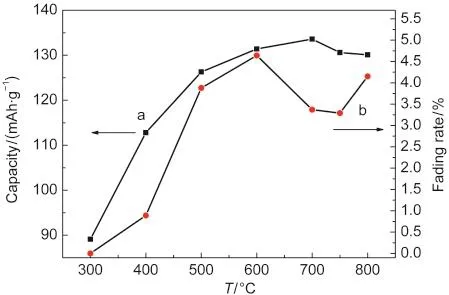
图2 热处理温度对循环性能的影响Fig.2 Cycle performance with treated temperature (a)maximum specific capacity;(b)fading rate vs treated temperature
为了更方便地对各样品进行比较,将所有样品的最大比容量和循环衰减对温度做曲线,如图2所示.从图2中a曲线可以清楚地看到,随着热处理温度的增加,表面改性样品的最大比容量逐渐增大,到700°C时达到最高值,温度继续增高时最大比容量稍有降低.据此可以推断在700°C之前,Al(NO3)3逐步分解,并开始与LiMn2O4颗粒发生反应生成固溶体壳层,到700°C时包覆层为Al2O3与LiAlxMn2-xO4的共包覆,此时改性样品比容量最大,而且包覆层的性能也较好,从图2b曲线中看到此时的循环衰减也较低.温度升到750°C时完全固溶,此时表面包覆层LiAlxMn2-xO4中的x值最大,因此比容量衰减最小.继续升高温度固溶体壳层会向颗粒内部扩散,比容量基本不发生变化,但是由于表面包覆层LiAlxMn2-xO4中的x值会变小,导致改性后颗粒被电解液溶解的量增加,使得循环衰减增大.
根据以上分析进行综合考虑,热处理700°C样品的比容量最大,为133.6 mAh·g-1,相应的50周衰减为3.4%.热处理750°C样品衰减最小,最大比容量130.5 mAh·g-1,50周衰减3.2%.与700°C样品相比衰减降低了0.2%,但最大比容量却少了2.3%,因此认为热处理700°C改性样品的性能最佳.
图3给出了未改性LiMn2O4原粉(LMO)和在包覆后700°C下热处理的样品(A7)在高温55°C下循环衰减曲线.由图可知,经过50周的高温循环,未改性的尖晶石样品的放电比容量衰减严重,容量保持率为67.9%.而经过包覆改性后的样品,其容量保持率提高到了88.6%.因此,可以推断,在尖晶石表面的Al2O3与LiAlxMn2-xO4固溶层可以有效地提高尖晶石的容量保持率.
3.2 表面形貌分析
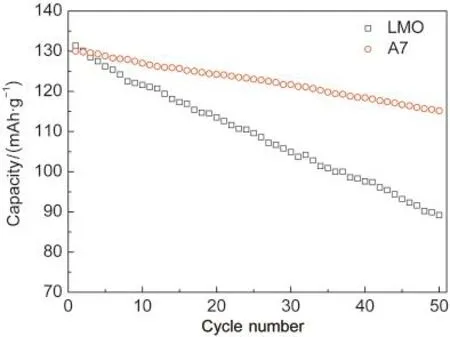
图3 样品LMO和A7在55°C时的循环性能Fig.3 Cycle performance of LMO andA7 samples at 55°CLMO:LiMn2O4

图4 改性过程中不同阶段的SEM照片Fig.4 Scanning electron microscopy(SEM)images at different stages in modifing process(a)LMO;(b)A0;(c)A5;(d)A7;AO:coated LiMn2O4sample without annealing
为了研究改性过程中尖晶石型LiMn2O4表面形态的变化,对改性各阶段的样品进行扫描电镜(SEM)测试,测试结果见图4.从图4(a)中可以看到,未改性LiMn2O4的晶粒为规则的多面体相貌,粒度均匀,晶粒尺寸在100-300 nm之间,颗粒边界分明、棱角清晰,表明LiMn2O4晶粒发育良好.在LiMn2O4颗粒表面包覆了Al(NO3)3后,导致LiMn2O4的晶粒轮廓比较模糊,边界和棱角变得不分明,但是晶粒表面依然光滑,从图4(b)中可以看到Al(NO3)3在LiMn2O4表面分布得很均匀,没有沉积密集导致团聚的区域.500°C热处理后,大部分Al(NO3)3分解为Al2O3,可以看到Al2O3小颗粒分布在LiMn2O4颗粒表面,使颗粒表面变粗糙,部分失去了原来光滑的表面轮廓(图4(c)).700°C进一步热处理后,均匀分布的Al2O3小颗粒全部消失,LiMn2O4颗粒表面重新变得光滑,颗粒边界较分明,但是棱角没有未改性原粉的尖锐(与图4(a)对比).表明Al2O3和LiMn2O4颗粒在700°C下基本固溶,在LiMn2O4颗粒表面形成固溶体壳层LiAlxMn2-xO4.
3.3 结构分析
图5给出了未改性尖晶石型LiMn2O4正极材料和各个改性阶段样品的XRD分析谱图,从图5中可以看到,各个样品的XRD谱都很相似,均对应立方晶系Fd3m空间点群,出现了(111)、(311)、(222)、
(400)、(331)、(511)、(400)和(531)八个衍射峰,各峰均窄而尖锐,与标准卡对比(JCPDS 35-782)后,得到改性前后的各个样品都是尖晶石型LiMn2O4结构.各XRD图中都没有多余的杂峰出现,说明A3、A5样品表面形成的Al(NO3)3和Al2O3均属于无定形结构,整个改性过程都没有破坏尖晶石型LiMn2O4原有的结构.
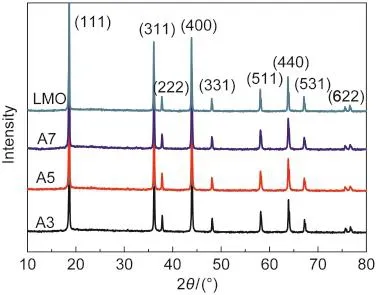
图5 不同样品的XRD图谱Fig.5 X-ray diffraction(XRD)patterns of different samples
表1给出了各个样品对应的晶胞参数以及(400)峰的位置.从表中看到,(400)峰向高衍射角移动,说明改性样品有更小的晶胞常数和晶胞体积.各个温度下改性处理的样品晶胞常数和晶胞体积都比未改性LiMn2O4粉末的小.包覆层中Al3+离子替代部分Mn3+或Mn4+形成固溶体LiAlxMn2-xO4,由于Al3+(0.053 nm)离子半径比Mn3+(0.066 nm)和Mn4+(0.060 nm)离子半径都小,并且Al―O(512 kJ· mol-1)键比Mn―O(402 kJ·mol-1)键的键能更强,有更强的八面体位择位能(OPE),28因此会缩短结合键键长.所以,当Al3+替代Mn3+或Mn4+占据八面体中16d位置时,晶胞体积会收缩,晶格常数会变小.29更小的晶格常数和更大的键能可以起到稳定尖晶石结构的作用.30尖晶石结构的稳定可以有效减小Jahn-Teller效应,有利于提高活性物质的电化学性能.另外,根据相似相溶原则,包覆层中Al3+会优先替代Mn3+形成固溶体LiAlxMn2-xO4,从而会减小改性颗粒表面Mn3+离子的浓度,有利于进一步减小Jahn-Teller效应.
3.4 Mn溶解分析
为了分析表面掺杂包覆改性前后尖晶石型LiMn2O4正极材料锰溶解量的大小,将LMO和A7样品各称取20 mg,分别浸入10 mL电解液中,在60°C下密封存放一周.然后过滤得到澄清滤液,采用电感耦合等离子体原子发射光谱(ICP-AES)测试了Mn在滤液中的含量.测试结果见表2.
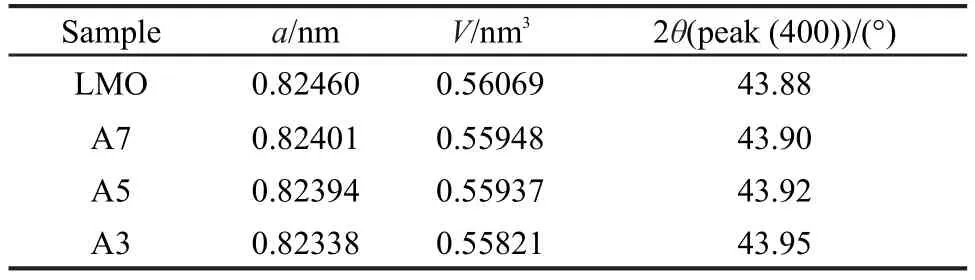
表1 不同样品对应的的结构参数Table 1 Structural parameters of different samples

表2 ICP-AES测定Mn溶解量Table 2 Mn dissolution contents with ICP-AES test
从表2中可以清楚地看到,经过表面掺杂包覆改性后,Mn在电解液中的溶解量大幅度地降低了,降幅达96%,说明在LiMn2O4颗粒表面生成的固溶体壳层能起到有效的保护作用,将LiMn2O4与电解液很好地隔离开,显著地减弱了Mn在电解液中的溶解.同时这层固溶体(LiAlxMn2-xO4)具有离子掺杂的特性,Al―O比Mn―O键强大,结构更稳定,使Mn3+不易与电解液发生岐化反应.因此表面掺杂包覆改性方法具有包覆与掺杂的双重优点,能更好地提高尖晶石型LiMn2O4正极材料的电化学性能.
4 结论
采用表面掺杂包覆改性的方法对尖晶石型LiMn2O4正极材料进行改性,制备了不同热处理温度下的样品.研究发现当热处理温度为700°C时,修饰改性的尖晶石LiMn2O4具有最优的电化学特性.其最大比容量为133.6 mAh·g-1,室温循环50周容量衰减3.4%.Al3+扩散进入尖晶石结构中在颗粒表面形成结构稳定的固溶体包覆层,不仅能提高尖晶石型LiMn2O4晶体结构的稳定性,也能降低Mn在电解液中的溶解.此次改性研究在最大限度保持原粉比容量的基础上,提高了尖晶石型LiMn2O4正极材料的循环性能,有利于促进尖晶石型LiMn2O4电池材料的商业化.
(1) Thackeray,M.M.;David,W.I.F.;Bruce,P.G.;Goodenough,J. B.Mat.Res.Bull.1983,18,461.
(2) Kim,J.;Manthiram,A.Nature 1997,390,265.
(3) Tarascon,J.M.;Armand,M.Nature 2001,414,359.
(4) Tanaka,T.;Ohta,K.;Arai,N.J.Power Sources 2001,2,97.
(5) Xia,Y.;Yoshio,M.J.Electrochem.Soc.1996,143,825.
(6)An,H.L.;Wu,N.N.;Lei,X.L.;Xu,J.L.;Qi,L.Acta Phys.-Chim.Sin.2007,23,60.[安洪力,吴宁宁,雷向利,徐金龙,其 鲁.物理化学学报,2007,23,60.]
(7) Wang,J.;Li,T.J.;Qi,L.Acta Phys.-Chim.Sin.2007,23,75. [王 剑,李桐进,其 鲁.物理化学学报,2007,23,75.]
(8)Katakura,K.;Wada,K.;Kajiki,Y.;Yamamoto,A.;Ogumi,Z. J.Power Sources 2009,189,240.
(9) Jiang,C.H.;Dou,S.X.;Liu,H.K.;Ichihara,M.;Zhou,H.S. J.Power Sources 2007,172,410.
(10) Xia,Y.;Zhou,Y.;Yoshio,M.J.Electrochem.Soc.1997,144, 2593.
(11) Jang,D.H.;Oh,S.M.J.Electrochem.Soc.1997,144,3342.
(12) Moon,H.S.;Park,J.W.J.Power Sources 2003,119-121,717.
(13) Shi,S.;Ouyang,C.;Wang,D.S.;Chen,L.;Huang,X.Solid State Commun.2003,126,531.
(14) Tang,Z.Y.;Fan,X.H.;Zhang,N.Acta Phys.-Chim.Sin.2005, 21,934.[唐致远,范星河,张 娜.物理化学学报,2005,21, 934.]
(15) Tang,Z.Y.;Feng,J.J.Acta Phys.-Chim.Sin.2003,19,1025. [唐致远,冯季军.物理化学学报,2003,19,1025.]
(16) Xiong,L.L.;Xu,Y.L.;Zhang,C.;Zhang,Z.W.;Li,J.B. J.Solid State Electrochem.2011,15,1263.
(17) Xiong,L.L.;Xu,Y.L.;Tao,T.;Goodenough,J.B.J.Power Sources 2012,199,214.
(18) Raja,M.W.;Mahanty,S.;Basu,R.N.J.Power Sources 2009, 192,618.
(19) Yuan,A.;Tian,L.;Xu,W.;Wang,Y.J.Power Sources 2010, 195,5032.
(20) Matsumoto,K.;Fukutsuka,T.;Okumura.T.;Uchimoto,Y.; Amezawa,K.;Inaba,M.;Tasaka,A.J.Power Sources 2009, 189,599.
(21) Ouyang,C.Y.;Zeng,X.M.;Sljivancanin,Z.J.Phys.Chem.C 2010,114,4756.
(22) Gnanaraj,J.S.;Pol,V.G.;Gedanken,A.;Aurbach,D. Electrochem.Commun.2003,5,940.
(23) Walz,K.A.;Johnson,C.S.;Genthe,J.;Stoiber,L.C.;Zeltner, W.A.;Anderson,M.A.;Thackeray,M.M.J.Power Sources 2010,195,4943.
(24) Li,X.F.;Xu,Y.L.Appl.Surf.Sci.2007,253,8592.
(25) Li,X.F.;Xu,Y.L.Electrochem.Commun.2007,9,2023.
(26) Xu,Y.L.;Li,X.F.;Ge,L.P.Appl.Surf.Sci.2007,253,8453.
(27) Xiong,L.L.;Xu,Y.L.;Tao,T.;Du,X.F.;Li,J.B.J.Mater. Chem.2011,13,4937.
(28) Yi,T.F.;Hu,X.G.;Gao,K.J.Power Sources 2006,162,636.
(29) Thirunakaran,R.;Sivashanmugam,A.;Gopukumar,S.;Dunnill, C.W.;Gregory,D.H.J.Phys.Chem.Solids 2008,69,2082.
(30) Xiao,L.;Zhao,Y.;Yang,Y.;Cao,Y.Electrochim.Acta 2008, 54,545.
December 26,2011;Revised:February 24,2012;Published on Web:March 9,2012.
Doping-Coating Surface Modification of Spinel LiMn2O4Cathode Material with Al3+for Lithium-Ion Batteries
XIONG Li-Long XU You-Long*ZHANG Cheng TAO Tao
(International Center for Dielectric Research,Electronic Material Research Laboratory of Ministry of Education, Xiʹan Jiaotong University,Xiʹan 710049,P.R.China)
A doping-coating surface modification method was used to improve the cycle performance of the lithium-ion battery cathode material spinel LiMn2O4.Al was chosen as the doping element and Al(NO3)3as the raw material.We investigated Al3+doping of 7.1%(atomic fraction)at the temperatures of 300,400, 500,600,700,750,and 800°C.It was found that at increasing temperatures,the maximum specific capacity of the modified samples first increased and then decreased,with a maximum at 700°C.The fading rate increased initially with temperature as well,and then decreased,followed by a small rise with temperature.This is because the coated layer gradually reacted with the LiMn2O4granule at elevated temperatures and became a completely solid solution layer by 750°C.The fading rate reached the minimum at the same time.Subsequently,the solid solution layer diffused into the LiMn2O4granule,weakening the granule protection so that the fading rate slightly increased.Among these samples,the maximum specific capacity(133.6 mAh·g-1)was for the sample treated at 700°C for 5 h,and the fading rate was 3.4%after 50 cycles.It is shown that doping-coating surface modification with Al3+may enable the commercial application of spinel LiMn2O4cathode material for lithium-ion batteries.
Lithium-ion battery;Cathode material;Spinel LiMn2O4;Doping-coating surface modification; Solid solution
10.3866/PKU.WHXB201203092
O646;TM911
∗Corresponding author.Email:ylxuxjtu@mail.xjtu.edu.cn;Tel:+86-29-82665161

