红土镍矿真空碳热还原过程中镁的行为
罗启,曲涛,刘大春,徐宝强,杨斌,戴永年
(1.昆明理工大学 真空冶金国家工程实验室,云南 昆明,650093;2.云南省复杂有色金属资源清洁利用国家重点实验室(培育基地),云南 昆明,650093;3.云南省有色金属真空冶金重点实验室,云南 昆明,650093)
金属镍具有良好的延展性、机械强度和很高的化学稳定性等优异性能,使其广泛应用于生产不锈 钢、各种合金和电镀等,已经成为现代社会中不可或缺的金属[1]。根据矿石中镍、钻含量和矿石类型的差异,镍的冶炼方法分别为湿法、火法和湿法火法结合的工艺[2−3]。在湿法工艺中,还原焙烧−氨浸工艺[4]和硫酸加压酸浸工艺[5−6]只能处理褐铁矿型红土镍矿,且具有回收成本高、经济效益低及对环境污染严重等缺点[7−8]。火法工艺中,主要是处理硅镁型红土镍矿,主要流程是回转窑−电炉工艺,产品是镍铁或镍硫,其最大的缺点是渣量大、能耗高,且还原产物中镍的质量分数较小[9−10]。由于受我国镍矿资源条件所限(硫化铜镍矿为 86%、红土型镍矿只占 9.6%),我国对红土镍矿的提炼一直难以取得突破性进展[11]。云南元江镍矿镍储量 43万 t,占全国第 2位,是一个典型的高MgO、高SiO2含量(质量分数,下同)的蛇纹石结合型贫红土镍矿[12],各元素的平均质量分数为Ni 0.83%,Fe 11%,MgO 28%,SiO237%[13]。自20世纪60年代以来,国内外虽然对该矿的开发利用进行了大量的研究,但是这些研究均是以回收矿物中的镍和钴作为最基本的出发点,而把矿物中所含价值极高的镁作为一种有害杂质进行处理,因此,元江贫红土镍矿的开发必须综合考虑镁的产品结构和经济利用[13−14]。真空冶金具有能耗低、清洁、环境友好等特点而得到了较多的关注[15],因此本文利用真空热还原原理[16−17],提出红土镍矿真空碳热还原回收镁富集镍铁新工艺处理元江红土镍矿,在冷凝系统回收金属镁,镍、铁在渣中得到富集。目前,真空碳热还原红土镍矿还处于实验研究阶段,缺乏基础性研究和理论指导。为此,本文作者在热力学分析基础上,对反应后还原产物和冷凝物进行化学成分、XRD和SEM-EDS分析,探讨红土镍矿真空碳热还原过程中镁的行为,以期掌握真空碳热还原红土镍矿的基本规律,为红土镍矿真空碳热还原新工艺中对镁的回收提供理论和技术依据。
1 实验
1.1 实验原料与设备
红土镍矿来源于云南元江镍矿,采样为块状,实验室用南京大学仪器厂制造的行星球磨机(型号为QM-BP,球磨转速为400 r/min)研磨至粒度小于0.106 mm备用。其化学成分分析如表1所示。由表1可知:该红土镍矿硅镁含量高、铁含量低,是典型的硅镁红土镍矿。
还原剂煤炭来自云南大舍煤矿,取样研磨至粒度小于0.106 mm备用,其成分分析结果如表2所示,其中灰分含SiO260.75%,Al2O326.3%,TiO22.47%。使用实验室自行设计型号为ZKS-07-02的立式真空炉进行实验,实验设备见图1。

表1 实验用红土镍矿的化学成分(质量分数)Table 1 Component of saprolite nickel laterite ore %

表2 煤炭成分分析(质量分数)Table 2 Analysis results of coal %
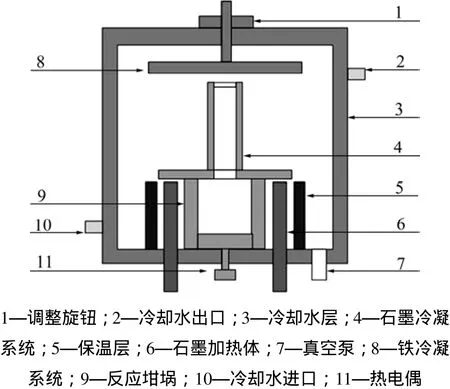
图1 真空炉示意图Fig.1 Schematic diagram of vacuum furnace
1.2 实验方法
将煤炭和红土镍矿球磨混合均匀,在6~8 MPa的压力下制成20 mm×25 mm(直径×高度)块后放入真空干燥箱,在150 ℃条件下干燥30~60 min。取出置于坩埚中,密封真空炉。打开水冷装置,抽真空至极限(15 Pa),升温至一定温度后恒温,物料将在石墨坩埚内发生反应,挥发物在冷凝系统冷凝。恒温一定时间后停止加热,冷却至室温,开炉取样。
完成上述实验后对反应残渣进行化学元素分析,采用日本理学公司 Rigaku X线自动衍射仪(XRD)(TTRⅢ)对冷凝物和反应残渣进行物相分析,使用Cu Kα,扫描区间为 10°~95°;采用 Philips XL30ESEM-TMP型扫描电子显微镜观察冷凝物的形貌,并用能谱仪(EDAX产PHOENIXTM)分析其表面元素含量。过程中,Mg的还原率R为:

式中:w1为渣中 Mg的质量分数;w2为入炉原料中Mg的质量分数。
2 理论分析
2.1 矿物的分解与还原反应热力学
硅镁型红土镍矿属难处理低品位含镍红土矿,其成分复杂,煅烧能够改变红土镍矿的微观结构,促进矿物的分解,有利于红土镍矿中氧化物的还原。图 2所示为红土镍矿在不同的温度条件下煅烧 90 min后的X线衍射分析图谱。
由图 2可知:原矿主要矿物组成为滑石(Mg3Si4O10(OH)2)、(含镍)利蛇纹石((Mg,Al)3-[(Si,Fe)2O5(OH)4])、针铁矿(Fe2O3·H2O)、石英及脉石等,镍含量低接近 XRD检测限(1%),在图中没有发现含镍的结晶物相,因此,镍应该是以取代硅酸盐晶格中镁或铁的形式存在;通过500 ℃煅烧以后,结晶水全部被脱除,矿物分解为 Fe2O3,MgO·Fe2O3,2MgO·2SiO2和 2FeO·SiO2;在 700 ℃煅烧后,SiO2的特征衍射峰明显减弱,其有可能联合 MgO·Fe2O3,2MgO·2SiO2和 2FeO·SiO2发生分解化合反应生成Fe2O3,2MgO·SiO2和 MgO·SiO2,为矿物的还原创造条件;当煅烧温度为1 450 ℃时,物相的种类没有发生大的变化,只是SiO2的特征衍射峰消失,2MgO·SiO2和 MgO·SiO2的特征衍射峰多而强,说明其含量有所增加,但此时物料发生熔融,结构紧密,气孔率低,还原性差。因此,煅烧温度不宜过高,应控制在500~700 ℃。

图2 原矿经不同温度煅烧后X线衍射分析结果Fig.2 XRD patterns of saprolite laterite ore after roasting at different temperatures
采用固体还原剂碳还原金属氧化物,且温度高于1 273 K时,文献[18]认为还原反应由如下2步完成:
(1)CO还原氧化物,MeO+CO=Me+CO2;
(2)CO2与C反应生CO,CO2+C=2CO。
但是,在真空条件下的含碳球团表现为疏松和多孔性,CO气体很容易扩散出去,其分压很低。因此,当采用固体还原剂还原氧化镁,且温度为1 273~1 900 K时,体系内可能发生以下气−固和固−固反应:
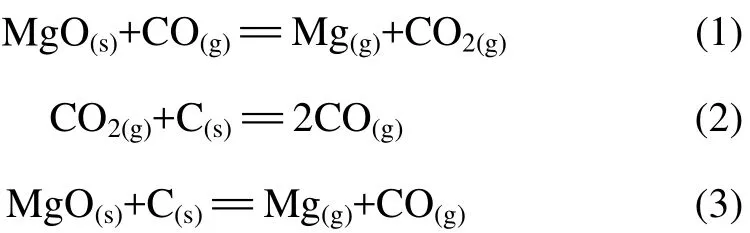
考虑到实验是在15~200 Pa下进行,因此,查阅相关的热力学数据[19],运用“物质吉布斯自由能函数法”[20]对反应(1)~(3)在系统压力为100 Pa下独立进行时的吉布斯自由能与温度的关系进行计算,结果如图3所示。从图3可以看出,在系统压力为100 Pa时,对于反应(1),当温度升高到1 900 K时,吉布斯自由能仍然为正,反应不能向右进行;反应(2)的吉布斯自由能总是负的,因此,CO2在温度高于1 300 K,且有固体C存在的条件下是不能稳定存在的,这与布多尔反应理论相吻合;对于反应(3),随着温度的升高,吉布斯自由能大幅度下降,反应的驱动力大,其起始反应温度为1 476 K。因此,氧化镁真空碳热还原反应机理是碳颗粒直接还原的固−固反应(3)。

图3 100 Pa下吉布斯自由能和温度的关系Fig.3 Relationships between Gibbs free energy and temperature at 100 Pa
2.2 金属镁的挥发与冷凝
金属在一定温度下有固定的蒸气压,其挥发性取决于在一定温度下的蒸气压。纯物质的饱和蒸气压(p)与温度(T)的关系可表示为[16]:
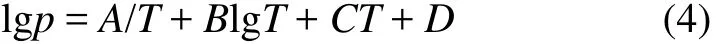
式中:A,B,C,D分别为蒸发常数。由式(4)可知:环境的气体压力对金属的蒸发有显著影响。图4所示为金属镁蒸气压与温度关系。由图4可知:金属镁的蒸气压随温度的升高而迅速增大,挥发性增强,在1 350 K时,金属镁蒸气压达到57.6 kPa,因此,在真空(15~200 Pa)碳热还原氧化镁的过程中金属镁极易挥发。

图4 金属镁的蒸气压(P)和温度(T)的关系Fig.4 P−T diagram of Mg

图5 单元系相平衡图Fig.5 Unary system phase diagram
金属蒸气引入冷凝区,冷凝成液态或者固态,遵循一定的温度和压强条件。图5所示为单元系相平衡图[16],其中:BO为冷凝曲线,AO为升华曲线和OC为熔融曲线,三线相交于点O,在O点三相共存,每种金属在三相点有其确定的温度T0和压强p0。对于金属镁,三相点[16]的温度T0=923 K,压强p0=333 Pa。在真空碳热还原红土镍矿过程中,体系压力为15~200 Pa,低于p0,因此,镁的冷凝过程将类似于图中b点,温度降低,b点向左水平移动,到达 AO线上气体成为饱和状态,开始出现固体,然后移入固相区(s区)成为过饱和气体,凝华成固体,容易形成镁粉。在冷凝系统刮取金属镁时,易燃易爆,存在一定的危险性。基于此,冷凝系统的设计有待改善。
3 结果与讨论
3.1 反应温度的影响
红土镍矿与煤炭质量比为 100:40,系统压力为15~200 Pa,在不同温度下反应90 min,镁还原率和渣中镍含量与温度的关系如图6所示。由图6可知:还原温度对镁还原率和镍含量有显著影响;当温度低于1 373 K时镁的还原率趋近于0,当温度为1 573 K时还原率为6.4%,说明镁开始被还原;温度继续升高,镁的还原率迅速上升,当温度为1 773 K时,镁还原率达到94.45%,渣中镍含量为3.32%,富集了3.32倍。

图6 温度对镁还原率和镍含量的影响Fig.6 Effect of temperature on reduction ratio of Mg and grade of Ni
还原产物的XRD图谱如图7所示。从图7(a)可以看出:当温度为773 K时,主要物相为SiO2,MgFe2O4,(Fe0.5Mg1.5)Si2O6和Ni1.43Fe1.7O4,并没有金属Fe和Ni生成;当温度为973 K时,开始生成Fe和Fe3Ni2,随着温度的升高,Fe和Fe3Ni2的衍射强度增强;在1 173 K时,XRD图谱显示还原产物中含有明显的Fe,Fe3Ni2和Mg2SiO4的特征衍射峰,没有发现镍、铁氧化物的特征衍射峰,且在冷凝系统没有收集到冷凝物。说明此时红土镍矿中硅、镁的氧化物没有和碳发生反应,而镍、铁的氧化物和碳发生了一系列的反应,生成了金属Fe和Ni,并且部分铁和镍形成了固溶体镍铁合金。
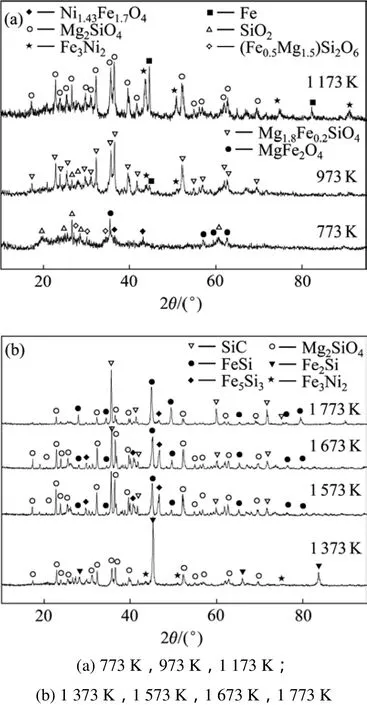
图7 在不同温度下还原产物的XRD图谱Fig.7 XRD patterns of slags after different reaction temperature
从图7(b)可以看出:当温度为1 373 K时,Fe的特征衍射峰消失,出现了强的 Fe3Si的特征衍射峰,说明此温度SiO2和C开始反应生成了SiC,继而SiC与 Fe反应生成 Fe-Si合金,此实验结果与加西克[21]对Fe-Si-C三元系的研究相符合。当温度为1 573 K时,还原产物的物相种类发生了较大的变化,Mg2SiO4的衍射峰有所减弱,Fe3Si的衍射峰消失,出现了SiC,FeSi和Fe5Si3的特征衍射峰,说明在此温度条件下,镁的氧化物和碳开始发生反应,硅的氧化物和碳发生了较激烈的反应,使得Fe-Si合金中Si的含量不断升高,依次形成了Fe3Si,Fe5Si3和FeSi,此结果与二元合金相图理论结果[22]相吻合。当温度为1 773 K时,还原产物主要物相为SiC和FeSi,以及少量的Fe5Si3和 Mg2SiO4。
3.2 还原煤用量的影响
还原剂的加入量直接影响红土镍矿中氧化物的还原气氛,还原剂含量不够则镁不能充分还原,还原剂含量过量致使还原球团内部仍残留大量游离碳,会降低渣中镍的含量。当温度为 1 723 K、系统压力为15~200 Pa时,在不同还原煤用量(与红土镍矿质量比计)条件下反应90 min,其还原效果如图8所示。
从图8可知:还原煤用量对还原效果影响显著,镁的还原率随着还原煤用量的增加而急剧增大,当还原煤用量为60%(质量分数)时,镁的还原率达到74.6%;渣中镍含量随着煤用量的增加先增大后减小,当还原煤用量为50%时最大为1.95%。这表明通过增加红土镍矿含碳球团中碳含量可以达到一个更好的还原效果。其原因是:随着碳含量增加,混合物中氧化镁和碳之间的接触面积增大,加快了碳对氧化镁的还原。

图8 还原煤用量对镁还原率和镍含量的影响Fig.8 Effect of reductant contention on reduction ratio of Mg and grade of Ni
3.3 添加剂的影响
由上述实验可知:红土镍矿球团还原要达到较好的效果,需要较高的温度和煤用量,这不利于节能降耗。为了提高含碳球团的还原效果,国内外科研人员进行了许多相关的研究,得出加入添加剂(催化剂)是一种较有效的方法[23]。红土镍矿与煤炭质量比为100:50,温度为1 723 K,系统压力为15~200 Pa,在不同添加剂(添加量均为红土镍矿质量的 6%)作用下反应90 min,其还原效果如图9所示。
从图9可以看出:不同添加剂的催化能力具有一定的差异,CaO和CaF2的催化效果显著,镁的还原率分别达到 99.87%和 99.8%,镍的含量达到 3.31%和3.3%,明显优于Na2CO3和NaCl。对于添加剂强化还原的机理,研究者提出了不同的理论[24]可概括为:添加剂可以强化碳气化反应;促进固相扩散反应;导致矿物晶格的畸变,降低了其表观反应活化能等。因此,添加剂强化红土镍矿球团还原的作用机理较复杂,受还原温度和添加剂类别等因素的影响,是多种因素耦合作用的结果。具体的作用机理有待进一步探索和研究。综合而言,本实验所涉及的添加剂中以 CaO和CaF2催化效果较好,可为降低红土镍矿碳热还原温度以及缩短还原时间提供帮助。

图9 添加剂对镁还原率和镍含量的影响Fig.9 Effect of additives on reduction ratio of Mg and grade of Ni
3.4 反应时间的影响
红土镍矿与煤炭质量比为100:50,CaF2添加量为6%,系统压力为15~200 Pa,在1 723 K下反应30,50,70,90和110 min,其还原效果如图10所示。从图10可知:镁的还原率和镍含量均是随反应时间的延长而增大,最后趋于稳定,110 min时氧化镁的还原过程基本完成,镁的还原率达到 99.99%,镍含量达到3.34%。其原因是:红土镍矿含碳球团的还原受反应时间的制约,在反应开始阶段,红土镍矿表面某些质点的氧化物优先得到还原,并逐渐向中心推进,过程中受界面反应和形核势垒的限制,故110 min后镁的还原才能完成。
3.5 冷凝物的分析

图10 反应时间对镁还原率和镍含量的影响Fig.10 Effect of reaction time on reduction ratio of Mg and grade of Ni

图11 不同冷凝层冷凝物的XRDFig.11 XRD patterns of condensate in different condensing system
对不同冷凝系统的冷凝物进行 XRD分析,其结果如图11所示。从图11可知,金属镁受到不同程度的污染,主要污染物为Mg2Si,SiO2和MgO,随着冷凝层的上升,污染物逐渐减少,钢板冷凝系统中得到的冷凝物只受少量 MgO的污染。因此,在不同冷凝系统得到金属镁的纯度不一样。图12所示为钢板冷凝系统金属镁块的电镜和能谱图。从图12可以看出:金属镁呈层状冷凝,结晶较为疏松,含Mg 95.59%,并含有少量O元素(其质量分数为4.41%)。
对污染物的形成进行分析,其中氧化镁的形成可能为,一是金属Mg与CO发生逆反应,二是金属镁被残余氧气氧化。化学反应方程式及其热力学分析[19−20]如下(其中P系为化学反应独立进行时的系统压力,下同):


图12 冷凝物金属镁的扫描电镜分析Fig.12 SEM image of condensate Mg

式中:ΔGT为吉布斯自由能,J/mol。
对于污染物Mg2Si和SiO2,其形成原因是:在红土镍矿真空碳热还原过程中,SiO2还原为低价SiO气体,而SiO气体高温稳定低温容易发生歧化反应,因此当SiO气体挥发至冷凝系统时将生成Si和SiO2,污染金属镁。化学反应方程式及其热力学分析[19−20]如下:


根据式(5)~(9)得到不同压力下吉布斯自由能与温度之间的关系如图13所示。由图13可以看出:反应(7)在1~100 Pa下的起始反应温度为1 240~1 334 K,低于氧化镁的起始反应温度(1 476 K),因此,在红土镍矿真空还原回收镁的同时不可避免会产生 SiO气体,污染金属镁;反应(5),(6),(8)和(9)均为体积缩小的放热反应,在系统压力为1 Pa,温度为1 300 K以下时,吉布斯自由能均为负值。因此,在试验过程中(15~200 Pa),在温度较低(300~1 723 K)的冷凝系统,金属 Mg会与 CO,O2和 Si发生反应生成 MgO和Mg2Si,影响镁的纯度。

图13 不同压力下反应(5)~(9)的吉布斯自由能与温度的关系Fig.13 Relationships between Gibbs free energy and temperature for reactions(5)~(9)at different pressures
4 结论
(1)真空条件下氧化镁的还原是固体碳直接还原的固−固反应,临界反应温度为1 476 K,生成的金属镁极易挥发,在冷凝系统凝华收集。
(2)红土镍矿真空碳热还原产物主要为SiC,Fe-Si合金,Mg2SiO4,Mg和SiO气体,SiO在冷凝系统歧解生成Si和SiO2;随着反应温度的升高、还原煤用量的增加和反应时间的延长,镁的还原率显著增大,渣中镍的含量也有所上升;添加剂强化红土镍矿还原的作用受还原温度和添加剂类别等因素的影响,实验所涉及的添加剂中以CaO和CaF2的催化效果较好。
(3)镁蒸气与CO,O2和Si的反应均为体积缩小的放热反应,在系统压力为1 Pa时,其吉布斯自由能仍有可能为负值,生成MgO和Mg2Si,降低金属镁的纯度。
[1]GUO Xue-yi,LI Dong,Park K H,et al.Leaching behavior of metals from a limonitic nickel laterite using a sulfation-roastingleaching process[J].Hydrometallurgy,2009,99:144−150.
[2]Loveday B K.The use of oxygen in high pressure acid leaching of nickel laterites[J].Minerals Engineering,2008,21(7):533−538.
[3]梁威,王晖,符剑刚,等.从低品位红土镍矿中高效回收镍铁[J].中南大学学报:自然科学版,2011,42(8):2173−2177.LIANG Wei,WANG Hui,FU Jian-gang,et al.High recovery of ferro-nickel from low grade nickel laterite ore[J].Journal of Central South University:Science and Technology,2011,42(8):2173−2177.
[4]Orquidea C,Federico G,Ianeya H.Cobalt and nickel recoveries from laterite tailings by organic and in organic bio-acids[J].Hydrometallurgyk,2008,94(1):18−22.
[5]CHEN Sheng-li,GUO Xue-yi,SHI Wen-tang,et al.Extraction of valuable metals from low-grade nickeliferous laterite ore by reduction roasting-ammonia leaching method[J].J Cent South Univ Technol,2010,17(4):765−769.
[6]Coto O,Galizia F,Hernadez I,et al.Cobalt and nickel recoveries from laterite tailings by organic and inorgnic bio-acids[J].Hydrometallurgy,2008,94(1/2/3/4):18−22.
[7]ZHAI Yu-chun,MU Wen-ning,LIU Yan,et al.A green process for recovering nickel from nickeliferous laterite ores[J].Transactions of Nonferrous Metals Society of China,2010,20(S1):s65−s70.
[8]Mcdonald R G,Whittington B I.Atmospheric acid leaching of nickel laterites review(Part Ⅰ):Sulphuric acid technologies[J].Hydrometallurgy,2008,91:35−55.
[9]Pelino M,Kararnanov A,Pisciella P,et al.Vitrification of electric arc furnace dusts[J].Waste Manage Ment,2002,22(8):945−949.
[10]Agatzini S L,Zafiratos I G,Spathis D.Beneficiation of a Greek serpentinic nickeliferous ore[J].Hydrometallurgy,2004,74:259−265.
[11]王成彦,尹飞,陈永强,等.国内外红土镍矿处理技术进展[J].中国有色金属学报,2008,18(S1):s1−s9.WANG Cheng-yan,YIN Fei,CHEN Yong-qiang,et al.Worldwide processing technologies and progress of nickel laterites[J].The Chinese Journal of Nonferrous Metals,2008,18(S1):s1−s9.
[12]乔富贵,朱杰勇,田毓龙.全球镍资源分布及云南镍矿床[J].云南地质,2005(4):395−401.QIAO Fu-gui,ZHU Jie-yong,TIAN Yu-long.Nickel resources distribution in the world and nickel resources of Yunan[J].Yunnan Geology,2005(4):395−401.
[13]徐宝强,裴红彬,杨斌,等.真空碳热还原脱除红土镍矿中镁的研究[J].真空科学与技术学报,2011,31(3):341−347.XU Bao-qiang,PEI Hong-bin,YANG Bin,et al.The carbothermic reduction process for magnesium removal from nickel laterite in vacuum[J].Chinese Journal of Vacuum Science and Technology,2011,31(3):341−347.
[14]King M G.Nickel laterite technology-finally a new dawn[J].ABI/INFORM Trade &Industry,2005(7):35−39.
[15]何德文,刘蕾,肖羽堂,等.真空冶金回收废旧锌锰电池的汞和镉试验研究[J].中南大学学报:自然科学版,2011,42(4):893−895.HE De-wen,LIU Lei,XIAO Yu-tang,et al.Experimental research on recycling of Hg and Cd from waste zinc-manganic batteries by vacuum metallurgy[J].Journal of Central South University:Science and Technology,2011,42(4):893−895.
[16]戴永年,杨斌.有色金属材料的真空冶金[M].北京:冶金工业出版社,2003:7−43.DAI Yong-nian,YANG Bin.Non-ferrous metal materials vacuum metallurgy[M].Beijing:Metallurgical Industry Press,2003:7−43.
[17]QI Tian-gui,LIU Nan,LI Xiao-bin,et al.Thermodynamics of chromite ore oxidative roasting process[J].J Cent South Univ Technol,2011,18(1):83−88.
[18]傅崇说.有色冶金原理[M].北京:冶金工业出版社,2005:51−74.FU Chong-yue.Principle of non-ferrous metallurgy[M].Beijing:Metallurgical Industry Press,2005:50−75.
[19]叶大伦,胡建华.实用无机物热力学数据手册[M].2版.北京:冶金工业出版社,2002:175−925.YE Da-lun,HU Jian-hua.Thermochemical date of inorganic substance[M].2nd ed.Beijing:Metallurgical Industry Press,2002:175−925.
[20]傅献彩,沈文霞,姚天扬,等.物理化学[M].5版.北京:高等教育出版社,2005:204−386.FU Xian-cai,SHEN Wen-xia,YAO Tian-yang,et al.Physical chemistry[M].5th ed.Beijing:Higher Education Press,2005:204−386.
[21](苏)加西克 М И.铁合金生产的理论和工艺[M].张烽,译.北京:冶金工业出版社,1994:18−241.JIAXIKE M И.Principle and technology of ferroalloy production[M].ZHANG Feng,transl.Beijing:Metallurgical Industry Press,1994:18−241.
[22]戴永年.二元合金相图集[M].北京:科学出版社,2009:518.DAI Yong-nian.Binary phase diagrams[M].Beijing:Science Press,2009:518.
[23]Zambrano A P,Takano C,Nogueira A E A,et al.Reduction behavior of chromite carbon composite pellets,at temperature of 1 873 K[C]//ANNALS-Int Meet Ironmak Int Symp Iron Ore 3rd International Meeting on Ironmaking and 2nd International Symposium on Iron Ore.Maranhao,Brazil:Int Meet Ironmak Int Symp Iron Ore,2008:667−677.
[24]Ding Y L,Warner N A.Catalytic reduction of carbon-chromite composite pellets by lime[J].Thermochimica Acta,1997,292(1/2):85−94.

