核桃壳真空化学活化制备活性炭
杨娟,丘克强
(中南大学 化学化工学院,湖南 长沙,410083)
活性炭作为一种重要的微孔吸附剂,具有丰富的孔结构和巨大的比表面积,广泛应用于空气净化、水处理、催化剂载体等方面。制备活性炭的原料很多,几乎所有的含碳材料都可以用于制备活性炭。然而,在能源危机和环境问题日益严重的今天,利用资源丰富、价格低廉的农林废弃物制备活性炭已经受到许多企业和科研工作者的青睐[1−4]。目前,用农林废弃物制备活性炭的报道非常多,主要原料有椰壳[5]、锯木屑[6]、甘蔗渣[7]、谷壳[8]、麦秆[9]等,但它们绝大多数都是在常压条件下制备的,国内关于真空条件制备活性炭的报道很少。Lua等[10]对比了真空条件与常压条件下制备的活性炭,发现真空条件下得到的活性炭性能更加优越。研究也表明,活性炭的表面形貌、孔径分布、比表面积、吸附性能都与体系压力密切相关[11−12]。此外,与常压条件相比,真空条件还具有以下2方面的优点。一方面,在真空条件下裂解制备活性炭,具有降低原料的碳化温度、洁净生产等优点,因而对节能、环保具有重要意义;另一方面,真空条件有利于生物油及裂解气的收集,对生物质原料的全组分利用也有重要意义。基于真空条件的优点,系统研究真空条件下过程变量对活性炭性能的影响非常有必要。此外,活性炭的表面官能团也是影响活性炭吸附性能的重要因素,其受制备方法和制备条件的影响,而关于这方面的研究报道较少。为此,本文作者以核桃壳为原料,氯化锌为活化剂,采用真空化学活化法制备活性炭,系统地探讨了体系压力、活化温度和浸渍比对活性炭比表面积、孔体积、碘值和亚甲基蓝值的影响;采用等电点与红外分析相结合,探讨了活性炭的表面官能团随制备条件的变化情况。
1 实验
1.1 原料
原料核桃壳的工业分析和元素分析(质量分数)如表1所示。从表1可知:核桃壳含碳量高且灰分低,适宜用于制备活性炭。元素分析中 C,H,N,O,S的含量由BCH-1 和WDL-3C 元素分析仪测定。原料使用前用蒸馏水洗净尘土,于105 ℃下烘干,破碎至0.15~0.90 mm备用。

表1 原料的工业分析与元素分析Table 1 Proximate and ultimate analysis of raw material %
1.2 活性炭的制备
将原料与 ZnCl2以一定的浸渍比R(ZnCl2与原料的质量比)浸渍48 h后烘干。称取15.00 g 样品置于反应器中,并按顺序连接好反应器、冷阱、真空泵。调节真空泵使其达到所需压强并接近稳定,以5 ℃/min的升温速率达到活化温度并保温一段时间。反应结束后,样品在真空条件下冷却。固体产物先后用 0.1 mol/L的盐酸溶液和蒸馏水洗涤数次,直至洗涤液的pH 为6~7,烘干后即可得到所需活性炭。
1.3 活性炭的表征
活性炭的比表面积及孔径分布用 ASAP-2020自动吸附仪测定(在 77.35 K时的氮吸附)。碘吸附量按GB/T 12496.8−1999 测定,亚甲基蓝吸附量按 GB/T 12496.10−1999 测定。等电点采用 Malvern Zetasizer Nano在不同 pH下测定得到。红外光谱由 Nicolet 380FT−IR型红外光谱仪采集得到。
2 结果与讨论
2.1 不同因素对活性炭性能的影响
在所研究的实验条件范围之内,讨论了体系压力(10~100 kPa)、活化温度(350~600 ℃)、浸渍比(0~2.0)对活性炭性能的影响。表2所示为不同条件下制备的活性炭的比表面积、孔体积、孔体积分布、碘吸附量和亚甲基蓝吸附量。
2.1.1 体系压力的影响
由表2可知,随着体系压力的增大,活性炭的比表面积、总孔体积、碘吸附量和亚甲基蓝吸附量均呈先上升后下降的趋势,且在体系压力为30 kPa时达到最大。真空条件下,原料中的易挥发份和裂解过程中产生的不凝气很快被抽离反应器,有机气体的二次裂解受到限制,避免了含碳物在活性炭内部孔道及内表面的沉积,减少了对活性炭孔结构的破坏,因此,体系压力越小,比表面积和孔体积越大,活性炭的吸附性能越好。然而,体系压力过低时,裂解气体挥发过快,可能会破坏活性炭的孔结构,此时,活化剂大量挥发而过度损失,使活化效果降低,导致比表面积和孔体积下降。将最优体系压力(30 kPa)时制备的活性炭与常压(100 kPa)条件制备的活性炭相比可知,其比表面积和总孔体积分别提高了27%和25%,因此,之后的实验均在该优化的体系压力下进行。此外,值得注意的是,体系压力对活性炭的孔体积分布有着重要影响,随着体系压力的增大,活性炭的微孔比率逐渐下降,而中孔比率逐渐升高,表明在低压条件下有利于得到微孔为主的活性炭。
不同体系压力下制备的活性炭的 N2吸附等温线及孔径分布如图1所示。根据 IUPAC分类,图1(a)中所得活性炭的吸附等温线均属于第一类等温线。吸附等温线的初始部分代表活性炭中狭窄微孔的充填过程,而在较高相对压力时,呈现接近水平的吸附曲线,这是由于非微孔(中孔、大孔及外表面)的多层吸附造成的。这些充分说明了活性炭内部含有丰富的微孔结构。此外,从图1(a)还可以看出:活性炭的氮气吸附量在体系压力为30 kPa时达到最大值,这与表2中的数据相吻合。图1(b)所示为不同体系压力时制备的活性炭的BJH孔径分布图。由图1(b)可知:所得活性炭中的中孔大都在5 nm以下。

表2 不同活化条件下制备的活性炭的比表面积、孔体积、孔体积分布、碘吸附量和亚甲基蓝吸附量Table 2 BET surface area,pore volume,pore volume distribution,iodine adsorption value,and methylene blue adsorption value of activated carbon prepared under different conditions
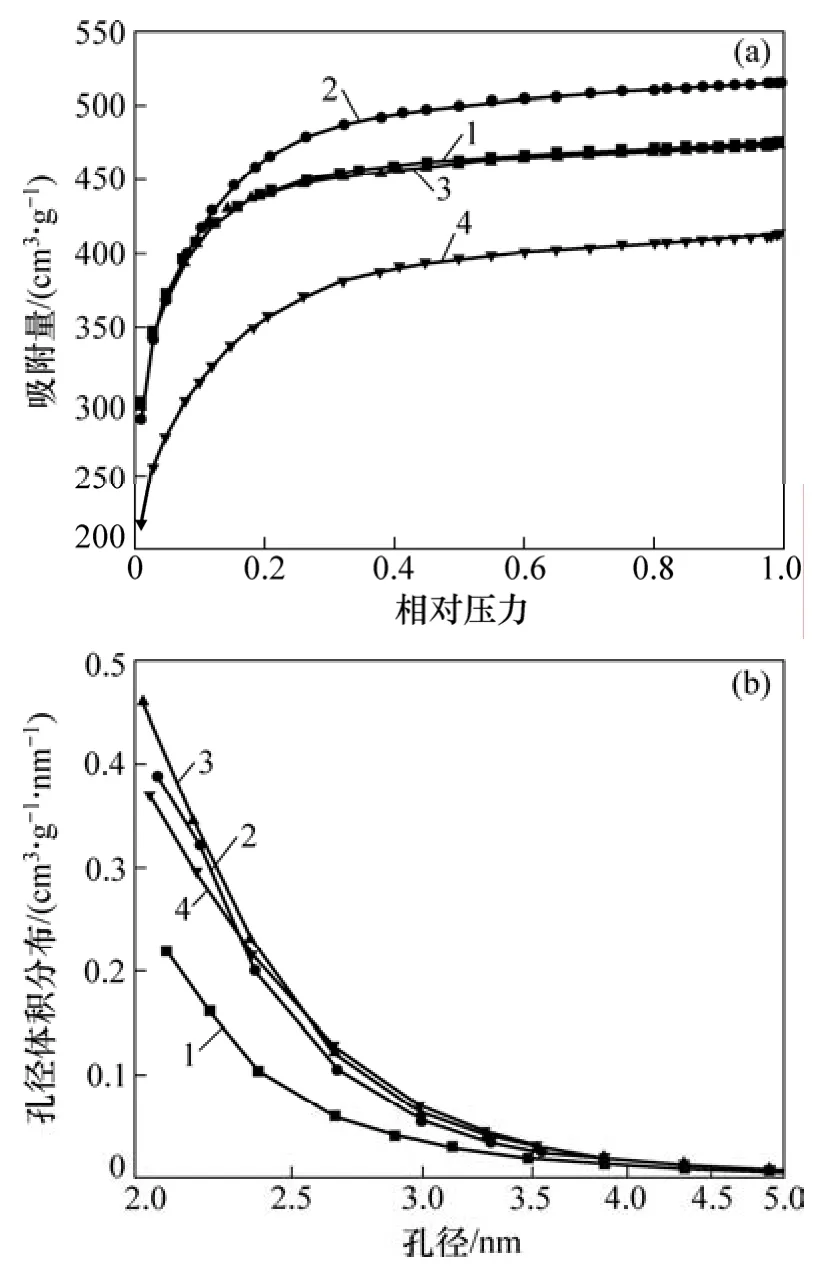
图1 体系压力对活性炭的影响Fig.1 Effects of system pressure on activated carbon
2.1.2 活化温度的影响
由表2可以看到:随着活化温度的变化,活性炭的比表面积、总孔体积、碘吸附量和亚甲基蓝吸附量呈现出相同的变化趋势。随着活化温度的升高,它们先增大后减小,在活化温度为450 ℃时存在最大值。在较低温度范围内(350~450 ℃),随着温度的升高,氯化锌的脱水作用以及易挥发份的挥发越明显,使得活性炭的比表面积和孔体积逐渐增加。当温度从450 ℃升高到 600℃时,活性炭的比表面积和孔体积逐渐下降,这是由以下2个原因造成的:(1)在温度为450 ℃时,易挥发份已经基本释放完全;(2)在较高的温度下,活性炭在高温下的热收缩将导致比表面积和孔体积下降[10],从而进一步导致碘吸附量和亚甲基蓝吸附量逐渐减小。
本文中最佳的活化温度为450 ℃,相比之下,传统氯化锌活化制备活性炭的温度较高,大都在600 ℃以上[13−17]。这表明,真空化学活化法能够降低活化温度,从而有可能降低活性炭制备过程中的能量消耗。
图2(a)所示为不同活化温度时制备的活性炭的N2吸附等温线。根据IUPAC分类,所得活性炭的吸附等温线均属于第一类等温线。随着活化温度的增加,活性炭的氮气吸附量逐渐增加,在活化温度为450 ℃时达到最大值,之后逐渐下降,这与表2中的数据相吻合。图2(b)所示为不同活化温度时制备的活性炭的BJH孔径分布图。由图2可知:所得活性炭中的中孔大都在5 nm以下,且微孔丰富,微孔比率均在65%以上。

图2 活化温度对活性炭的影响Fig.2 Effects of activation temperature on activated carbon
2.1.3 浸渍比的影响
由表2可知:浸渍比对活性炭的比表面积和孔结构的影响非常显著,没有经过氯化锌活化的炭,比表面积很低且孔体积基本为 0 cm3/g。随着浸渍比的增大,活性炭的比表面积、总孔体积和中孔体积均逐渐增大,而微孔体积随着浸渍比的增大先增大后减小,在浸渍比为1.0时存在最大值,这说明浸渍比小于1.0时制备的活性炭中微孔居多,而浸渍比大于1.0时制备的活性炭具有更多的中孔。在低浸渍比时,随着浸渍比的增加,氯化锌的活化作用增强,它可以抑制焦油的产生,有利于易挥发份的挥发,使微孔体积增加。而当浸渍比大于1.0时,原料过度润涨,而且活化过程中易挥发份挥发过快,这些都会导致孔的扩大,微孔被扩宽为中孔甚至大孔,微孔体积下降。此外,随着浸渍比的增大,活性炭的中孔比率逐渐升高,而微孔比率逐渐下降。事实上,在浸渍比为 0.5~2.0的范围内,活性炭的微孔和中孔的比率与浸渍比呈良好的线性关系,R2为0.989。结果表明,通过改变浸渍比,可以对活性炭的微孔和中孔比率在 10%~90%内进行调控。此外,活性炭的碘吸附量和亚甲基蓝吸附量均随浸渍比的增大而增大,浸渍比达到1.0以后增加变慢。在浸渍比为 1.0时所得活性炭的碘吸附量和亚甲基蓝吸附量分别为1 035 mg/g和253 mg/g。
图3(a)所示为不同浸渍比时制备的活性炭的 N2吸附等温线。从图3(a)可以看到:随着浸渍比的变化,活性炭的N2吸附等温线逐渐变化。在较低浸渍比时,观察到的是第一类吸附等温线,说明在此条件下制备的活性炭富含微孔。而当浸渍比增大到 1.5~2.0时,等温线具有第 IV类吸附等温线的特征,即中孔吸附特征。图3(b)所示为不同浸渍比时制备的活性炭的BJH孔径分布图。随着浸渍比的变化,活性炭的孔径分布也呈规律性的变化。
2.2 不同因素对活性炭表面性质的影响
活性炭的吸附性能不仅与其比表面积和孔结构有关,而且与活性炭的表面性质也存在紧密联系。已有大量的研究表明,活性炭上的基团种类和数量对活性炭的吸附性能有重要影响[18−19]。

图3 浸渍比对活性炭的影响Fig.3 Effects of impregnation ratio on activated carbon

图4 不同条件下制备的活性炭Zeta电位随pH的变化Fig.4 Zeta potential−pH evolution of activated carbons prepared under different preparation conditions

图5 不同浸渍比条件下制备活性炭的红外光谱Fig.5 FTIR spectrum of activated carbons prepared under different impregnation ratios
在水溶液中,活性炭表面所带电荷会随着溶液pH不同而发生变化,在某一pH的溶液中活性炭整体所带电荷为 0,这时溶液对应的 pH即为活性炭的等电点。等电点是表征活性炭表面酸碱性的一个重要参数,它与活性炭表面的酸性氧化物特别是羧基、酚羟基等有着密切关系。图4所示为不同条件下制备的活性炭其Zeta电位随pH的变化,从图4可以看出:活性炭的Zeta电位随pH的变化趋势基本一致。在较低pH时,活性炭表面带正电,而在较高pH时,活性炭表面带负电。图4(a)所示为不同体系压力下制备的活性炭其Zeta电位随pH的变化,可以看出,体系压力对活性炭的表面基团基本没有影响,其等电点均在8.5~9.0之间。图4(b)表明,不同温度下制备的活性炭,其等电点都在碱性范围内(7.3~10.0),虽然有一定的变化,但并没有明显规律。相对于体系压力和活化温度,浸渍比对活性炭表面基团的影响非常明显。从图4(c)可以看出:随着浸渍比的增加,活性炭的等电点逐渐向高pH移动(pH=2.1~9.2)。这是由于氯化锌在活化过程中,具有催化脱羟基和脱水作用,使原料中氢和氧以水蒸气形式放出,导致活性炭表面酸性含氧基团减少,从而导致活性炭的等电点逐渐增加。不同浸渍比下制备的活性炭的红外光谱如图5所示。从图5可知:3 400 cm−1附近的吸收峰主要对应于酚羟基的伸缩振动,1 580 cm−1和 1 400 cm−1附近为芳环中C=C双键的振动吸收,478 cm−1的吸收对应于O—H的面内弯曲振动吸收。由图5可以看出:随着浸渍比的增加,含氧基团(主要为酚羟基)的吸收峰逐渐减弱,表明活性炭表面含氧基团数量逐渐减少。总之,浸渍比对活性炭表面性质影响最大,随着浸渍比的增加,活性炭表面酸性基团逐渐减少,温度虽然也是影响活性炭表面基团的一个重要因素,但是在实验条件范围内,温度对活性炭表面基团影响却不是非常明显,而体系压力对活性炭表面的基团基本没有影响。
3 结论
(1)体系压力越低,活性炭的微孔比率越高,中孔比率越低;在30 kPa时制备的活性炭其比表面积和总孔体积比常压条件时分别提高了27%和25%。活性炭吸附性能随温度的升高先增加后降低,最佳活化温度为450 ℃。随着浸渍比的增大,活性炭的比表面积、孔体积、碘值和亚甲基蓝值均逐渐增加,且孔体积分布和浸渍比存在良好的线性关系。
(2)对于活性炭表面的含氧基团,浸渍比影响最大,活化温度次之,而体系压力基本没有影响。
[1]张利波,彭金辉,李宁,等.KOH 活化制备烟杆基活性炭的炭化过程[J].化学工程,2009,37(6): 59−62.ZHANG Li-bo,PENG Jin-hui,LI Ning,et al.Carbonization process in preparation of activated carbon from tobacco stems with KOH-activation[J].Chemical Engineering,2009,37(6):59−62.
[2]陈爱国.稻壳制备活性炭的研究[J].新型炭材料,1999,14(3):58−62.CHEN Ai-guo.Manufacturing activated carbon from rice shell[J].New Carbon Materials,1999,14(3): 58−62.
[3]解立平,林伟刚,杨学民.废弃物基活性炭吸附性能的影响因素[J].新型炭材料,2006,21(2): 156−160.XIE Li-ping,LIN Wei-gang,YANG Xue-min.Factors affecting the adsorbability of activated carbons produced from municipal solid organic waste[J].New Carbon Materials,2006,21(2):156−160.
[4]周鹏伟,李宝华,康飞宇,等.椰壳活性炭基超级电容器的研制与开发[J].新型炭材料,2006,21(2): 125−131.ZHOU Peng-wei,LI Bao-hua,KANG Fei-yu,et al.The development of supercapacitors from coconut-shen activated carbon[J].New Carbon Materials,2006,21(2): 125−131.
[5]Azevedo D,Araujo J,Bastos-Neto M,et al.Microporous activated carbon prepared from coconut shells using chemical activation with zinc chloride[J].Microporous and Mesoporous Materials,2007,100(1−3): 361−364.
[6]Ozacar M,Sengil I A.Adsorption of metal complex dyes from aqueous solutions by pine sawdust[J].Bioresource Technology,2005,96(7): 791−795.
[7]Darmstadt H,Garcia-Perez M,Chaala A,et al.Co-pyrolysis under vacuum of sugar cane bagasse and petroleum residue-Properties of the char and activated char products [J].Carbon,2001,39(6): 815−825.
[8]Liou T,Wu S.Characteristics of microporous/mesoporous carbons prepared from rice husk under base-and acid-treated conditions [J].Journal of Hazardous Materials,2009,171(1/2/3):693−703.
[9]Bagheri N,Abedi J.Preparation of high surface area activated carbon from corn by chemical activation using potassium hydroxide[J].Chemical Engineering Research & Design,2009,87(8A): 1059−1064.
[10]Lua A C,Yang T.Characteristics of activated carbon prepared from pistachio-nut shell by zinc chloride activation under nitrogen and vacuum conditions[J].Journal of Colloid and Interface Science,2005,290(2): 505−513.
[11]Yang J,Qiu K.Preparation of activated carbon by chemical activation under vacuum[J].Environmental Science &Technology,2009,43(9): 3385−3390.
[12]杨娟,丘克强,武菲,等.真空化学活化法制备活性炭[J].过程工程学报,2009,9(3): 586−591.YANG Juan,QIU Ke-qiang,WU Fei,et al.Preparation of activated carbon by vacuum pyrolysis[J].Chinese Journal of Process Engineering,2009,9(3): 586−591.
[13]Onal Y,Akmil-Basar C,Sarici-Ozdemir C,et al.Textural development of sugar beet bagasse activated with ZnCl2[J].Journal of Hazardous Materials,2007,142(1/2): 138−143.
[14]Kalderis D,Bethanis S,Paraskeva P,et al.Production of activated carbon from bagasse and rice husk by a single-stage chemical activation method at low retention times[J].Bioresource Technology,2008,99(15): 6809−6816.
[15]Demiral H,Demiral I,Tumsek F,et al.Pore structure of activated carbon prepared from hazelnut bagasse by chemical activation[J].Surface and Interface Analysis,2008,40(3/4):616−619.
[16]Tsai W T,Chang C Y,Lee S L.A low cost adsorbent from agricultural waste corn cob by zinc chloride activation[J].Bioresource Technology,1998,64: 211−217.
[17]Aygun A,Yenisoy-Karakas S,Duman I.Production of granular activated carbon from fruit stones and nutshells and evaluation of their physical,chemical and adsorption properties[J].Microporous and Mesoporous Materials,2003,66(2/3):189−195.
[18]Rangel-Mendez J R,Streat M.Adsorption of cadmium by activated carbon cloth: influence of surface oxidation and solution pH[J].Water Research,2002,36(5): 1244−1252.
[19]Salame I I,Bandosz T J.Role of surface chemistry in adsorption of phenol on activated carbons[J].Journal of Colloid and Interface Science,2003,264 (2): 307−312.

