缺血性脑卒中患者颈动脉彩色多普勒超声显像和踝臂指数对比研究
惠 冉,杨 慧,李 明,房勤茂
(河北医科大学第三医院超声科,河北 石家庄050000)
脑卒中是严重危害人类健康且致死率、致残率很高的一种疾病,缺血性脑卒中占所有卒中的75%~90%,多项研究证明,颈动脉粥样硬化和踝臂指数是缺血性脑卒中重要的病因及危险因素[1-2]。本研究应用颈动脉彩色多普勒血流成像技术和踝臂指数(ankle-brchial index,ABI)测定,分析缺血性脑卒中患者颈动脉各项参数(内径、内中膜厚度、搏动指数及阻力指数)及ABI的变化,探讨颈动脉彩色多普勒超声各参数与ABI对缺血性脑卒中的诊断价值及两种检测方法的相关性。
1 资料与方法
1.1 一般资料
1.1.1 病例组 本组病例均为河北医科大学第三医院2009-12—2011-10月的住院患者,按照1995年全国第四届脑血管病学术会议修订的诊断标准[3],并经头颅CT或MRI证实为缺血性脑卒中患者118例;年龄33~86岁,平均年龄65岁;无严重心、肝、肾等脏器疾病。
1.1.2 对照组 78例无糖尿病、高血压、高血脂及冠心病等相关性疾病的健康人作为对照组。年龄36~69岁,平均年龄59岁;男43例,女35例。
1.2 仪器与方法
1.2.1 仪器 飞利浦IU22彩色多普勒超声诊断仪,线阵式探头,探头频率7.5MHz,手持式血压计,气囊宽度10cm,长度40cm。
1.2.2 测量方法 颈动脉彩色多普勒超声检测:在安静状态下对研究对象的颈总动脉、颈动脉分叉部及颈内动脉颅外段行彩色多普勒超声检查。检查内容包括:①检查双侧颈动脉有无斑块,观察彩色血流信号有无充盈缺损;计算双侧颈内动脉(ICA)起始端管腔面积,管腔面积减少大于50%(面积狭窄率≥50%)记录为狭窄,管腔面积减少达100%(面积狭窄率=100%)记录为闭塞。②血管内径:距颈总动脉(CCA)分叉水平上方1cm处测量ICA管腔内径。③颈动脉内中膜(IMT)厚度:颈动脉后壁超声显示典型的 “双线征”为IMT。颈总动脉IMT≥1.0mm、颈内动脉颅外段IMT≥1.0mm、颈总动脉膨大处IMT≥1.2mm和斑块形成,满足上述四点中任意一项可视为颈动脉粥样硬化。测量颈内动脉内膜一中层最厚处作为受检者的IMT值。④颈内动脉颅外段多普勒频谱定量分析:将取样容积置于距颈总动脉分叉水平上方1cm处、血管内血流中央,调节取样容积大小使之小于被测血管内径的一半,并调节多普勒角度使其不超过60°,记录收缩期最大血流速度(peak systolic velocity,PSV)、阻力指数(resistive index,RI)、搏动指数(pulsative index,PI)。所有参数测量3个心动周期,取其平均值。ABI检测:患者取仰卧位静卧5min,将血压计袖带缠于上臂或踝部,袖带下缘在肘窝或内踝关节以上2.5cm,用5MHz超声探头在肱动脉或胫后、足背动脉走行区探查动脉信号最佳点,然后将袖带充气,当压力阻断动脉血流时,超声仪屏幕上显示管腔内血流信号消失,继续充气使压力升高20~30mmHg,然后缓慢放气,记录屏幕上血流信号重新出现时血压计读数,即收缩压。先测量双侧肱动脉收缩期血压并取其平均值,若两侧血压差值大于10mmHg则以高值作为肱动脉收缩压,再测同侧胫后动脉和足背动脉,取其中的高值作为踝部收缩压,最后用选定的踝部收缩压除以选定的肱动脉收缩压,所得的值即这一侧的ABI。双侧下肢ABI均需测量的情况,则选择较低的ABI值[4]。ABI正常组:1.0≤ABI≤1.4,ABI异常组:ABI≤0.9[5]。
1.3 统计学方法
应用SPSS17.0统计分析软件。计量资料用均数±标准差±s)表示,均数比较采用独立样本t检验。计数资料构成比比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 病例组与正常对照组颈内动脉检查情况比较
病例组颈动脉斑块检出率显著高于对照组(P<0.01)。病例组中颈内动脉狭窄18例(双侧狭窄4例、单侧狭窄14例),占全部病例组的15.3%,显著高于对照组(5.1%),两组比较差异有统计学意义(P<0.05)。对照组中无颈内动脉闭塞,病例组中颈内动脉闭塞7例(双侧闭塞2例,单侧闭塞5例),两组比较差异有统计学意义(P<0.05),见表1。
2.2 病例组与正常对照组颈内动脉管腔内径、IMT、RI及PI比较
缺血性脑卒中患者与正常对照组比较颈内动脉管腔内径减小(P<0.01),RI增高(P<0.05),IMT增厚(P<0.01),PI增高(P<0.01)。缺血性脑卒中患者检出颈动脉粥样硬化85例,占72.0%,与正常对照组(21.8%)相比差异有统计学意义(P<0.01),见表2。
2.3 病例组低踝臂指数检出率
病例组ABI检出率与正常对照组相比差异有统计学意义(P<0.01),118例缺血性脑卒中患者低踝臂指数组IMT(1.19±0.35)与踝臂指数正常组IMT(0.98±0.36)相比较差异有统计学意义(P<0.05)。本组研究结果表明低踝臂指数的发生与IMT相关。颈动脉IMT常作为反映早期动脉粥样硬化的标志,因此,低踝臂指数可以提示颈动脉粥样硬化。
2.4 颈动脉彩色多普勒血流成像技术及踝臂指数检测颈内动脉粥样硬化结果比较
118例缺血性脑卒中患者中,应用彩色多普勒血流成像技术诊断颈内动脉粥样硬化率72.0%,低踝臂指数组66例,提示患者伴有动脉粥样硬化,颈动脉粥样硬化检测率为55.9%。两种检测方法比较差异有统计学意义(P<0.05),见表3。

表1 病例组与正常对照组颈内动脉检查情况比较 n(%)

表2 病例组与正常对照组管腔内径、IMT、RI、PI及ABI比较
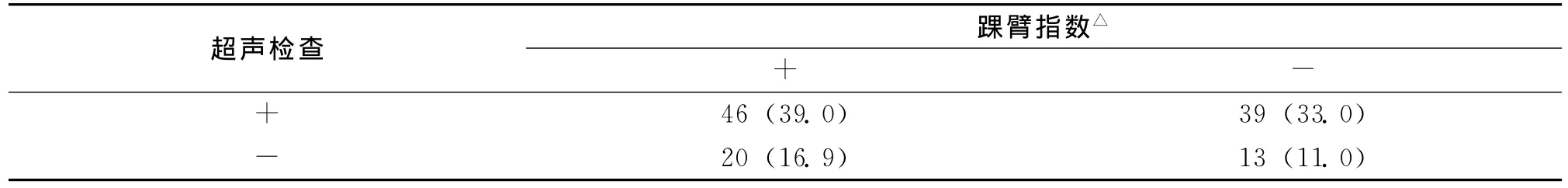
表3 超声检查及踝臂指数检测颈动脉粥样硬化结果比较 n(%)
3 讨 论
脑由两条颈内动脉和椎动脉供血,两条颈内动脉供血约占脑部总共血量的80%~90%[6],当其中一条动脉发生足以影响血流量的狭窄或闭塞时,便会引起该动脉供区的缺血缺氧,继而发生脑血管内膜损伤、脑组织坏死,即缺血性脑卒中。国内外大量研究表明,颈动脉粥样硬化是引起脑梗死的重要原因[7]。早期的颈动脉粥样硬化仅表现为颈动脉IMT厚度增加,其次是斑块的形成,管腔有效面积减少。本组研究显示,病例组颈动脉粥样硬化率及斑块检出率显著高于正常对照组(P<0.05),缺血性脑卒中患者颈内动脉IMT厚度及管腔内径与正常对照组相比差异有显著性意义(P<0.01)。分析其原因,缺血性脑卒中患者多伴有高血压史、糖尿病史或血脂紊乱史,上述因素加速了动脉粥样硬化的发生,高血压、糖尿病、高血脂作为缺血性脑卒中的危险因素[8-9]与动脉粥样硬化共同作用,增加了缺血性脑卒中的发病率。
阻力指数及搏动指数为评估动脉血流情况的参数,RI主要反映被测点远端的血管床阻力状况,PI是反映血管顺应性或弹性的指标,且可提示供血动脉病理生理特征。本组研究结果显示,缺血性脑卒中患者RI及PI显著高于正常对照组(P<0.05)。生理情况下,随着年龄增大,血管弹性逐渐下降,特别是阻力血管的弹性下降,导致血管阻力增大,阻力指数及搏动指数值增高。本组病例颈内动脉粥样硬化85例,占72.0%,颈内动脉颅外段粥样硬化导致了动脉弹性下降,RI及PI值增高。RI值升高,提示颈内动脉远端狭窄,血管灌注不足,低灌注可以导致微栓子形成,从而导致脑梗死的发生。研究表明PI与脑血管储备呈反比,而脑血管储备功能受损是脑梗死的独立危险因素[10-11],PI增高的患者,脑血管储备下降,脑血流灌注不足,当动脉血压出现较大波动时易引发缺血性脑卒中。
ABI是诊断外周动脉疾病的一种非侵入性方法,与外周动脉病、心血管疾病、脑血管疾病、慢性肾功能衰竭等多种疾病之间存在良好的相关性[12]。本组研究显示缺血性脑卒中患者低ABI发生率显著高于正常对照组(P<0.01)。缺血性脑卒中患者中低ABI组IMT较ABI正常组IMT明显增厚(P<0.05),因此,低ABI能提示颈动脉粥样硬化的发生。但是,与颈动脉彩色多普勒血流成像技术相比,ABI检测颈动脉粥样硬化的阳性率较低,两种检测方法相比差异有统计学意义(P<0.05)。分析原因,ABI通过检测下肢动脉粥样硬化,间接反映全身动脉情况,而颈动脉超声能更清晰的显示颈动脉斑块,准确测量颈动脉IMT厚度,及早反应颈动脉血流动力学的改变,比ABI测量能更直观地反应颈动脉粥样硬化。
颈动脉彩色多普勒血流成像技术及ABI作为一种无创检查手段,为诊断缺血性脑卒中提供重要指标,颈动脉彩色多普勒血流成像技术联合ABI测量可应用于缺血性脑卒中高危人群的常规筛选,及早发现脑梗塞危险因素。
[1]朱海兵,唐震宇,徐丽君.踝臂指数与缺血性脑血管病颅内动脉狭窄的关系 [J].实用临床医学,2008,9(6):48-50.
[2]谌瑾寰,冯国军,曾志良.彩色多普勒超声对缺血性脑梗死与颈动脉硬化的相关性研究 [J].中国超声诊断杂志,2006,7(4):241-243.
[3]医学会全国第四届脑血管病学术会议.脑血管疾病分类诊断要点 [J].中华神经科杂志,1996,29(6):376-379.
[4]Greenland P,Abrams J,Aurigemma GP,et al.Prevention conference V:beyond secondary prevention:identifying the high-risk patient for primary prevention:noninvasive tests of atherosclerotic burden:writing groupШ [J].Circulation,2000,101(1):16-22.
[5]Baumgartner I,Schainfeld R,Graziani L.Management of peripheral vascular disease[J].Annu Rev Med,2005,56:249-272.
[6]杨树源,只达石.神经外科学 [M].北京:人民卫生出版社,2008:1123-1128.
[7]Rozenfeld A,Ryglewicz D.Incidence of atherosclerotic lesions in internal carotid arteries and leg arteries of patients with ischemic stroke[J].Neurochir Pol,2000,34(5):843-851.
[8]潘恩春,顾东风.脑卒中的危险因素 [J].中国分子心脏病学杂志,2004,4(5):313-318.
[9]贺建华,吴兆苏,赵冬.脑卒中危险因素研究进展 [J].心肺血管病杂志,2002,21(1):59-61.
[10]Markus H,Cullinane M.Severely impaired cerebrovascular reactivity predicts stroke and TIA risk in patients with carotid artery stenosis and occlusion [J].Brain,2001,124(3):457-467.
[11]Ogasawara K,Ogawa A,Terasaki K.Use of cerebrovascular reactivity in patients with symptomatic major cerebral artery occlusion to predict 5-year outcome:comparison of xenon-133and iodine-123-IMP single-photon emission computed tomography [J].Cereb Blood Flow Metab,2002,22(9):1142-1148.
[12]阿布都热合曼·阿布都喀迪尔.踝臂指数的临床应用 [J].心血管病学进展,2009,30(2):276-280.

