MMP-9及PTEN在牙龈癌中的表达及意义
李敬东 梁锐英 徐艳丽 李金源
牙龈癌是常见的口腔恶性肿瘤之一,目前牙龈癌的治疗以手术切除为主,但常会造成患者颜面部的缺损和畸形[1]。本研究旨在检测基质金属蛋白酶(MMP)-9、第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)在牙龈癌中的表达情况,探讨其与牙龈癌临床病理分型间的关系,为牙龈癌的生物学治疗提供参考。
1 资料与方法
1.1 一般资料 选取2009年1月—2011年9月于本院就诊的牙龈癌患者33例,其中发生颈淋巴结转移9例,术后复发7例。依分化程度分为低分化组8例,男4例,女4例,年龄32~73岁,中位年龄为58岁;中分化组10例,男4例,女6例,年龄35~69岁,中位年龄55岁;高分化组15例,男7例,女8例,年龄21~77岁,中位年龄56岁。同期随机从癌旁的正常牙龈组织中抽取8例(癌旁组织组),男4例,女4例,年龄 37~69岁,中位年龄 52岁。各组性别(χ2=0.439)、年龄(Z=5.306)差异无统计学意义(P>0.05)。
1.2 主要试剂 pv6000两步法免疫组化试剂盒、DAB Kit显色试剂盒及Mouse anti-PTEN(ZM-0221,北京中杉金桥生物技术有限公司),Rabbit anti-MMP-9(Matrix Metalloproteinase 2,bs-0397R)(北京博奥森生物技术有限公司)。
1.3 方法 将手术所取标本先进行HE染色,确定所取标本的病理性质。免疫组织化学检测采用SP法染色。所有切片均由2位有经验的病理科医生进行双盲阅片,MMP-9以细胞胞浆内出现棕黄色颗粒为阳性表达,PTEN以细胞浆和 (或)细胞核内出现棕黄色颗粒为阳性表达。在Motic Med 6.0软件系统镜下采图,每张切片随机摄取10个视野,在光镜下放大400倍,分析其阳性细胞表达的积分光密度(IOD)值,光密度定标值为255。
1.4 统计学方法 采用SPSS 13.0统计软件进行处理。计量资料以±s表示,多组间比较用单因素方差分析,组间多重比较采用SNK-q法检验。计数资料用率(%)表示,组间比较行卡方检验及确切概率法,MMP-9及PTEN之间相关性及其与临床特征的关系采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 MMP-9和PTEN在各组中的病理表达 (1)MMP-9病理表达。癌旁组织组阳性表达者胞浆可见棕黄染色,为弱阳性表达、弥散分布,见图1。高分化组阳性表达者在胞浆中可见弥散分布的棕黄染色,为弱阳性表达,见图2。中分化组阳性表达者胞浆广泛出现较深的棕黄染色,见图3。低分化组胞浆中出现深棕黄染色,且细胞膜也出现明显黄染,为强阳性表达,见图4。(2)PTEN病理表达。癌旁组织组蛋白主要定位在细胞质和细胞核,呈棕黄色、弥散分布,表达强度较高,见图5。高分化组PTEN阳性表达者棕黄染色在细胞核和细胞质中弥散分布,染色较深,表达为强阳性,见图6。中分化组阳性表达者在细胞核和细胞质中棕黄染色散在分布,表达为弱阳性,见图7。低分化组在细胞核和细胞质中均未见棕黄染色,全部为阴性表达,见图8。
2.2 各组MMP-9和PTEN的阳性表达率及IOD值比较 (1)MMP-9表达情况。癌旁组织组表达比例低于中、低分化组,高分化组低于低分化组,差异有统计学意义(P<0.05),其余各组间比较差异均无统计学意义(P>0.05)。各组IOD值比较,除癌旁组织组和高分化组,高、中分化组间比较差异无统计学意义(P>0.05)外,其余各组间均有统计学意义(P<0.05),见表1。(2)PTEN表达情况。PTEN阳性率癌旁组织组高于中、低分化组,高分化组高于低分化组,差异有统计学意义(P<0.05)。各组间IOD值两两比较,除癌旁组织与高分化组间差异无统计学意义外,其余各组间差异均有统计学意义(P<0.05),见表1。
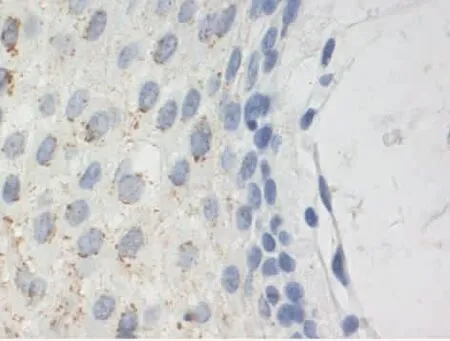
Figure 1 Expression of MMP-9 in gingival tissues adjacent to cancer(SP×400)图1 MMP-9在癌旁牙龈组织中的表达(SP×400)
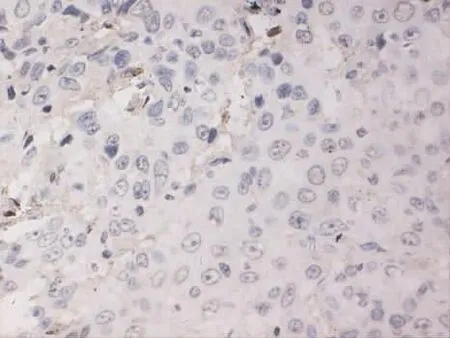
Figure 2 Expression of MMP-9 in well differentiated gingival cancer(SP×400)图2 MMP-9在高分化牙龈癌中的表达(SP×400)
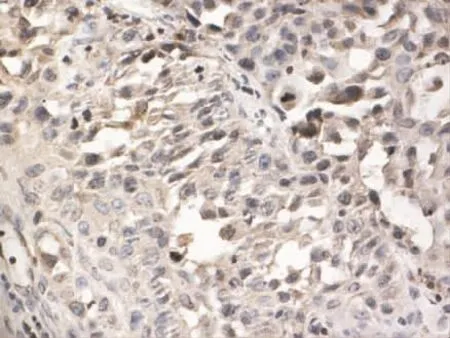
Figure 3 Expression of MMP-9 in moderately differentiated gingival cancer(SP×400)图3 MMP-9在中分化牙龈癌中的表达(SP×400)
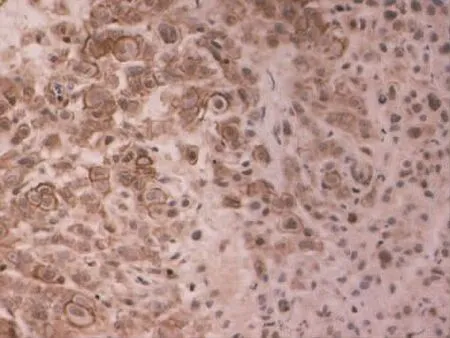
Figure 4 Expression of MMP-9 in poorly differentiated gingival cancer(SP×400)图4 MMP-9在低分化牙龈癌中的表达(SP×400)

Figure 5 Expression of PTEN in gingival tissues adjacent to cancer(SP×400)图5 PTEN在癌旁牙龈组织中的表达(SP×400)
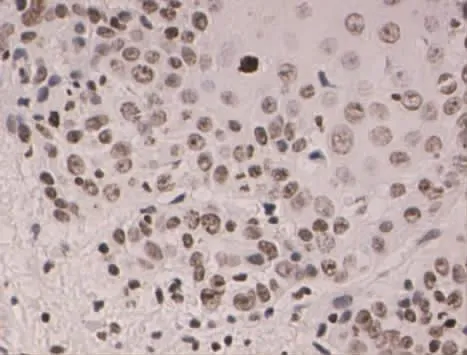
Figure 6 Expression of PTEN in well differentiated gingival cancer(SP×400)图6 PTEN在高分化牙龈癌中的表达(SP×400)
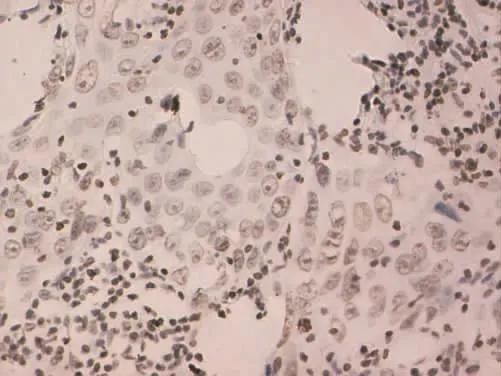
Figure 7 Expression of PTEN in moderately differentiated gingival cancer(SP×400)图7 PTEN在中分化牙龈癌中的表达(SP×400)
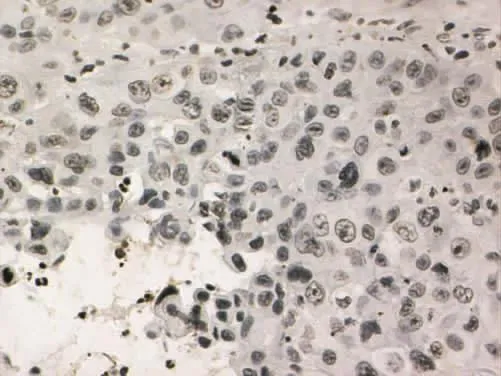
Figure 8 The negative expression of PTEN in poorly differentiated gingival cancer(SP×400)图8 PTEN在低分化牙龈癌中的阴性表达(SP×400)
2.3 相关性分析结果 MMP-9和PTEN在牙龈癌中的阳性表达呈负相关(rs=-0.949,P<0.05)。MMP-9及PTEN的表达率与性别、年龄均无相关性(P>0.05)。MMP-9表达与淋巴结转移及术后复发呈正相关,PTEN的表达与淋巴结转移和复发呈负相关(P<0.05),见表2。
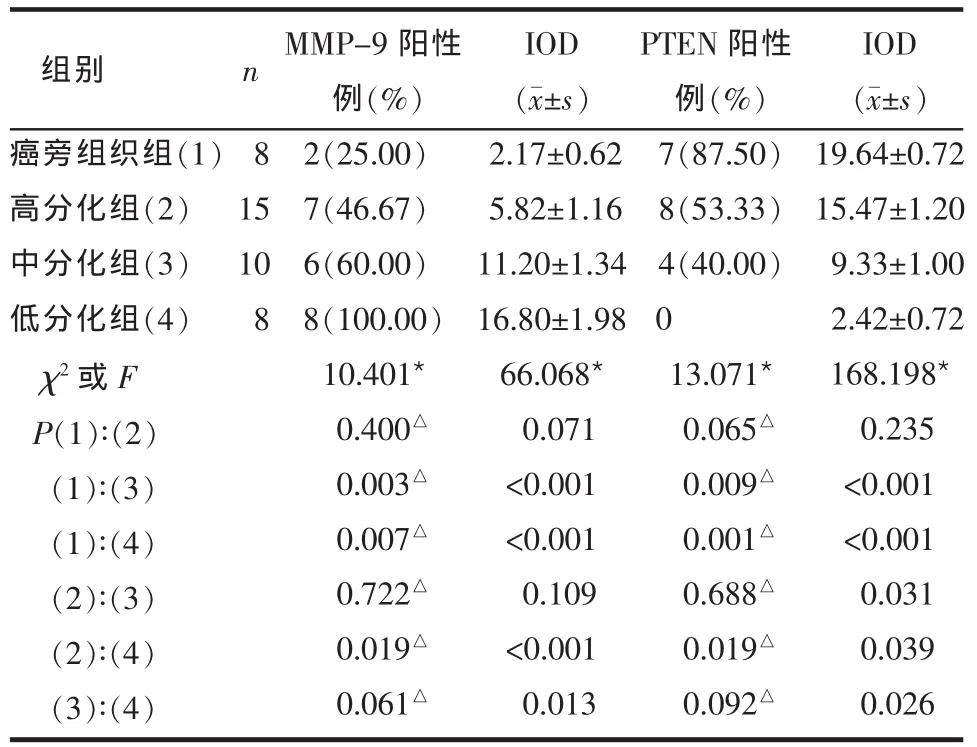
Table 1 Comparison of expressions of MMP-9 and PTEN between four groups表1 4组MMP-9和PTEN表达情况的比较
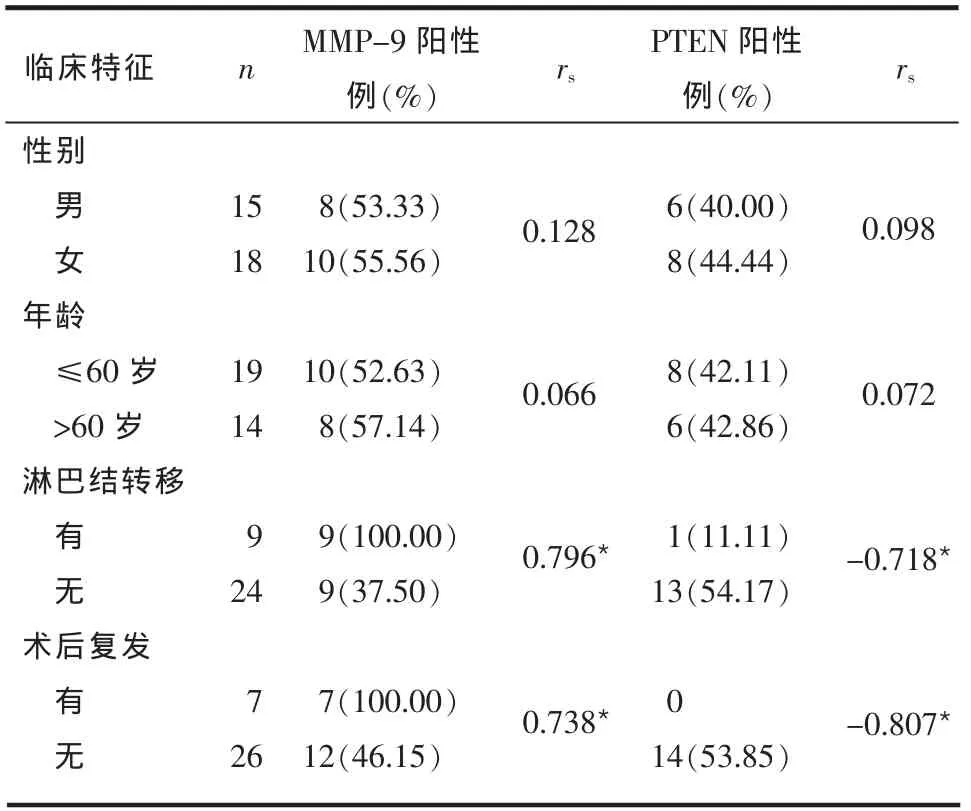
Table 2 Correlation between positive expressions of MMP-9 and PTEN and clinical features in patients with gingival cancer表2 牙龈癌患者MMP-9和PTEN表达与各临床参数之间的相关性
3 讨论
研究认为,细胞外基质(ECM)是肿瘤细胞侵袭和转移的必经通道,基质金属蛋白酶类(Matrixmetalloproteinases,MMPs)尤其是MMP-9与肿瘤的侵袭和转移关系最为密切[2-3]。PTEN基因是具有磷酸酶活性的一种重要的抑癌基因,对细胞周期调控起着重要的调节作用。已有研究表明,口腔鳞状细胞癌中PTEN基因常出现异常表达[4]。但具体关于PTEN在牙龈癌中的表达及其与其他因子之间的关系尚少见报道。本研究显示,MMP-9在癌旁组织组的表达率低于中、低分化组,且随着分化程度的降低,表达率呈增高趋势。雷志敏等[5]在研究MMP-2、MMP-9及肿瘤抑制基因脆性组氨酸三位体(FHIT)在口腔鳞癌组织中的表达发现MMP-9在正常口腔黏膜中的表达率为26.67%,随分化程度降低,2种蛋白的表达率随之增高,与本研究结果一致。免疫组化染色结果显示,低分化组在胞浆和包膜上均呈深棕染色,表明低分化组MMP-9强阳性表达,同时IOD值结果也近一步证实,分化程度越低,IOD值越大。Cupic′等[6]研究证实,MMP-9在肿瘤组织的表达高于良性肿瘤和正常组织。通常肿瘤坏死因子 (TNF)-α可诱导MMP-9合成增加。Hyc等[7]在研究大鼠膝关节细胞时发现,TNF-α作用于MMP-9基因促进其转录过程,从而引起MMP-9水平上调。但牙龈癌中造成MMP-9表达增加的具体机制仍有待于进一步研究。
本研究发现PTEN在癌旁组织中的表达率为100%,且随着分化程度降低,PTEN的表达率也随之降低,癌旁组织组和高分化组与中低分化类型牙龈癌比较差异有统计学意义,提示随着牙龈癌分化程度的降低,PTEN阳性表达率有下降的趋势。目前大多数观点认为,PTEN通过它的脂质磷酸酶的活性参与细胞凋亡过程,从而可抑制肿瘤的发生[8]。也有研究认为,PTEN基因可能发生突变,导致酶活性急剧下降,致肿瘤细胞恶性增殖能力增强[9]。本研究结果证实,PTEN的阳性表达率随分化程度降低而降低,表明其可能在牙龈癌的发生发展过程中起着关键作用,但PTEN在牙龈癌中如何发挥作用仍需进一步研究证实。
本研究结果显示,MMP-9的阳性表达与淋巴结转移和术后复发呈正相关,表明MMP-9的表达增高可能会促进牙龈癌的复发和转移。另外,PTEN的阳性表达与淋巴结转移和术后复发呈负相关,表明PTEN阳性表达时患者淋巴结发生转移和术后复发的概率较低,而阴性表达的患者,更易发生淋巴结转移,术后较易复发。MMP-9和PTEN呈负相关,提示MMP-9的高表达和PTEN的低表达在牙龈癌的复发和转移过程中共同发挥作用,但有关其具体作用机制尚有待进一步研究证实。
[1]郭朱明,王顺兰,张诠,等.116例牙龈癌的治疗与预后分析[J].癌症,2008,27(3):307-310.
[2]Liu Z,Li L,Yang Z,etal.Increased expression of MMP-9 is correlated with poor prognosis of nasopharyngeal carcinoma[J].BMC Cancer,2010,10(9):270.
[3]Yang S,Zhao Z,Wu R,etal.Expression and biological relationship of vascular endothelial growth factor-A and matrix metalloproteinase-9 in gastric carcinoma[J].J Int Med Res,2011,39(6):2076-2085.
[4]Gan YH,Zhang S.PTEN/AKT pathway involved in histone deacetylases inhibitor induced cell growth inhibition and apoptosis of oral squamous cell carcinoma cells[J].Oral Oncol,2009,45(10):150-154.
[5]雷志敏.MMP-2、MMP-9及肿瘤抑制基因FHIT在口腔鳞癌组织中的表达[J].武汉大学学报,2007,28(2):188-191.
[6]Cupic′DF,Tesar EC,Ilijas KM,etal.Expression of matrix metalloproteinase 9 in primary and recurrent breast carcinomas[J].Coll Antropol,2011,35(2):7-10.
[7]Hyc A,Osiecka-Iwan A,Niderla-Bielinska J,etal.Influence of LPS,TNF,TGF-β1 and IL-4 on the expression of MMPs,TIMPs and selected cytokines in rat synovial membranes incubated in vitro[J].Int JMol Med,2011,27(1):127-137.
[8]Ghosh D,Najwa AR,Khan MA,etal.IGF2,IGF binding protein 1,and matrix metalloproteinases 2 and 9 in implantation-stage endometrium following immunoneutralization of vascular endothelial growth factor in the rhesus monkey[J].Reproduction,2011,141(4):501-509.
[9]Ioannidis I,Dimo B,Karameris A,etal.Comparative study of the immunohistochemical expression of metalloproteinases 2,7and 9 between clearly invasive carcinomas and"in situ"trophoblast invasion[J].Neoplasma,2010,57(1):20-28.

