花生肽对衰老模型大鼠血清和心、脑组织抗氧化效果的影响
陈贵堂 赵立艳 李 博 杨志萍 綦国红 王岁楼
花生肽对衰老模型大鼠血清和心、脑组织抗氧化效果的影响
陈贵堂1赵立艳2李 博1杨志萍1綦国红1王岁楼1
(中国药科大学药学院食品质量与安全教研室1,南京 210009)
(南京农业大学食品科技学院2,南京 210095)
为研究花生肽的体内抗氧化效果,将50只SD大鼠随机分为5组(对照组、模型组、低中高剂量花生肽组),除对照组外,其余各组大鼠按其体重每天皮下注射D-半乳糖400 mg/kg建立衰老模型,同时3个花生肽组每天分别按200、500、800 mg/kg的剂量灌胃,持续50 d。检测大鼠血清和心、脑组织中丙二醛或脂褐质(LF)含量以及抗氧化酶活力。结果表明,花生肽能够有效抑制半乳糖致衰老大鼠体重的下降,减缓胸腺指数和脑指数的下降,提高大鼠血清、脑组织中SOD和GSH-Px活性,并能够降低大鼠血清MDA含量和脑中的LF含量,表明花生肽具有显著的抗氧化作用。
花生肽 D-半乳糖 大鼠 抗氧化
为了降低自由基的伤害,细胞内有很多抗氧化系统,包括酶类抗氧化剂和非酶类抗氧化剂,然而随着年龄增长、疲劳以及机体发生病变等状态下,该抗氧化系统的防御能力会随之降低,而导致体内氧化还原失衡。为了弥补体内抗氧化能力的损失,一方面可强化体内抗氧化系统,如提高SOD的活性或谷胱甘肽的含量等,另一方面则可补充体内的抗氧化物质,故营养学家一直希望找到具有抗氧化性的天然产物以期能用以维持体内氧化还原的平衡。
近十几年来,源于食物蛋白的抗氧化多肽研究日益增多,其抗氧化活性的评价方法也从体外试验向动物体内试验方向发展,因为它们真正的生物学效能只有通过人体试验或动物试验才能得以阐明。然而,若在人体上进行这一漫长衰老过程的研究及对生物抗氧化剂进行疗效观察是不易做到的。因此,人们根据衰老的机制建立了许多动物衰老模型。其中D-半乳糖所致的亚急性衰老模型,可引起心、肝、肾、脑等重要器官的代谢异常,类似人类自然衰老时的表现[1],所以在抗氧化物质的活性评价方面得到了广泛的应用[2-4]。
陈贵堂等[5-7]采用多种试验方法评价了 Alcalase酶解花生蛋白所得花生肽的生物活性,表明花生肽具有很强的抗氧化能力。为进一步研究花生肽在体内的生理活性,本试验采用D-半乳糖诱导的衰老大鼠模型,通过研究花生肽对衰老模型大鼠血清和心、脑组织抗氧化作用的影响,探讨花生肽在体内抗氧化活性的作用模式,为花生抗氧化肽乃至花生饼粕的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
SPF级雄性SD大鼠:中国药品生物制品检定所实验动物中心,许可证号SCXK11-00-0010;大鼠普通饲料:北京科澳协力饲料有限公司;D-半乳糖:分析纯,中国医药集团上海化学试剂公司;花生肽:自制[8];丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)以及考马斯亮蓝蛋白测定试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
全塑动物代谢笼:自制;101-3E电热鼓风干燥箱:上海实验仪器厂有限公司;Lambda 7紫外可见分光光度计、Ls-5荧光光度计:美国P.E公司;Sartorius电子天平:德国哥廷根赛多利斯股份有限公司;LDZ5-2自动平衡离心机:北京医用离心机厂。
1.3 方法
1.3.1 动物分组及处理
根据体重将大鼠随机分为5组,即对照组、D-半乳糖致衰老模型组,低、中、高剂量花生肽组。除对照组外,每天给各组大鼠皮下注射D-半乳糖400 mg/kg BW,给对照组大鼠皮下注射等量生理盐水,同时每天分别按200、500、800 mg/kg BW的剂量给低、中、高剂量花生肽组大鼠灌胃,对照组及模型组用等量蒸馏水灌胃,每天称重1次。于空调动物实验室内,在全塑代谢笼内单独饲养,采用对喂法,保证每只大鼠每天食物摄入量相等。
在第50天禁食12 h后,大鼠断头取血,3 000 r/min离心15 min分离出血清,用于SOD、GSH-Px、CAT活性及MDA含量的测定。解剖大鼠,迅速取出脑、心脏、脾脏及胸腺,剔除其表面的脂肪膜,用生理盐水冲洗干净,用滤纸将水分吸去,然后称重,置洁净塑料袋内密封,低温保存待测。
1.3.2 脏器指数计算
脏器指数(g/100 g)=脏器质量×100/大鼠体重
1.3.3 血清及心、脑组织中SOD活力测定
用黄嘌呤氧化酶法[8]测定。取血清30μL进行测定;心、脑组织用预冷的生理盐水制成10%匀浆,低温下3 000 r/min离心10 min,取上清液测定SOD活性。按试剂盒操作规程进行。以每毫升血清或每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。
1.3.4 血清及心、脑组织中GSH-Px活力测定
用DTNB显色法[9]测定。血清用生理盐水稀释5倍,取0.1 mL进行测定;心、脑组织用预冷的生理盐水制成 10%匀浆,低温下 3 000 r/min离心10 min,取上清液进行测定,按试剂盒操作规程进行。以每毫升血清或每毫克组织蛋白在37℃反应5 min,扣除非酶促反应作用,使反应体系中 GSH浓度降低1μmol/L为一个活力单位(U)。
1.3.5 血清及心、脑组织中CAT活力测定
用钼酸铵法[10]测定。取 0.1 mL 血清或 0.05 mL经生理盐水稀释的1%心、脑组织匀浆,按试剂盒操作程序加入试剂,测定其在405 nm处的吸光值,按公式计算CAT活力,以每毫升血清或每毫克组织蛋白每秒钟分解1μmoL的H2O2为一个活力单位(U)。
1.3.6 血清中MDA含量测定
用硫代巴比妥酸(TBA)比色法[11]。取血清0.2 mL,按试剂盒操作程序加入试剂,反应终体积为4.4 mL,反应管振荡混匀后在水浴中煮沸40 min,然后3 500 r/min离心10 min,取上清液在532 nm处测定其吸光值,根据公式计算MDA含量。
1.3.7 心、脑组织中脂褐质含量测定
参照卫生部《保健食品检验与评价技术规范》(2003)[12]规定方法略加修改进行测定。取组织200 mg,加入定量蒸馏水用匀浆器制成5%的组织匀浆,然后加入4.0 mL于50℃预热的2∶1氯仿/甲醇混合液,用旋涡振荡器充分混匀,3 000 r/min离心10 min后样品分为3层,上层为水相,中层为组织,下层为氯仿甲醇相。小心吸去水层,用带长麻醉针头的注射器沿管壁穿过中层,将下层氯仿甲醇提取液吸出。向提取液中加入甲醇0.2 mL,轻轻振荡混匀,置紫外灯下照射30 s,倒入石英杯中,以0.1μg/mL的硫酸奎宁为标准对照,氯仿甲醇混合液为空白对照,在狭缝 4.4,灵敏度 3.6,激发波长360 nm,发射波长450 nm下测定样品的荧光强度。
组织中脂褐质(Lipofuscin,LF)含量计算公式:
LF含量(μg/g组织)=(样品荧光强度-空白荧光强度/硫酸奎宁荧光强度)×硫酸奎宁浓度×(匀浆体积/样品质量)
1.3.8 心、脑组织中蛋白质含量测定
用福林-酚法[13]测定,以小牛血清白蛋白为标准物质。
1.3.9 统计分析
试验数据以(珋x±s)表示,用SPSS11.0软件包进行方差分析,组间两两比较采用LSD检验。
2 结果与分析
2.1 大鼠的生长状况
在整个饲养周期,包括致衰老模型组大鼠在内,所有大鼠食欲良好,体重均呈增长趋势,无感染、腹泻等异常症状,其体重变化如表1所示。各组大鼠初始平均体重基本相同,组间无显著差异(P>0.05),给予不同的处理后,各组大鼠生长速度各不相同,其中对照组体重增加最快,衰老模型组体重增加最慢,经给予花生肽后,大鼠的生长速度随着肽剂量的增加而增加。至饲养结束时,中、高剂量组大鼠体重及食物转化率与对照组无明显差异,而显著高于衰老模型组(P<0.05)。

表1 体重增加量及食物转化率

表2 花生肽对大鼠脏器重量及脏器指数的影响
2.2 花生肽对大鼠脏器重量及脏器指数的影响
由表2可见,大鼠心脏、脾脏质量及其脏器指数在各组之间均无统计学差异(P>0.05)。与对照组相比,衰老模型大鼠脑和胸腺质量以及脑指数和胸腺指数均显著降低(P<0.05),而与衰老模型组相比,高剂量花生肽组大鼠脑指数和胸腺指数均显著增高(P<0.05),而中、低剂量花生肽对大鼠脑指数和胸腺指数的增高作用不明显(P>0.05)。
2.3 花生肽对大鼠血清 SOD、GSH-Px、CAT活性和MDA含量的影响
如表3所示,衰老模型组大鼠血清MDA含量极显著高于对照组(P<0.01),SOD活性和GSH-Px活性显著低于对照组(P<0.05),CAT活性虽低于对照组,但没有统计学差异(P>0.05)。中、高剂量组花生肽组血清SOD活性和GSH-Px活性显著高于衰老模型组,其GSH-Px活性甚至显著高于对照组,MDA含量显著低于衰老模型组(P<0.05)。低剂量花生肽组血清SOD活性、CAT活性以及MDA含量与衰老模型组无显著差异(P>0.05),但其GSH-Px活性却远远低于其他4组(P<0.01)。
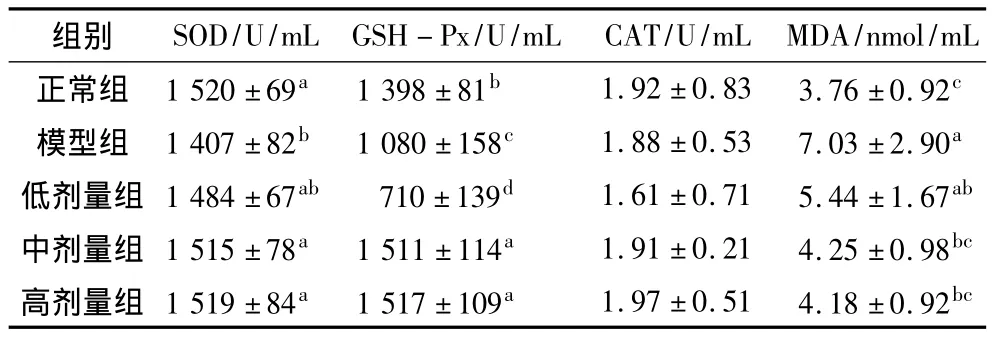
表3 大鼠血清SOD、GSH-Px、CAT活性和MDA含量
2.4 花生肽对大鼠心脏 SOD、GSH-Px、CAT活性和脂褐质含量的影响
如表4所示,各组大鼠心脏SOD、CAT活性以及脂褐质含量之间均无明显差异(P>0.05),衰老模型组和低剂量花生肽组大鼠GSH-Px活性显著低于对照组(P<0.05),中、高剂量花生肽组GSH-Px活性低于对照组,而高于衰老模型组和低剂量组,但与它们之间均无显著差异(P>0.05)。
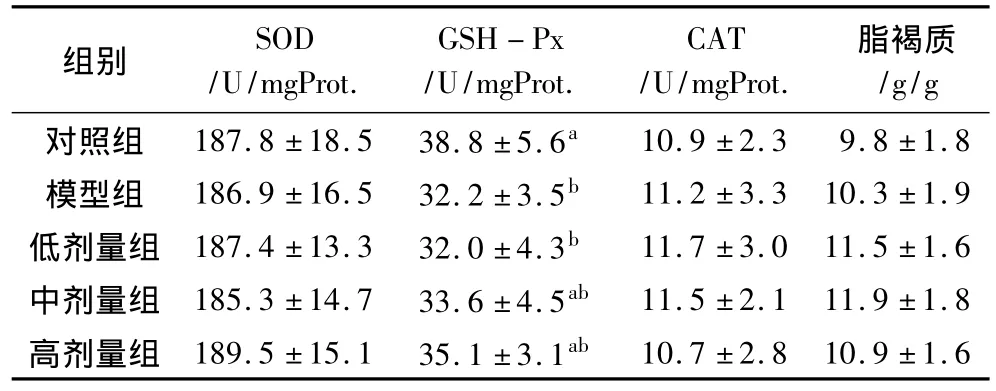
表4 大鼠心脏SOD、GSH-Px、CAT活性和脂褐质含量
2.5 花生肽对大鼠脑 SOD、GSH-Px、CAT活性和脂褐质含量的影响
如表5所示,衰老模型组大鼠脑脂褐质含量极显著高于对照组(P<0.01),SOD活性和GSH-Px活性显著低于对照组(P<0.05)。中、高剂量花生肽组脑SOD活性略低于对照组,但显著高于衰老模型组(P<0.05);高剂量花生肽组脑GSH-Px活性略低于对照组,但显著高于衰老模型组(P<0.05);中、低剂量花生肽组GSH-Px活性略高于衰老模型组,但低于对照组和高剂量花生肽组,其差异均不显著(P>0.05)。各组大鼠脑CAT活性虽然差别很大,但因为个体差异较大而无统计学意义。中、高剂量组大鼠脑LF含量显著低于衰老模型组(P<0.05),而与对照组无显著差异(P>0.05)。
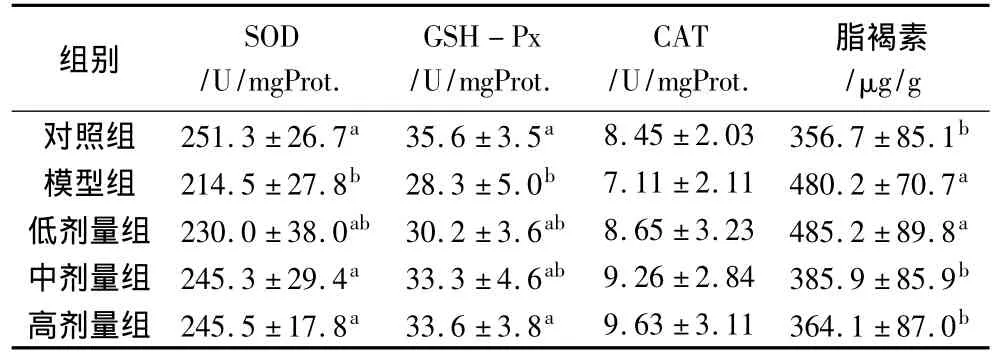
表5 大鼠脑SOD、GSH-Px、CAT活性和脂褐质含量
3 讨论与结论
3.1 D-半乳糖致衰老动物模型的建立
目前D-半乳糖诱导的动物模型已成为抗氧化、延缓衰老药物及保健食品筛选工作中经常选用的试验动物模型,动物试验必测指标为动物体重、过氧化脂质含量(MDA或LF)以及抗氧化酶活性(SOD和GSH-Px),如果过氧化脂质含量升高和任一抗氧化酶活性降低,即可判定该受试样品抗氧化功能动物试验结果阳性[13]。本研究中给成年SD雄性大鼠连续颈背部皮下注射D-半乳糖7周后,衰老模型组大鼠的血清MDA及脑LF含量明显高于对照组,同时血清SOD、GSH-Px活性及脑SOD、GSH-Px的活性显著降低,说明本试验动物模型建造成功。
3.2 花生肽对大鼠体重和脏器指数的影响
研究表明,试验动物给予过量半乳糖后,生长迟缓,体重减轻[14-15],本研究也得到了同样的结果,但花生肽的补充可有效抵抗大鼠体重的下降。许多学者认为免疫系统功能下降是衰老的主要原因和标志。陈海英等[16]在研究健康大鼠衰老指标的增龄变化及形态学基础的相关性研究中观察到老年大鼠胸腺的重量和胸腺指数明显低于青年大鼠和幼年大鼠;葛斌等[17]和陈贵堂等[6]前期的研究也发现,连续颈背部皮下注射D-半乳糖4~7周后,小鼠的胸腺和脾脏发生萎缩,重量明显减轻,表明半乳糖能致动物免疫器官老化及其功能下降,这可能是引起动物早衰的原因之一。本研究结果显示,D-半乳糖诱发的衰老模型大鼠脾脏重量和脾脏指数无明显差异,但胸腺重量和胸腺指数均显著降低,这说明胸腺对半乳糖的反应可能比脾脏更明显,或者大鼠对半乳糖的耐受能力比小鼠强。另外,D-半乳糖诱发的衰老模型大鼠脑重量和脑指数显著低于正常组,说明D-半乳糖能够致使大鼠脑萎缩和重量减轻。补充高剂量花生肽(800 mg/kg BW)的大鼠,其胸腺指数和脑指数与对照组相差无几,并且显著高于衰老模型组,表明一定剂量的花生肽能明显对抗胸腺和脑的退化,提高免疫功能,抑制大鼠早衰。
3.3 花生肽对血清MDA及心、脑LF的影响
LF沉积是机体衰老的重要特征之一,而MDA是LF形成过程的中间产物,它能间接反映机体内的脂质过氧化水平。大量试验证实,衰老时MDA水平或LF含量显著升高。本研究发现D-半乳糖可以诱发模型动物血清的MDA含量显著升高,脑组织LF沉积明显增加。而补充高剂量花生肽(800 mg/kg BW)后,可显著降低血清MDA和脑LF含量,提示花生肽可作为外源性的抗氧化物质,能够促进机体产生内源性抗氧化物质,抑制脂质过氧化损伤,起到延缓衰老的作用。
3.4 大鼠血清和心、脑组织中抗氧化酶活性的变化
SOD、GSH-Px和CAT是体内重要的三大酶类抗氧化剂,SOD能使超氧自由基歧化为过氧化氢和氧,CAT可使过氧化氢分解成为水和氧,GSH-Px可催化还原型的谷胱甘肽转变为氧化型的谷胱甘肽,从而消除细胞中的有机或无机的过氧化物。本试验结果表明,D-半乳糖致衰老模型大鼠血清、脑组织中SOD和GSH-Px活性显著降低。3个剂量花生肽组能不同程度抑制血清和脑组织中SOD和GSH-Px活力下降,其量效关系均呈正相关,提示花生肽可通过增强体内抗氧化系统发挥抗氧化作用。
综上所述,花生肽能够有效抑制半乳糖致衰老大鼠体重的下降,减缓胸腺指数和脑指数的下降;能够提高D-半乳糖致衰老大鼠血清、脑组织中SOD和GSH-Px活性,并能够降低大鼠血清MDA含量和脑中的LF含量,表明花生肽具有显著的抗氧化作用,但其作用大小与其剂量有直接关系。
[1]李文彬,韦丰,范明,等.D-半乳糖在小鼠上诱导的拟老化效应[J].中国药理学与毒理学杂志,1995(9):93-95
[2]黄晓.小柴胡汤对D-半乳糖致亚急性衰老模型大鼠血清和海马组织中SOD活性MDA及心肌LPF含量影响的实验研究[J].中华中医药学刊,2007,25(3):542-543
[3]康桦,匡荣,姚治,等.麦芪口服液对D-半乳糖所致衰老模型大鼠的抗氧化作用[J].中国现代应用药学,2010,27(3):190-192
[4]樊金娟,付岩松,宗立立,等.米糠肽对D-半乳糖致衰小鼠线粒体损伤的影响[J].中国粮油学报,2011,26(1):29-33
[5]Chen G T,Zhao L,Zhao L Y,et al.In Vitro Study on Antioxidant Activities of Peanut Protein Hydrolysate[J].Journal of the Science of Food and Agriculture,2007,87(2):357-362
[6]陈贵堂,赵立艳,丛涛,等.花生多肽的制备及其对氧化损伤模型小鼠抗氧化作用的研究[J].食品科学,2007,28(3):324-327
[7]陈贵堂,赵立艳,丛涛,等.Alcalase蛋白酶水解花生蛋白制备抗氧化肽的研究[J].食品工业科技,2008,29(3):119-121,124
[8]Mizuno Y.Changes in superoxide dismutase,catalase,glutathione peroxidase and glutathione reductase activities and thiobarbituric acid reactive product levels in early stages of development in dystrophic chickens[J].Experimental Neurology,1984,84(1):58
[9]徐叔云,卞如濂,陈修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:529-531,549-554
[10]朱广廉,钟海文,张爱琴.植物生理学实验[M].北京:北京大学出版社,1990:37-40
[11]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:937-943
[12]卫生部.保健食品检验与评价技术规范[S].2003:49-50
[13]Lowry O H,Rosenbrough N.J,Farr A L,et al.Protein measurement with the Folin reagent[J].Journal of Biological Chemistry,1951,193:265-275
[14]王忠,谷顺才,韩艳丽,等.芦荟及其复方制剂对衰老小鼠脂质过氧化及白介素水平的影响[J].解放军药学学报,2004,20(1):8-10
[15]杨清,冯芬,易无庸.保肾汤抗大鼠D-半乳糖致衰老作用的实验研究[J].中国中医药科技,2004,11(3):164-165
[16]陈海英,孔月红,蔡兆明.健康大鼠衰老指标的增龄变化及形态学基础的相关性研究[J].山西医科大学学报,2005,36(5):537-539
[17]许爱霞,王彩琴,杨社华,等.何首乌多糖和枸杞多糖的协同抗衰老作用机制的实验研究[J].兰州大学学报:医学版,2005,31(2):13-16.
Antioxidative Effect of Peanut Polypeptide in Serum,Heart and Brain of D-galactose-induced Aging Rats
Chen Guitang1Zhao Liyan2Li Bo1Yang Zhiping1Qi Guohong1Wang Suilou1
(College of Pharmacy,China Pharmaceutical University1,Nanjing 210009)
(College of Food Science and Tech-nology,Nanjing Agricultural University2,Nanjing 210095)
To research the antioxidantive effects of peanut polypeptides(PP),fifty SD rats were randomly divided into five groups,namely control,model and three PP- treated groups.Except the control group,all other groups were subcutaneously injected with D -Gal solution(40 mg/mL,0.1 mL/10g mb)daily for successive 50 days.On the same time,rats in the PP treatment groups were orally given PP in the dosage of 200 mg/kg mb,500 mg/kg mb and 800 mg/kg mb,respectively.Then the MDA or lipofuscin(LF)contents,superoxide dismutase(SOD),glutathione peroxidase(GSH-Px)and catalase(CAT)activities in serum,heart and brain were analyzed respectively.The results showed that D-Gal-induced aging rats model was successfully established.PPsignificantly increased the thymus index and brain index,the levels of SOD,GSH-Px in serum and brain,and obviously decreased the MDA content in serum and LF content in brain in a dosedependent manner.It indicated PPhad an excellent antioxidative action in aging rats induced by D- Gal.
peanut polypeptide,D- galactose,rat,antioxidative effect
TQ936.16
A
1003-0174(2012)01-0043-05
2011-04-07
陈贵堂,男,1977年出生,副教授,博士,食品化学与营养学
赵立艳,女,1977年出生,副教授,食品营养

