棉叶中棉酚的快速提取与测定方法研究
景伟文,遆晓南,陈燕勤,张坤驰,刘 喜
新疆农业大学化学工程学院化学生物学研究室,乌鲁木齐830052
棉叶中棉酚的快速提取与测定方法研究
景伟文,遆晓南*,陈燕勤,张坤驰,刘 喜
新疆农业大学化学工程学院化学生物学研究室,乌鲁木齐830052
棉酚(G)及其相关物甲氧基半棉酚(DHG)、半棉酚酮(HGQ)、半棉酚(HG)、杀实夜蛾素(H1-4)等是棉花中重要的抗虫性萜烯类次生物质。利用高效液相色谱法(HPLC)对棉酚及其相关物进行了分离,测定了棉叶中的棉酚含量,讨论了不同的提取方法和测定条件对结果的影响,给出了一套简便、快速的分析测试方法,同时与紫外-可见分光光度法(苯胺法)的结果进行了对比,认为对于棉花的抗虫性的研究来说,HPLC是比较适宜的方法。
棉酚;HPLC;苯胺比色法
萜烯类物质是棉叶中最重要的抗虫性次生物质之一,这些物质包括棉酚(G)及其相关物甲氧基半棉酚(DHG)、半棉酚酮(HGQ)、半棉酚(HG)、杀实夜蛾素(H1-4)等[1]。研究表明,棉叶色素腺体内的棉酚等次生物质对棉花害虫如棉铃虫的生长发育具有明显的抑制作用,当棉酚含量达到一定值时,虫体内的解毒活力就会受到抑制,昆虫幼虫的正常生长受到影响最终导致幼虫死亡[2-5]。因此,为了解棉花品种的抗虫性,探明萜烯类物质在棉株体内的含量分布情况,尤其是在棉叶中积累的时间变化特性,必须建立一种有效的分析测试方法。
关于棉酚测定的方法很多,最为常用的是紫外-可见分光光度法和色谱法[6-9]。目前文献中介绍的液相色谱分析方法,有的如国标法,适合于植物油或以棉籽饼为原料的食品中游离棉酚的测定[10,11];有的如张永军等将植物样品加提取液振荡2小时后离心,减压浓缩氮气吹干定容过滤后进行测定,方法可以对多组分同时定量但样品的处理稍嫌繁琐费时[12]。本文着重对棉叶样品的提取进行了讨论,筛选出一种便捷、易行的前处理方法,同时利用HPLC法对棉叶中各种萜烯类物质进行分离,测定了棉酚物质的含量,并将其结果与紫外-可见分光光度法(苯胺法)比较,为分析方法的选择提供参考。
1 材料与方法
1.1 供试材料
供试棉花为盆栽棉花(新陆早17),常规管理,生长期不使用任何农药。
棉叶样品采集后去除水分,磨碎过筛(40目)备用。
1.2 仪器与试剂
岛津LC-20AB型高效液相色谱仪,SPD-M20A检测器,色谱柱:C18柱(5 μm,4.6×150 mm),普析通用TU-1810型紫外可见分光光度计,超声清洗器,振荡器,离心机,粉碎机。

图1 棉株中的萜烯类物质[1]Fig.1 Terpenoids in cotton[1]
棉酚标准样品:购自 Sigma公司(批号106K4013,95%以上)。称取纯棉酚0.0117 g,以提取溶剂溶解、定容至100 mL容量瓶中,得到浓度为117.0 mg/L的储备液。再以提取溶剂将储备液稀释成浓度为35.1 mg/L的标准工作液。分别取此工作液2、4、6、8、10 mL稀释至25 mL容量瓶中,得到浓度分别为2.8、5.6、8.4、11.2、14.0 mg/L的标准溶液。其余所用甲醇、乙醇、异丙醇、乙腈、乙酸、NN二甲基甲替酰胺、磷酸、正己烷、丙酮、四氢呋喃等均为色谱纯试剂(上海星可生化有限公司)。
1.3 样品的处理
1.3.1 HPLC法
称取粉碎样品0.1 g左右(精确至0.0001 g)于具塞离心管中,加入提取溶剂超声-振荡提取后离心,取上清液过滤后进行测定。

表1 样品不同除水处理方式的影响Table 1 The result of different dehydrated cotton samples
1.3.1.1 样品不同除水处理方式的影响
分别采用以下几种方式对样品进行除水处理,所测结果如表1。
测定结果表明,真空冷冻干燥处理的样品测定所得色谱峰面积最大。真空冷冻干燥法水分去除彻底,且低温不破坏组分,所测结果应该最为可靠,但是仪器设备投资比较大。低温烘干法的结果与真空干燥法相近,且简单易行,故应用广泛。
1.3.1.2 提取过程的影响
1.3.1.2.1 提取溶剂的确定
常温下,纯棉酚呈黄色晶体,易溶于乙醇、乙醚、丙酮和三氯甲烷等有机溶剂,不溶于水、己烷及低沸点的石油醚。故此,在分析检测棉酚的过程中,常用这些有机溶剂来提取或分离棉酚。不同的提取溶剂由于极性的不同导致提取结果的不同。分别以乙腈+水+磷酸、无水乙醇、乙酸乙酯∶正己烷(1∶3)、70%丙酮、四氢呋喃为提取溶剂进行提取后进行测定,所得试验数据表明,以乙腈+水+磷酸为提取剂时所得色谱峰峰形最佳,面积最大。另外,棉酚在乙腈中的稳定性也比较好,且该提取溶剂与流动相互溶性好,最终确定为合适的提取液。
1.3.1.2.2 提取方式的选择
比较了常用的冷浸过夜、振荡和超声等提取方式的异同,结果显示,以振荡15 min+超声15 min的提取方式效果较好。
1.3.1.2.3 提取液的处理
采用两种方式对提取液进行处理:a.提取液离心分离出上清液,氮气吹干,用5 mL提取溶剂冲洗定容后测定;b.提取液离心分离后直接进行测定。试验结果表明,b的结果高于a。前处理的步骤,如样品转移、冲洗等会导致样品当中棉酚含量的损失,因此采取提取后直接测定的方法比较简便、适宜。
1.3.2 紫外可见分光光度计法(Smith-苯胺法)
称取粉碎样品0.1 g左右(精确至0.0001 g)置于250 mL带塞三角瓶中,加20 mL玻璃珠(6 mm),再加3 mL抗坏血酸溶液(3 g抗坏血酸溶于45 mL溶液A及0.5 mL浓盐酸,混匀;溶液A:715 mL乙醇用水稀释至1000 mL,加冰醋酸0.2 mL及200 mL乙醚)振摇,3 min后叶绿素褪色,加提取溶剂超声-振荡提取,减压抽滤,漏斗及滤纸用少量的溶剂冲洗。滤液置于50 mL容量瓶中,用提取溶剂稀释至刻度,取此液5 mL(双份,分别记为a、b),置于25 mL容量瓶中,同时取提取溶剂5mL(双份,分别记为a0、b0)置于25 mL容量瓶中,向b、b0中加入0.5 mL新蒸苯胺,置于75℃水浴加热40 min,冷却后与a、b一起以提取溶剂稀释至刻度,测定吸光度[13]。
1.4 测定条件
1.4.1 HPLC法
流动相:乙醇/甲醇/异丙醇/乙腈/水/乙酸乙酯/N,N-二甲基甲替酰胺/磷酸(V/V=16.7/4.6/ 12.1/20.2/37.4/3.8/5.1/0.1),等度洗脱;流速:1.0 mL·min-1;检测波长:272 nm;柱温:55℃;进样量20 μL。
1.4.2 紫外可见分光光度计法(Smith-苯胺法)
以a0为参比测定空白测定液b0的吸光度A0,以a为参比测定试样测定液b的吸光度A,A-A0为校正的试样溶液吸光度值。测定波长445 nm。
2 结果与分析
2.1 HPLC法
2.1.1 流动相的选择
对于棉酚的分析测定,文献上多采用甲醇-水或四氢呋喃+水作为流动相,但是棉酚在四氢呋喃或甲醇组成的溶剂中并不稳定,随放置时间的延长,杂质峰逐次增大,主峰逐次减小。同时,这些简单的流动相只能分离出棉酚组分,不能同时分离出HG、HGQ和H1-4这些结构上与棉酚非常相近的萜烯类次生物质,因而难以同时对这些物质进行测定。经尝试,采用甲醇/乙醇/异丙醇/乙腈/水/乙酸/N-N二甲基甲替酰胺/磷酸(16.7/4.6/12.1/20.2/37.4/ 3.8/5.1/0.1)作为复合流动相,可以对棉花中的多种萜烯类化合物进行高效分离,达到测定目的。棉酚的紫外吸收峰有多个,包括254 nm、272 nm等,其中在272 nm处的吸收峰干扰少,灵敏度高,故选择272 nm处为测定波长。
在以上确定的提取与测定条件下,所得谱图(见图 2)与文献中的谱图相比,确定组分峰名[1,12,14]。
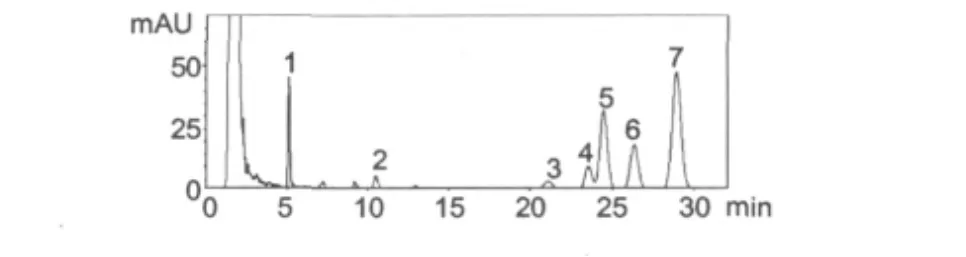
图2 样品的HPLC色谱图Fig.2 The HPLC chromatograph of terpenoids in cotton samples
2.1.2 样品预处理
提取溶剂的选择要保证既能得到较高的提取率,同时又要考虑到样品中基体物质的干扰。另外,进行HPLC测定时还需考虑要与流动相相容。综合以上因素,选择乙腈+水+磷酸为提取剂。由于棉酚为一多羟基酚化合物,遇光、热易氧化变质,故多采用冷浸或超声提取的方式,否则会造成棉酚的损失。相比于冷浸法,超声提取由于其固有的空化作用,效率较高。结合常温振荡方式机械破坏植物细胞结构,有助于提取充分。棉酚结构式中含有醛基和羟基,化学性质很活泼,极易被氧化而变质,因此提取时间不宜过长。由于超声提取效率较高,亦可相应缩短提取时间。
2.1.3 标准曲线和灵敏度
利用外标法定量。将配制好的棉酚标准溶液(2.8、5.6、8.4、11.2、14.0 mg/L)进行测定,以棉酚标准品质量浓度x(mg/L)为横坐标,峰面积y为纵坐标,绘制标准曲线,得回归方程为y=50835x-16681,R2=0.9999,由此表明棉酚在上述质量浓度范围内线性良好。棉酚的最低检出限为8.5 ng(按20 μL计)。
2.1.4 平行性与重复性测定
称取六份样品各0.1 g左右,低温烘干后过40目筛,以乙腈+水+磷酸为提取剂,振荡15 min+超声15 min提取,离心分离后测定棉酚的含量,所得数据如表2。

表2 棉酚HPLC法平行性的测定Table 2 The reproducibility of gossypol in samples for HPLC
2.1.5 加标回收率测定
称取样品按上述确定的条件(2.1.4)进行提取和测定,在标准曲线上查出样液中棉酚的浓度;再次在提取液中分别加入棉酚标液(2.8 mg/L、8.4 mg/ L、14.0 mg/L)各1.0 mL进行测定,从标准曲线上查得加标后浓度,按下式计算回收率[15],所得回收率为86.4%~93.4%(见表3)。
加标回收率(%)=(样液加标后物质的量-样液中物质的量)/标液中物质的量×100%

表3 棉酚回收率的测定(HPLC)Table 3 Recovery determination for gossypol(HPLC)
2.2 紫外-可见分光光度法
选择不同的提取溶剂(70%丙酮、无水乙醇、乙醚、溶剂A)按照上述方法(1.3及1.4)进行提取和测定。结果表明,以溶剂A作提取剂时所得吸光度值为最大。因此,以溶剂A作提取剂,振荡15 min +超声15 min提取后测定样品中棉酚的含量,所得结果见表4。
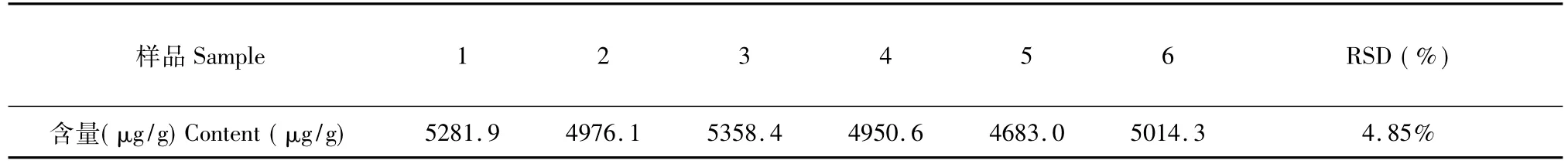
表4 紫外-可见分光光度法平行性的测定Table 4 The reproducibility of samples for UV spectrum
3 样品的测定
采用上述HPLC法对一定生长时期的棉花叶片样品中的棉酚含量进行了测定,所得结果如图3。结果显示,在棉花生长过程中,棉酚含量表现出一定程度的起伏,表明在棉株不同的发育时期棉叶内次生物质棉酚的含量有所不同。
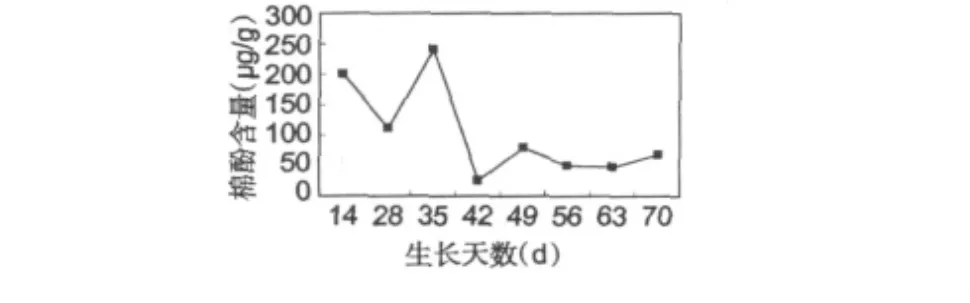
图3 棉叶中棉酚的动态变化Fig.3 The dynamic variations of gossypol in cotton leaves
4 讨论
目前,分光光度法在国内外应用较普遍。Smith-苯胺法利用棉酚中含有的芳香醛结构与苯胺反应形成黄色物质进行比色测定,棉株中所有的含芳香醛基的物质均可与苯胺发生此反应,因此测得的实际是样品提取液中萜烯类物质的总和,还包括棉酚的磷脂衍生物和亲水棉酚衍生物等在一定波长下吸光度的总和,对棉酚不具有专一性,因此使得结果偏高。经F统计检验,HPLC法所测结果与Smith-苯胺法比色法所得结果存在显著性差异。HPLC法是将棉酚与其他物质分离后进行测定的,因此,对于寄主植物的抗性研究来说,HPLC法应该是比较可靠的方法。当然,提取溶剂的不同对结果亦会产生一定的影响。
长期以来,对棉叶中萜烯类物质的测定工作主要集中在对棉酚的测定上。事实上,棉酚并不是棉叶中唯一的萜烯类次生物质。因此,仅对棉酚含量进行测定对于抗虫性的研究来说是远远不够的。本文对以往测定棉酚的方法进行了改进,建立的前处理及HPLC法简便、快捷而准确。同时,该方法能够对棉叶中各个萜烯类次生物质进行分离,在此基础上,才能实现对各个萜烯类物质的含量测定。这对于进一步弄清萜烯类物质与棉花抗虫性之间的关系,以便达到更好地抗性调节的目的是非常有益的工作,亦是作者今后努力的方向。
1 Stipanovic RD,Altman DW,Begin DL,et al.Terpenoid Aldehydes in upland cottons:analysis by aniline and HPLC methods.J Agric Food Chem,1988,36:509-515.
2 Wang CZ(王琛柱).Effects of gossypol and tannic acid on the growth and digestion physiology of cotton bollworm larvae.Acta Phytophyl Sin(植物保护学报),1997,24:10-18.
3 Fei Y(费跃),Guo CZ(郭长佐),Huang ZY(黄志勇),et al.Effects of gossypol on the growth of cotton bollworm.China Cotton(中国棉花),1997,24(4):21.
4 Hedin PA,Parrott WL,Jenkins JN.Relationships of glands,cotton square terpenoid aldehydes and other allelochemicals to larval growth of Heliothis virescens(Lepidoptera:Noctuidae).J Econ Entomol,1992,85:359-364.
5 Ti XN,Zhang KC.Advances in research of induced resistance to insects in cotton.Front Biol China,2009,3:1673-3622.
6 Huang TB(黄天宝),Wang LR(王立人),Liu GL(刘桂兰),et al.Determination of residual gossypol in cotton seed cake by reversed-phase HPLC.Chin J Anal Chem(分析化学),1989,1:1025-1027.
7 Lu DQ(卢定强),Duan L(段柳),Wu YS(吴雅霜),et al.RP-HPLC determination of gossypol acetate.Chin J Pharm Anal(药物分析杂志),2008,28:1562-1564.
8 Ao WP(敖维平),Qu MY(曲明悦).Election appropriate conditions of rapid measurement for free gossypol.J Anim Sci Vet Med(畜牧兽医杂志),2007,6(26):23-25.
9 Wen H(文虹).Determination of the content of free gossypol by reversed-phase HPLC.Jiangxi Feed(江西饲料),1999,6:21-22.
10 GB/T 17334—1998(国标法),Determination of free gossypol in foodstuff(食品中游离棉酚的测定).
11 GB/T 5009.148—2003(国标法),Determination of free gossypol in phytogenic foodstuff(植物性食品中游离棉酚的测定).
12 Zhang YJ(张永军),Wang WG(王武刚),Guo YY(郭予元).Analysis of terpenoids and their spatio-temporal expression of content in Bt transgenic cotton by HPLC method.Chin J Appl Environ Biol(应用与环境生物学报),2001,7:37-40.
13 GB/T 5009.37—2003(国标法),Method for analysis of hygienic standard of edible oils(食用植物油卫生标准的分析方法).
14 Altman DW,Stipanovic RD,Benedict JH.Terpenoid aldehydes in upland cottons.П.Genotypes-environment interactions.Crop Sci,1989,29:1451-1456.
15 Wu SH(吴树宏),Zhou CH(周春华).Discussion on calculation of recovery.GANSU Environ Study Monit(甘肃环境研究与监测),2000,13:179-180.
Quick Extraction and Analysis of Gossypol in Cotton Leaves
JING Wei-wen,TI Xiao-nan*,CHEN Yan-qin,ZHANG Kun-chi,LIU Xi
The Laboratory of Chemical Biology,Department of Chemical Engineering,Xinjiang Agricultural University,Urumqi 830052,China
The terpenoids in cotton contain a unique group of secondary metabolites,which include desoxyhemigossypol (DHG),hemigossypolone(HGQ),hemigossypol(HG),gossypol(G),and heliocides H1,H2,H3and H4(H1-4).These compounds have been shown to be important in protecting the plant from cotton insects.An HPLC method has been utilized for separating individual terpenoid and quantitating gossypol in cotton leaves.Some influencing factors,such as extracting and pre-treating process,were discussed and a set of simple,rapid method was developed.At the same time,the result of the UV-visible spectrophotometry(aniline method)was described and compared.The results showed that HPLC analysis was more reasonable for the insect-resistance investigation in cotton.
gossypol;aniline method;HPLC
1001-6880(2012)04-0498-05
2010-09-07 接受日期:2011-03-17
国家自然科学基金项目(30760135)
*通讯作者 Tel:86-991-8762831;E-mail:tixiaonan@163.com
R284.2
A

