水甲痔血胶囊毒理作用研究※
罗伦才 季小平 张仲林 李列平 杨 彬 唐 玲 钟振东
(1 四川省凉山州第二人民医院,西昌615000; 2 成都医学院,成都610083;3 四川省人民医院实验动物研究所,成都610212)
水甲痔血胶囊系根据我院协定处方研制而成的院内制剂,由水指甲、栀子、黄连、夏枯草、僵蚕等药物组成,具有清热散结、凉血止血之功,用于痔疮肿痛、出血,对痔疮出血效果显著。为了给临床用药提供安全依据,根据国家新药相关法规和技术规范[1-5],我们于2010年9月至2011年9月对水甲痔血胶囊进行了毒理作用研究,现将结果报告如下。
1 材料和方法
1.1 材料
1.1.1 动物 昆明种小鼠,56只,体重l8~22 g;SD大鼠,120只,体重110~140g。均雌雄各半,动物合格证号均为SYXK(川)2008-049号,由成都中医药大学实验动物中心提供。
1.1.2 药物 水甲痔血胶囊细粉,由凉山州第二人民医院制剂室提供,批号:20100813,每1g细粉含有0.3g生药。
1.1.3 试验仪器 KX-21N全自动血液分析仪,由日本东亚Sysmex公司生产;RT-1904C半自动生化仪,由美国Rayto公司生产;Leica-1015切片机,由德国徕卡仪器有限公司生产;TSJ-Q型全自动封闭式组织脱水机、BMJ-Ⅲ型包埋机及HY-Ⅲ型病理组织漂烘仪,均由江苏常州市中威医疗仪器有限公司生产;Motic BA400显微镜,由天津麦克奥迪实业集团有限公司生产。
1.2 方法
1.2.1 小鼠急性毒性试验 取合格昆明种小鼠20只,雌雄各半,用改良寇氏法计算LD 及95% 的可信区间,测定LD ;若无法测定LD 则测量最大耐受量,动物禁食不禁水12h后,用最高的药物浓度(能顺利通过灌胃针头)和动物的最大胃容纳量0.4 mL/10g,3次/d 给药,观察 14d[6]。
1.2.2 大鼠长期毒性试验 取110~140 g大鼠80只,雌雄各半,在动物房适应5d后,按体重和雌雄随机分为空白对照组(给生理盐水)和用药高、中、低剂量[分别为3.84、1.92、0.48 g (kg•d)]组,每组30只,雌雄各半,分笼饲养,每笼l0只。在实验室饲育1周,观察各组动物活动、进食、粪便等情况均无异常后,采用临床给药途径灌胃给药。各剂量组按等容积不同浓度,每l00g体重灌胃lmL药液,连续l3周。每周停药1d并称重,按体重增减情况调整用药剂量。实验期间观察动物的行为活动、外观体征、体重、毛发、进食及粪便等情况。末次给药后,每组取20只大鼠,雌雄各半,禁食不禁水12h,主动脉取血,分别进行红细胞(RBC)、白细胞(WBC)、血红蛋白(HGB)、LPR(淋巴细胞百分率)和凝血酶原时间(PT)等测定;血液离心后取血清进行尿素(UREA)、总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)等测定;对脏器进行全面肉眼尸检,解剖取心、肝、脾、肺、肾、胸腺、子宫、肾上腺、胃、十二指肠,其中心、肝、脾、肺、肾、胸腺、子宫称取湿重,求出脏器系数,将上述器官用甲醛溶液固定,常规病理切片,进行组织学检查。余下的动物停药2周后,按上述方法进行检测,观察有无药物所致的延迟性变化。
1.3 统计学方法 用SPSS 13.0统计软件,组间比较用t检验。
2 结果
2.1 小鼠急性毒性试验 试验结果发现,水甲痔血胶囊的最大耐受量(MTD)为36g/kg,按60 kg人计算,相当于临床用量的1125倍,在观察期内,未发现动物有明显的中毒症状和死亡发生,14d后体重均有所增长。
2.2 大鼠长期毒性实验
2.2.1 一般情况 观察试验期间,动物活泼健康,皮毛光亮,行为活动、外观体征等未见异常,高剂量组大鼠在每次给药后出现粪便溏烂的现象,l~3 h后恢复,其余各组粪便性状未见异常。各组大鼠体重均呈增长趋势,给药4周及停药2周与空白对照组比较差异均无统计学意义,见表1。
表1 水甲痔血胶囊对大鼠体重的影响 (±s)

表1 水甲痔血胶囊对大鼠体重的影响 (±s)
注:与空白对照组比较,*P<0.05,**P<0.01
时间 n 空白组 高剂量组 中剂量组 低剂量组1周 20 147.77±5.58 147.53±8.67 145.93±8.11 145.10±9.73 2周 20 172.37±7.17169.97±12.00170.13±9.70 169.27±11.66 3周 20 195.67±6.74191.97±10.46192.33±9.05 189.10±13.01*4周 20228.17±10.10223.87±11.74223.13±12.11218.53±13.77**5周 20247.20±15.02245.10±11.83246.30±15.45 245.80±8.69 6 周 20270.10±12.31267.30±10.80271.70±16.06 268.70±9.46
2.2.2 脏器检查 尸检动物各脏器,肉眼观察未见病变,称取心、肝、脾、肺、肾、脑、胸腺,肾上腺等脏器湿重,计算出器官系数,并与空白对照组比较,给药4周后中低剂量组脑脏器系数降低,与空白组差异有显著性(P<0.05),其余各组各脏器系数与空白组比较差异均无统计学意义。停药2周后,各组各脏器系数与空白组比较差异均无统计学意义。具体情况见表2。
表2 水甲痔血胶囊对大鼠器官系数的影响 (±s)
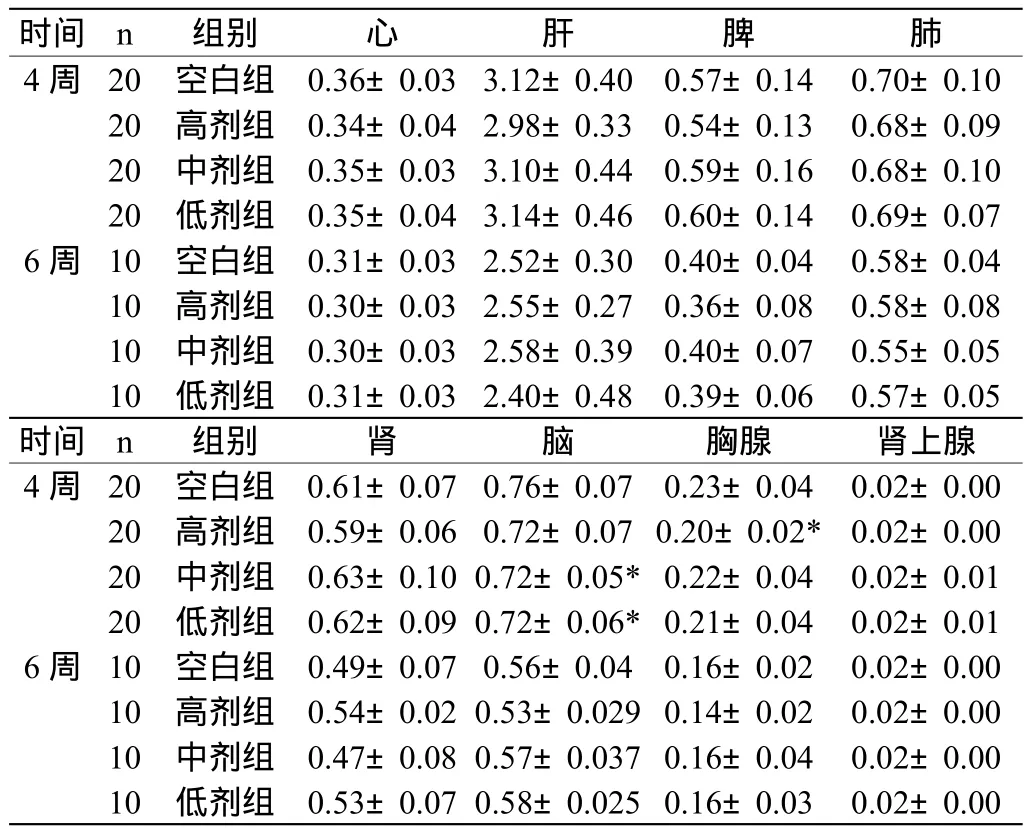
表2 水甲痔血胶囊对大鼠器官系数的影响 (±s)
注:与空白对照组比较,*P<0.05
时间 n 组别 心 肝 脾 肺4周 20 空白组 0.36±0.033.12±0.40 0.57±0.14 0.70±0.10 20 高剂组 0.34±0.042.98±0.33 0.54±0.13 0.68±0.09 20 中剂组 0.35±0.033.10±0.44 0.59±0.16 0.68±0.10 20 低剂组 0.35±0.043.14±0.46 0.60±0.14 0.69±0.07 6周 10 空白组 0.31±0.032.52±0.30 0.40±0.04 0.58±0.04 10 高剂组 0.30±0.032.55±0.27 0.36±0.08 0.58±0.08 10 中剂组 0.30±0.032.58±0.39 0.40±0.07 0.55±0.05 10 低剂组 0.31±0.032.40±0.48 0.39±0.06 0.57±0.05时间 n 组别 肾 脑 胸腺 肾上腺4周 20 空白组 0.61±0.070.76±0.07 0.23±0.04 0.02±0.00 20 高剂组 0.59±0.060.72±0.070.20±0.02* 0.02±0.00 20 中剂组 0.63±0.100.72±0.05*0.22±0.04 0.02±0.01 20 低剂组 0.62±0.090.72±0.06*0.21±0.04 0.02±0.01 6周 10 空白组 0.49±0.070.56±0.04 0.16±0.02 0.02±0.00 10 高剂组 0.54±0.020.53±0.0290.14±0.02 0.02±0.00 10 中剂组 0.47±0.080.57±0.0370.16±0.04 0.02±0.00 10 低剂组 0.53±0.070.58±0.0250.16±0.03 0.02±0.00
2.2.3 病理组织学检查 病理切片观察给药4周和停药后2周(恢复期)各给药组的心、肝、脾、肺、肾、脑、胸腺、肾上腺、睾丸、附睾、子宫及卵巢等均未见典型的炎症、增生或萎缩等病理学改变,与对照组比较均未见异常改变。
2.2.4 血常规检查 给药4周后,低剂量组RBC降低,高中低剂量组LPR均降低,与空白组差异有显著性(P<0.05,P<0.01),其余各组各指标均无统计学差异;停药2周,高剂量组HGB升高,低剂量组PLT降低,与空白组差异有显著性(P<0.05),其余各组各指标均无统计学差异。血液生化学检查:给药4周后,高剂量组ALP、CREA及UREA均降低,中剂量组ALP、UREA及GLU均降低,低剂量组ALP、GGT、CREA及UREA均降低,与空白组差异有显著性(P<0.05,P<0.01),其余各组各指标均无统计学差异;停药2周,中剂量组TBIL降低,高剂量组CREA降低,与空白组差异有显著性(P<0.05),其余各组各指标均无统计学差异。具体结果见表3~4。
表3 水甲痔血胶囊对大鼠血常规指标的影响 (±s)

表3 水甲痔血胶囊对大鼠血常规指标的影响 (±s)
注:与空白对照组比较,*P<0.05,**P<0.01
时间 n 组别 RBC(×1012/L)WBC(×1012/ L)HGB(g/l)4周 20 空白组 7.84±1.02 11.02±3.10 138.70±6.16 20 高剂组 7.33±0.97 10.78±3.45 138.65±6.28 20 中剂组 7.66±1.13 12.62±4.61 136.65±6.78 20 低剂组 7.09±0.59* 11.15±3.08 138.90±5.24 6周 10 空白组 7.09±0.91 9.16±2.07 137.00±6.90 10 高剂组 7.75±1.32 10.78±2.58 146.90±6.35*10 中剂组 7.44±1.38 11.21±4.80 142.50±11.88 10 低剂组 6.78±1.00 9.77±1.66 137.00±8.30时间 n 组别 LPR(%)PLT(×109/L)PT(s)4周 20 空白组 67.95±8.48 621.10±114.19 13.50±1.14 20 高剂组 75.10±6.51** 608.45±123.47 13.39±2.20 20 中剂组 72.75±7.48* 623.40±136.88 13.66±1.09 20 低剂组 74.35±7.22** 603.30±129.39 13.29±1.33 6周 10 空白组 73.20±5.39 672.40±115.48 13.38±1.49 10 高剂组 71.60±4.97 648.80±184.29 13.05±1.51 10 中剂组 68.10±6.87 600.30±153.55 13.17±1.15 10 低剂组 66.80±13.68 516.10±206.89* 14.02±1.05
表4 水甲痔血胶囊对大鼠血液生化学指标的影响 (±s)
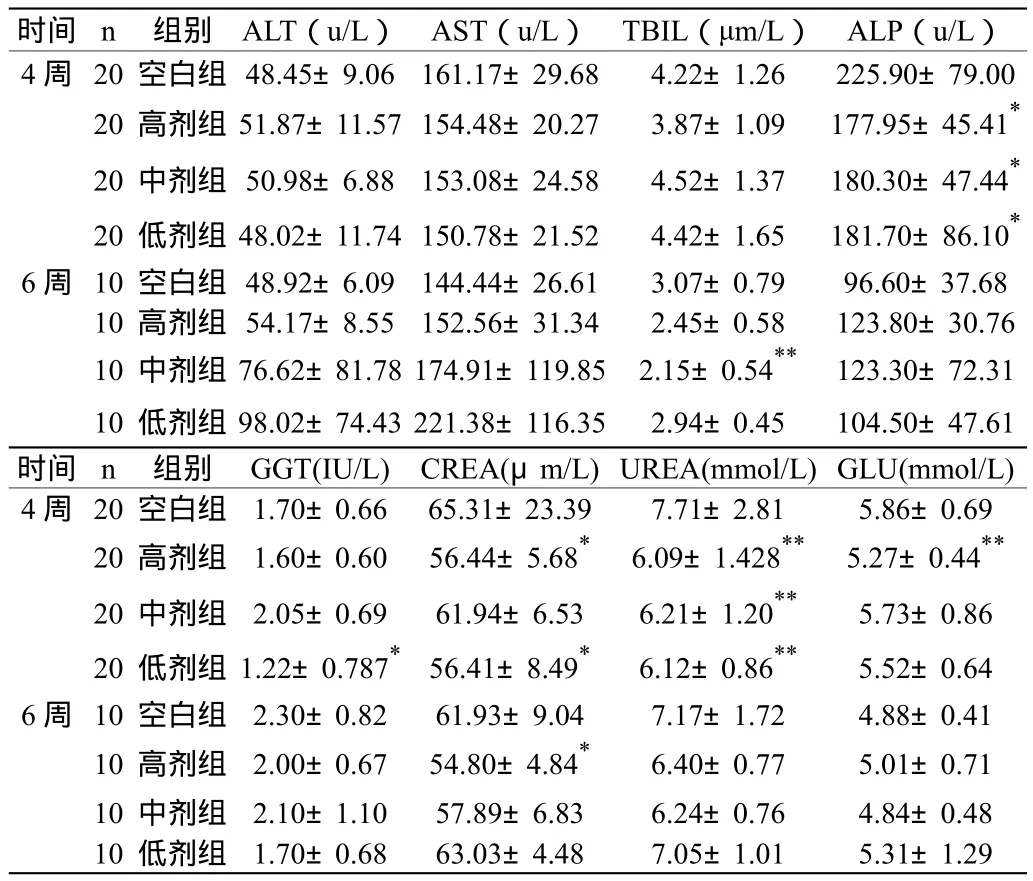
表4 水甲痔血胶囊对大鼠血液生化学指标的影响 (±s)
注:与空白对照组比较,*P<0.05,**P<0.01
时间 n 组别 ALT(u/L)AST(u/L)TBIL(μm/L)ALP(u/L)4周 20空白组 48.45±9.06 161.17±29.68 4.22±1.26 225.90±79.00 20高剂组 51.87±11.57154.48±20.27 3.87±1.09 177.95±45.41*20中剂组 50.98±6.88 153.08±24.58 4.52±1.37 180.30±47.44*20低剂组 48.02±11.74150.78±21.52 4.42±1.65 181.70±86.10*6周 10空白组 48.92±6.09 144.44±26.61 3.07±0.79 96.60±37.68 10高剂组 54.17±8.55 152.56±31.34 2.45±0.58 123.80±30.76 10中剂组 76.62±81.78174.91±119.85 2.15±0.54** 123.30±72.31 10低剂组 98.02±74.43221.38±116.35 2.94±0.45 104.50±47.61时间 n 组别 GGT(IU/L)CREA(μm/L)UREA(mmol/L)GLU(mmol/L)4周 20空白组 1.70±0.66 65.31±23.39 7.71±2.81 5.86±0.69 20高剂组 1.60±0.60 56.44±5.68* 6.09±1.428** 5.27±0.44**20中剂组 2.05±0.69 61.94±6.53 6.21±1.20** 5.73±0.86 20低剂组 1.22±0.787* 56.41±8.49* 6.12±0.86** 5.52±0.64 6周 10空白组 2.30±0.82 61.93±9.04 7.17±1.72 4.88±0.41 10高剂组 2.00±0.67 54.80±4.84* 6.40±0.77 5.01±0.71 10中剂组 2.10±1.10 57.89±6.83 6.24±0.76 4.84±0.48 10低剂组 1.70±0.68 63.03±4.48 7.05±1.01 5.31±1.29
3 讨论
水甲痔血胶囊临床采用口服给药途径,以最高药物浓度(能顺利通过灌胃针头)和动物的最大胃容纳量0.4mL/10 g,3次/d给药,连续观察14 d,未见死亡。急性毒性试验表明,水甲痔血胶囊的最大耐受量为36g/kg,相当于成人临床用量的1125倍。
本试验以高、中、低3个剂量连续给大鼠灌胃90d,进行长期毒性实验。通过观察其进食、体重、外观体征和行为活动、粪便性状等一般状况,血常规、肝、肾功能和心、肝、脾、肺、肾、脑、肾上腺、胸腺等脏器系数及病理学组织检查,与对照组比较均未见异常,提示水甲痔血胶囊对上述器官无病理性损害。就体重而言,给药4周及停药2周后与空白组比较,各剂量组动物的体重有所下降,但均无统计学意义(P>0.05)。就脏器系数与空白组比较而言,除中低高剂量组脑在给药4周后降低且有显著性差异(P<0.05),其余脏器无差异。就血常规指标而言,与空白组比较各组在给药4周,低剂量组红细胞降低,高中低剂量组淋巴细胞百分率均降低,且有显著性差异(P<0.05,P<0.01);停药2周,高剂量组血红蛋白含量升高,低剂量组血小板降低,且有显著性差异(P<0.05),其余各组各指标变化均无差异。就血生化指标而言,给药4周高中低剂量组碱性磷酸酶及尿素降低,高低剂量组血肌酐降低,中剂量组血糖降低,低剂量组γ谷氨酰转肽酶降低,与空白组差异有显著性(P<0.05,P<0.01);停药2周,中剂量组TBIL降低,高剂量组血肌酐降低,与空白组差异有显著性(P<0.05),其余各组各指标均无统计学差异。组织病理检测结果显示,各组各脏器均无异常病理变化。综上所述,在13周给药期间未见明显毒性反应,亦未见延迟毒性反应。
本实验对水甲痔血胶囊进行了毒理作用研究,通过对上述实验结果分析认为,水甲痔血胶囊在规定剂量下服用是安全可靠的,为其临床安全性用药提供了可靠实验依据。
[1]国家食品药品监督管理局.药品注册管理办法[S].2007.
[2]国家食品药品监督管理局.中药、天然药物急性毒性研究技术指导原则[S].2005.
[3]国家食品药品监督管理局.中药、天然药物长期毒性试验技术指导原则[S].2005.
[4]国家食品药品监督管理局.药物非临床研究质量管理规范[S].2003.
[5]卫生部药政局.中药新药研究指南(药学、药理学、毒理学)[S].1994.
[6]陈奇.中药药理研究方法学[M].2版,北京:人民卫生出版社,2006:107-113.

