应用固相支撑液液萃取-平行蒸发前处理技术检测饲料中四种硝基呋喃类药物
王彩娟,祝伟霞,杨冀州,孙转莲,张巨洲,张书胜
(1.河南出入境检验检疫局,郑州 450003;2.郑州大学化学与分子工程学院,郑州 450042)
硝基呋喃是人工合成的抗菌类药物,主要用于预防和治疗沙门氏菌和大肠杆菌引起的胃肠道疾病。经毒理学评价证明硝基呋喃类药物具有很强“三致”效应,长期使用易危害动物及人类的身体健康,目前国内外已全面禁止硝基呋喃类原药作为饲料添加剂使用[1-2]。为贯彻食品安全源头控制的监管要求,建立一种快速、灵敏的分析方法监督饲料中硝基呋喃类原药的含量已势在必行。
国内外有关饲料中硝基呋喃原药的检测报道主要采用分光光度法[3]、酶联免疫吸附法(ELISA)[4]、高效液相色谱法(HPLC)[5]、液相色谱质谱法(LC-MS)[6-8]等。饲料中硝基呋喃原药的前处理方法主要采用有机溶剂提取和固相萃取(SPE)净化方法,文献报道了混合阴离子交换SPE柱[5]、亲水 - 亲脂平衡填料[6]、石墨化碳黑/氨基混合柱[7]、反相C18填料[3]等 SPE 方法净化饲料中四种硝基呋喃原药,农业部1486号公告采用乙腈提取,混合型阳离子交换柱净化[9]的前处理方法。已报道的方法需要多步溶剂转移步骤,闫晓东等[1]测定饲料时采用乙腈提取后直接测定,但提取液中干扰物质较多。2011年,本实验室采用固相支撑液液萃取-全自动平行蒸发前处理技术建立了动物源性食品中硝基呋喃代谢物的分析方法[10],净化效果理想。在此研究基础上,本文采用该前处理净化技术建立了饲料中四种硝基呋喃原药的快速分析方法。
1 实验部分
1.1 仪器、药品与试剂 Agilent 1200高效液相色谱仪(配二极管阵列检测器,美国Agilent公司);8210超声波提取仪(日本Yamato公司);IKA T18涡旋混匀器(德国IKA公司);CT6E离心机(日本Hitachi公司);Synore Q101平行蒸发-固相萃取仪(配真空泵、冷凝器,瑞士BÜCHI公司);Chem Elut萃取柱(20 mL,美国Varian公司)。呋喃唑酮、呋喃它酮、呋喃西林和呋喃妥因标准物质(纯度≥97%,德国Dr.Ehrenstrofer公司)。乙酸乙酯、甲醇和乙腈(色谱纯,美国Fisher公司);实验用水均由Milli-Q超纯水系统制备;其他试剂均为市售分析纯。
1.2 分析条件 色谱柱为ZORBAX SB C 18(4.6 mm×250 mm,5 μm);流动相:A相为乙腈,B相为10 mmol/L乙酸铵溶液(pH=4),梯度洗脱程序见表1;柱温30℃;检测波长365 nm;进样量20 μL。
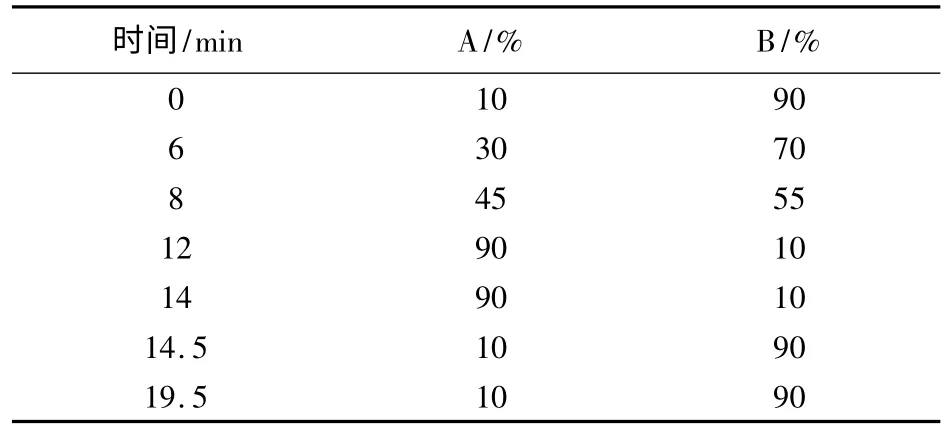
表1 液相色谱梯度洗脱程序
1.3 实验步骤 称取(2.00±0.02)g样品,加入20 mL甲醇-1 mol/L(pH=7)磷酸盐缓冲溶液(30 ∶70,V/V),涡旋混合 3 min,超声提取 10 min,4000 r/min离心5 min,转移上清液于固相萃取-平行蒸发仪的Chem Elut柱,待样液全部通过柱体后,静置等待反应30 min,加入20 mL乙酸乙酯以1.0 mL/min流速洗脱待测物,流出液至平行蒸发试管中,再加入20 mL乙酸乙酯重复洗脱步骤,洗脱液全部收集于平行蒸发管,以振荡速度185 r/min、冷却温度-4℃,加热温度60℃,真空下将洗脱液浓缩至干,2 mL乙腈-10 mmol/L乙酸铵(10 ∶90,V/V)溶解残渣,过0.22 μm 滤膜,待测定。
2 结果与讨论
2.1 提取条件的优化 饲料中富含灰分、蛋白和碳水化合物等物质,文献报道硝基呋喃类药物的提取主要采用乙腈、甲醇、乙酸乙酯及其盐溶液。本研究分别考察了乙腈、甲醇、乙酸乙酯、乙腈-磷酸盐、甲醇-磷酸盐作为提取剂时的提取效率,结果表明5种提取溶剂提取四种硝基呋喃原药回收率均≥70%,甲醇-磷酸盐混合液提取干扰物质少,同时该提取液与净化方法匹配,因此实验选择甲醇-磷酸盐(30∶70,V/V)作为饲料提取溶剂。
2.2 净化方法的选择 饲料样品基质复杂,提取液中存在的干扰物质易影响色谱仪器分离。聚苯乙烯-二乙烯基苯柱、亲水-亲脂平衡填料SPE净化方法用于硝基呋喃代谢物净化时可获得较高的回收率,但这些净化方法包括多步溶剂转移步骤,操作繁琐耗时。本方法试验了固相支撑液液萃取技术用于硝基呋喃原药分析时的效果,该方法基于样液与硅藻土填料柱作用形成特有的“支撑骨架”萃取模式,乙酸乙酯类有机溶剂通过该柱时,目标物被萃取至有机相,液液萃取步骤在固相萃取-平行蒸发系统完成,减少了有机溶剂消耗和溶剂转移步骤,样品的净化和富集过程在全自动的条件下完成,四种硝基呋喃萃取回收率≥90%,因此本实验选用固相支撑液液萃取作为净化方法。
2.3 固相支撑液液萃取条件的优化 样液在硅藻土柱中的平衡时间是影响固相支撑液液萃取回收率的重要参数,本研究分别考察了 10、20、30、40、50、60 min平衡时间对萃取效率的影响。结果表明,溶液与硅藻土填料可在30 min时间内形成牢固的支撑作用。同时试验了不同体积乙酸乙酯(5、10、15、20和25 mL)的萃取效率,实验结果表明5、10、15 mL的回收率约为45%,20和25 mL的回收率72%,四种硝基呋喃原药回收率随乙酸乙酯体积逐渐增加。试验选用20 mL乙酸乙酯在重力作用下分两次萃取,四种硝基呋喃萃取回收率≥98%。
2.4 色谱条件的优化 硝基呋喃类化合物结构中含有多个杂环共轭结构,在紫外波长下具有特征吸收。实验在200~800 nm波长范围内对待测物进行扫描,结果表明四种待测物在260、365 nm处均有较强特征吸收,其中365 nm处样品干扰峰少,方法最终选用365 nm作为检测波长。比较了多种商品化液相色谱柱CAPCELL PAK MGⅡC18、ZORBAX SB C18、ZORBAX Extend C18、Symmetry C18、Gemini-NX C18和YMC-ODS-AQ等的分离效果,发现未封端ZORBAX SB C18柱分离度好、灵敏度高。实验选用ZORBAX SB C18柱作为分离柱,标准溶液的色谱图如图1所示。
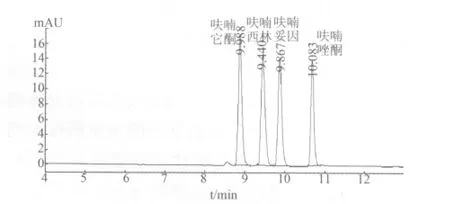
图1 四种硝基呋喃原药标准溶液的色谱图(1 μg/mL)
2.5 线性范围和方法定量限 取一系列标准工作溶液进行测定,以峰面积(Y)对相应的浓度(X,μg/mL)作标准曲线,在0.05~10 μg/mL的浓度范围内线性关系良好,线性方程分别为:呋喃它酮Y=109.47X-0.9327(r=0.9998),呋喃西林Y=101.32X+0.7439(r=0.9997), 呋 喃 妥 因Y=92.653X+0.0633(r=0.9999),呋 喃 唑 酮Y=76.347X-0.9633(r=0.9999)。 以 信 噪 比S/N≥10为依据,四种硝基呋喃原药的方法定量限(LOQ)为0.1 mg/kg。
2.6 方法回收率与精密度 称取空白饲料样品,在0.1、0.2、1.0 mg/kg三个浓度水平作加标回收试验,按照本方法所述步骤每个浓度重复测定10次,空白样品的加标色谱图如图2所示,获得方法回收率在78.4% ~105.3%,RSD为1.8% ~7.2%(表2)。

表2 方法回收率和精密度

图2 空白饲料样品中添加四种硝基呋喃原药的回收色谱图
3 结论
首次采用硅藻土固相支撑液液萃取-平行蒸发建立了浓缩饲料、预混合饲料和功能性饲料中四种硝基呋喃原药的检测方法,方法技术参数均满足禁用药物限量要求。样品前处理集浓缩与净化于一体,自动化程度高,操作简单,通过分析送检饲料样品,并将本方法与农业部1486号公告中的现行方法进行比较,样品测定结果与标准方法的测定结果一致,相对偏差小于10%,可作为饲料中4种硝基呋喃原药分析测定的高通量常规检测方法。
[1]闫晓东,王克宁,张会彩,等.检测饲料中4种硝基呋喃类药物的简易高效液相色谱法[J].畜牧和兽医,2010,42(3):86-89.
[2]魏晋梅.饲料中三种硝基呋喃类兽药超高效液相色谱同步检测方法[D].兰州:甘肃农业大学,2007.
[3]Galeano Díaz T,Guiberteau Cabanillas A,Acedo Valenzuela M I,et al.Determination of nitrofurantoin,furazolidone and furaltadone in milk by high-performance liquid chromatography with electrochemical detection[J].Journal of Chromatography A,1997,764:243-248.
[4]Diblikova I,Cooper K M,Kennedy D G,et al.Monoclonal antibody-based ELISA for the quantification of nitrofuran metabolite 3-amino-2-oxazolidinone in tissues using a simplified sample preparation[J].Analytica Chimica Acta,2005,540(1/2):285-292.
[5]Conneely A,Nugent A,Keeffe M O,et al.Isolation of bound residues of nitrofuran drugs from tissue by solid-phase extraction with determination by liquid chromatography with UV and tandem mass spectrometric detection[J].Analytica Chimica Acta,2003,483:91-98.
[6]Xia X,Li X W,Zhang S X,et al.Simultaneous determination of 5-nitroimidazoles and nitrofurans in pork by high-performance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2008,1208(1/2):101-108.
[7]Barbosa J,Moura S,Barbosa R,et al.Determination of nitrofurans in animal feeds by liquid chromatography-UV photodiode array detection and liquid chromatography-ionspray tandem mass spectrometry[J].Analytica Chimica Acta,2007,586:359-365.
[8]Klein J,Alder L.Applicability of gradient liquid chromatography with tandem mass spectrometry the simultaneou screening for about 100 pesticides in crops[J].Journal of AOAC International,2003,86(5):1015-1037.
[9]农业部1486号公告-8-2010.饲料中硝基呋喃类药物的测定,高效液相色谱法[S].
[10]祝伟霞,袁 萍,杨冀州,等.固相支撑液液萃取-平行蒸发前处理技术测定动物源性食品中4种硝基呋喃类代谢物[J].食品科技,2011,36(2):300-303.

