高效液相色谱法测定鸡鸭羊组织中环丙氨嗪残留量
周 炜,应永飞,韦敏珏,罗成江,朱聪英
(浙江省兽药监察所,杭州 310020)
环丙氨嗪(2-环丙氨基-4,6-二氨基-S-三嗪,cyromazine),又名灭蝇胺、灭蛆灵、灭蝇药或蝇得净,是一种选择性昆虫生长调节剂,可诱使双翅目幼虫和蛹在形态上发生畸变,使成虫羽化不全或受到抑制。2002年我国农业部批准环丙氨嗪为三类新兽药。通过饲喂方式进入动物体内的环丙氨嗪,绝大部分以原形(约99%)及其代谢产物的形式随粪便排出体外并沉积在粪便中,因而可用于控制动物厩舍内蝇蛆的生长发育,改善畜禽养殖场环境卫生。尽管环丙氨嗪毒性较小,但大量研究表明环丙氨嗪在动物体内的主要代谢产物是三聚氰胺。据Melnick R L等[1]的研究表明,三聚氰胺可导致动物体重下降、肝脏肿大、血液中血红蛋白及血细胞减少、胎儿体重减轻,还可诱导小鼠膀胱肿瘤的形成,可能是一种致癌物质。
我国农业部235号公告规定了:环丙氨嗪在羊肌肉、脂肪、肝、肾中的最高残留限量为300 μg/kg;在禽肌肉、脂肪、副产品中的最高残留限量为50 μg/kg,但对三聚氰胺尚未制订最高残留限量。国内外学者对肉鸡组织、鸡蛋、牛奶、土壤及饲料中环丙氨嗪及其代谢物——三聚氰胺残留量的检测进行了大量研究,但羊组织及禽副产品中环丙氨嗪残留量的检测鲜有报道。已有研究表明,在大鼠、猴、羊、母鸡体内,环丙氨嗪经口服后可被迅速吸收并迅速排泄,其中大于70%的环丙氨嗪以原型存在于排泄物中,三聚氰胺约为15%,氢氧化环丙氨嗪、甲基环丙氨嗪约2%[2]。亦有研究表明:三聚氰胺在动物体富集快,但代谢亦快,在低浓度饲喂猪、鸡时,休药后三聚氰胺即基本代谢完全,残留量极少[3]。因而,结合农业部235号公告,本研究拟不考虑三聚氰胺的残留,仅开展针对羊肌肉、脂肪、肝、肾和禽肌肉、脂肪、副产品中环丙氨嗪残留检测的研究。
1 材料与方法
1.1 试剂与仪器 环丙氨嗪标准品(97.0%),美国Sigma公司;混合阳离子交换固相萃取柱(MCX,60mg:3mL),美国Waters公司;Agilent 1100高效液相色谱仪(配紫外检测器)及Agilent化学分析工作站,美国Agilent公司;Symmetry C18(4.6 mm×250 mm,5.0 μm)色谱柱、XBridgeTMHILIC(2.1 mm ×150 mm,3.0 μm)色谱柱、Atlantis HILIC(2.1 mm ×150 mm,3.0 μm)色谱柱,美国 Waters公司;XDB C18(4.6 mm ×250 mm,5.0 μm)色谱柱、RX-SIL(2.1 mm ×150 mm,5.0 μm)色谱柱,美国 Agilent公司。
1.2 标准品溶液 准确称取环丙氨嗪标准品25 mg于25 mL容量瓶中,用甲醇配成浓度为1.0 mg/mL的标准储备液;吸取标准储备液1.0 mL于100 mL容量瓶中,用甲醇定容至刻度,配制成10.0 mg/L的标准工作液;吸取适量体积的标准工作液,用流动相稀释含环丙氨嗪为0.05、0.10、0.20、0.50、1.0、2.0 mg/L的系列标准工作液。
1.3 色谱条件 色谱柱:XBridgeTMHILIC(2.1 mm×150 mm,3.0 μm);检测波长214 nm;流动相为乙腈/25 mmol/L乙酸铵溶液(4∶96,V/V);柱温30 ℃;流速0.3 mL/min;进样量20 μL。
1.4 样品预处理
1.4.1 样品提取 称取(5±0.05)g试料于50 mL离心管中,加入15 mL提取液(乙腈∶1%三氯乙酸溶液,15∶85,V/V),以 10000 r/min速度匀质1 min,再以5000 r/min离心5 min,收集上清液,然后在残渣中再加入10 mL提取液,同样步骤操作后合并上清液,用30 mL正己烷脱脂一次,收集乙腈相,加入5 mL异丙醇,在50℃水浴中旋转浓缩至1 mL左右,转移至10 mL刻度离心管中,用2 mL提取液淋洗鸡心瓶,合并提取液,待净化。
1.4.2 样品净化 依次用甲醇3 mL和水3 mL活化MCX固相萃取柱,将待净化液上柱,控制过柱速度在1 mL/min以内。用甲醇3 mL、0.1 mol/L盐酸溶液3 mL、水3 mL和甲醇3 mL淋洗固相萃取柱,抽干,用5%氨水甲醇溶液5 mL洗脱。洗脱液在50℃下氮气吹干,用1.0 mL流动相溶解残渣,涡旋30 s,经0.45 μm滤膜过滤后,上机测定。
2 结果与分析
2.1 检测条件的优化与选择
2.1.1 检测波长的确定 目前,国内外文献中测定动物组织中环丙氨嗪的方法中,测定波长主要为214 nm[4-6]和 230 nm[7],为了确定最佳检测波长,采用紫外分光光度计对最佳检测波长进行了考察。用甲醇稀释环丙氨嗪标准品至5 μg/mL溶液,照分光光度法测定,所得紫外光吸收图谱见图1。
由图1可知,环丙氨嗪在214 nm波长处有最大吸收,在230 nm波长处吸收值较弱,因此,确定214 nm波长为最佳检测波长。

图1 环丙氨嗪紫外吸收光谱图
2.1.2 液相色谱分离条件的确定 由于环丙氨嗪的极性较强,文献报道采用C18柱和氨基柱作为分析柱。本研究根据魏瑞成等[8]对猪肉中环丙氨嗪残留的提取方法,制备待测组织的提取液,作为阴性基质样本,随后通过基质加标的方法对C18柱、氨基柱及HILIC柱的色谱分离性进行考察。
结果显示,C18柱、氨基柱均无法实现环丙氨嗪与杂质的有效分离。而在HILIC柱条件下,当流动相中乙酸铵溶液/乙腈的比例为96∶4时,能得到较好的分离效果。羊肉样品环丙氨嗪在HILIC色谱柱上的分离效果见图2。

图2 环丙氨嗪在HILIC柱上的高效液相色谱图
2.1.3 干扰试验 考察在HILIC色谱柱条件下其他类似药物对环丙氨嗪分析方法的干扰。环丙氨嗪在畜禽体内主要代谢产物为三聚氰胺,本标准选用三聚氰胺进行了干扰试验,采用环丙氨嗪的色谱条件,三聚氰胺的保留时间为8.9 min,不影响环丙氨嗪的检测,三聚氰胺的色谱图见图3。
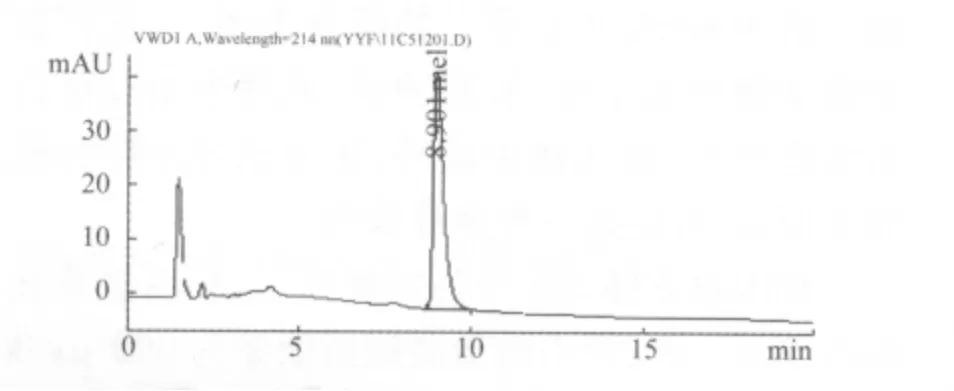
图3 三聚氰胺标准品溶液色谱图
2.2 样品前处理方法的优化
2.2.1 样品提取条件的确定 本研究比较了不同提取体积和提取次数下,乙腈/水溶液(95 ∶5、90 ∶10、85 ∶15、80 ∶20,V/V)以及1%三氯乙酸/乙腈溶液(90 ∶10、85∶15,V/V)对鸡肉组织中环丙氨嗪的提取效能。具体步骤如下:取阴性样本5.0 g,添加环丙氨嗪标准工作液适量,使之成为1.0 mg/kg阳性添加样品,分别用10 mL或15 mL提取液进行提取,重复提取三次,提取液经旋转蒸发浓缩至5 mL左右,经MCX混合阳离子交换柱净化,上机测定,外标法定量。各试验组均重复三次,结果以平均值表示,见表1所示。
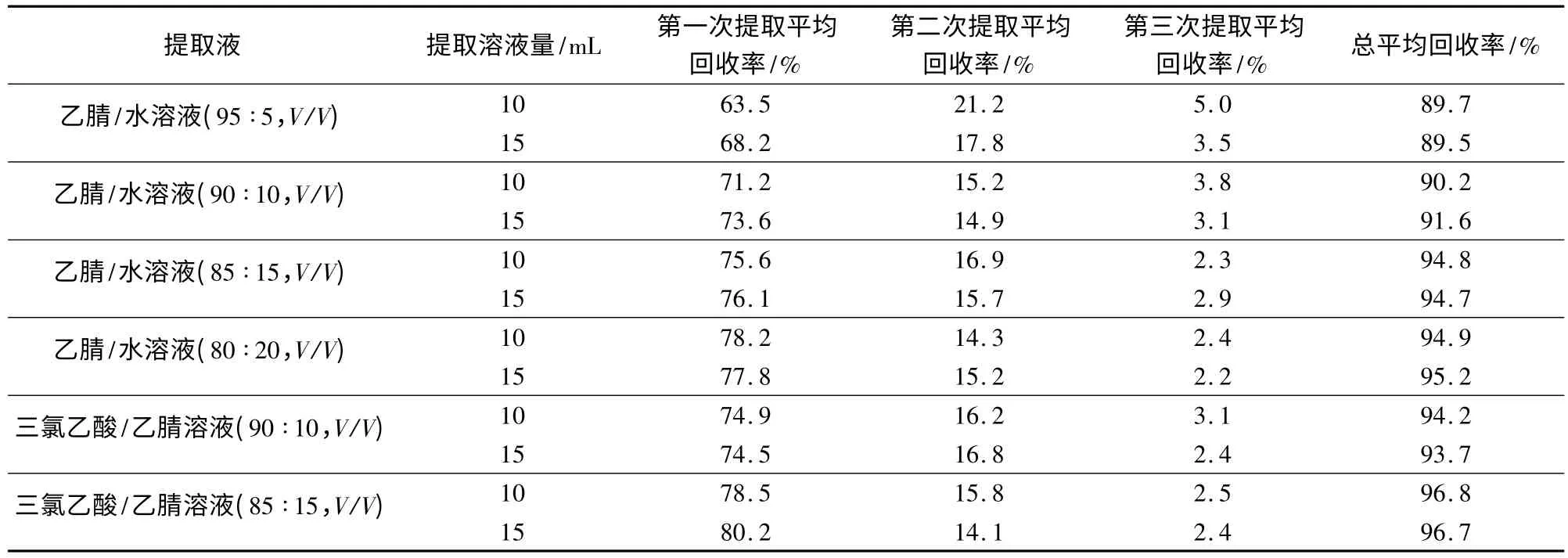
表1 提取溶剂选择及用量对环丙氨嗪提取效率的影响
从表1中可见,随着含水量的增加,提取液的提取效率逐渐提高,但是含水量太高时,为后续的浓缩处理增加了难度。三氯乙酸具有明显的沉淀蛋白作用,同时能改变提取环境的酸碱度为酸性,更有利于环丙氨嗪的提取,故具有更好的提取效率。综合考虑后,选用三氯乙酸/乙腈溶液(85∶15,V/V)为提取剂。在提取体积的选择上,发现无论是每次10 mL或15 mL提取液用量,总回收率均高于96%,且前两次的回收率之和均高于94%。考虑到尽量减少溶剂用量和节约时间等因素,本方法采用两次提取,第一次提取溶液用量15 mL、第二次提取溶液用量10 mL,作为样品的提取方法。
2.2.2 浓缩净化条件的确定 目前对于环丙氨嗪的净化方法,主要采用液液分配和固相萃取小柱进行净化,考虑到环丙氨嗪的极性较强,且容易得到质子形成季铵盐的阳离子结构,故本方法采用混合阳离子交换柱进行净化。
由于提取液提取完成后,提取液中含有大量的脂肪等干扰物质,特别是鸡脂肪形成了上下两层,需采用正己烷脱脂除去大部分的脂肪等干扰物质。本方法采用正己烷脱脂的方法,萃取体积为30 mL,脱脂后脂肪层明显减少,而环丙氨嗪因水溶性好而没有明显的损失,回收率稳定。FSIS等方法采用部分提取直接进行SPE净化,但是由于不同基质样品中含水量不同,取固定体积上柱往往会影响到最后的体积系数,回收率不稳定。且由于取部分提取液上柱,也在很大程度上降低了方法检测限,采用高效液相色谱法无法达到鸡组织及副产物最高残留限量中50 μg/kg的要求。故需要先对提取液进行浓缩,取浓缩液全部过柱的方法来提高方法的检测灵敏度。由于提取液中水分比例较高,需对浓缩方法进行研究,比较氮气吹干法和旋转蒸发法的适用性。采用氮气吹干法耗时费力,大大影响检测效率,而旋转蒸发法可通过控制系统真空度的方法,在提高前处理效率的同时保证方法的回收率,故本方法采用旋转蒸发法将样品提取液浓缩至1 mL左右,用2 mL左右提取液淋洗鸡心瓶二次,合并提取液,充分混匀后,在10000 r/min下冷冻(-4℃)离心10 min,取上清液,备用。
本标准的固相萃取条件主要参考FSIS等方法,结合混合阳离子交换柱(MCX柱)的应用条件,建立了以下净化步骤:取5 mL上清液样品转移到经3 mL甲醇、3 mL水活化的MCX固相萃取柱中,待全部溶液过柱后,再用3 mL甲醇淋洗、3 mL 0.1%盐酸溶液淋洗、3 mL水淋洗和3 mL甲醇淋洗并抽干柱子1 min,最后用5 mL 5%氨水/甲醇溶液洗脱,收集洗脱液,在50℃水浴中用氮气吹干,加入1.0 mL流动相溶解,过滤膜后进行HPLC分析。
2.3 检测方法的方法验证
2.3.1 标准曲线的建立 配置标准系列工作溶液,使其浓度为 0.05、0.10、0.20、0.50、1.0、2.0、5.0 mg/L。在上述色谱条件下,依次注入液相色谱仪进行分析,以峰面积y对浓度x(mg/L)作标准曲线,得回归方程:y=411.15x-8.247,R2=0.9999,结果表明:当环丙氨嗪在0.05~5.0 mg/L的浓度范围内时,呈现良好的线性关系。
2.3.2 检测限和定量限的确定 农业部235号公告规定,羊肌肉、脂肪、肝、肾中环丙氨嗪的最高残留限量为300 μg/kg,而禽肌肉、脂肪、副产品中的最高残留限量为50 μg/kg。为了满足这个要求,采用空白样品中添加浓度25 μg/kg环丙氨嗪的方法进行试验,考察方法的检测限和定量限。经回收率试验,当动物组织中添加环丙氨嗪为25 μg/kg时,信噪比(S/N)大于10;当动物组织中添加环丙氨嗪为10 μg/kg时,信噪比(S/N)大于3。所以,本方法将动物性食品中环丙氨嗪残留检测的方法定量限确定为 25 μg/kg,检测限确定为 10 μg/kg,完全能满足实际样品检测的需要。
2.3.3 方法的回收率和精密度 根据我国农业部235号公告的规定:羊肌肉、脂肪、肝、肾组织中环丙氨嗪的最高残留限量为300 μg/kg,禽肌肉、脂肪中环丙氨嗪的最高残留限量为50 μg/kg,因而初定对25、50、100、300、600 μg/kg 五种空白添加浓度进行方法学考查,不同组织的具体添加浓度及回收率数据见表2。
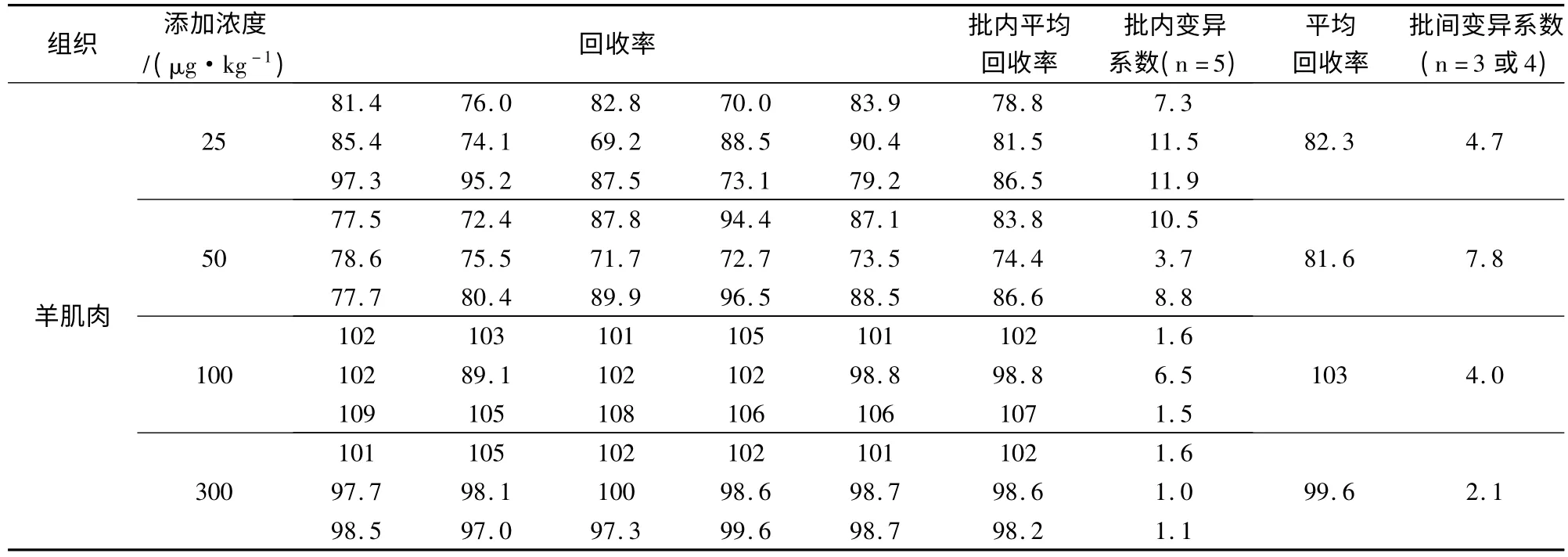
表2 不同动物组织中环丙氨嗪回收率试验 %

续表

续表
从回收率结果看出,羊肉、羊肝、羊肾和羊脂肪在25~600 μg/kg添加浓度范围内,回收率为74.4% ~107%,批内RSD在0.9% ~11.9%之间,批间RSD在0.3% ~11.1%之间。鸡肉、鸡肝、鸡脂肪和鸭肉在25~600 μg/kg添加浓度范围内,回收率为74.9% ~101%,批内 RSD在1.9% ~10.7%之间,批间RSD在1.2% ~7.1%之间。由此可见回收率满足通常70% ~120%的规定,批内RSD<15%,批间RSD<20%,说明本方法能满足动物性食品中环丙氨嗪测定的需要。
2.3.4 实际样品检测 在本实验设定的检测步骤和仪器条件下,对日常监测和市场抽查的15例羊组织(肌肉、脂肪、肝脏)以及26例禽组织(鸡肉、鸭肉、鸡脂肪、鸭肝)进行了检测,均未发现环丙氨嗪残留。
3 结论
研究建立了禽、羊可食性动物组织中环丙氨嗪残留检测方法,采用三氯乙酸/乙腈提取,经MCX固相萃取小柱净化后,上机检测,外标法定量,检测限为10 μg/kg,定量限为25 μg/kg。提取效果好,回收率在74% ~107%之间,批内RSD为0.9~11.9%,批间RSD为0.3% ~11.1%,能充分满足动物性食品中环丙氨嗪检测的需要,可为该药物的监控提供技术支持和保障,对保证国际之间正常贸易往来以及保障人类健康,具有十分重要的意义和实用价值。
[1]Melnick R L,Boorman G A,Haseman J K,et al.Urolithiasis and bladder carcinogenicity of melamine in rodents[J].Toxicol Appl Pharmacol,1984,72:292-303.
[2]罗芳琴,王 冉,候 翔,等.三聚氰胺的代谢原药—环丙氨嗪[J].江苏农业科学,2009,3:4-7.
[3]孙泽祥,杨 挺,鲍伟华,等.猪鸡体内三聚氰胺残留与代谢规律研究[J].兽医导刊,2009,8:49-51.
[4]郭 筠,莫汉宏,安凤春,等.HPLC法检测灭蝇胺在黄瓜和土壤中的残留[J].环境化学,2004,23(6):700-703.
[5]王 冉,柳伟荣,耿志明,等.高效液相色谱法测定饲料中环丙氨嗪[J].中国饲料,2005,2:34-36.
[6]FSIS.Cyromazine and Melamine[S].
[7]Yu H,Tao Y F,Chen D M,et al.Development of a high performance liquid chromatography method and a liquid chromatography-tandem mass spectrometry method with pressurized liquid extraction for simultaneous quantification and confirmation of cyromazine,melamine and its metabolites in foods of animal origin[J].Analytica Chimica Acta,2010,682:48-58.
[8]魏瑞成,王 冉,刘伟荣.高效液相色谱法测定鸡蛋、牛奶和猪肉中环丙氨嗪及三聚氰胺的实验研究[J].食品科学,2008,29(12):605-609.

