燕麦种子萌发过程中提取物的抑菌作用研究
胡青平 徐建国
燕麦种子萌发过程中提取物的抑菌作用研究
胡青平1徐建国2
(山西师范大学生命科学学院1,临汾 041004)
(山西师范大学食品科学与工程系2,临汾 041004)
以4种食品腐败菌为指示菌,采用滤纸片法和液体倍比稀释法对裸燕麦(Avena nuda L.)种子萌发过程中不同溶剂提取物的抑菌作用和最低抑菌浓度(MIC)进行了比较研究。试验结果表明,乙酸乙酯提取物的抑菌作用较好,但在种子萌发过程中抑菌效果不同,萌发24 h时燕麦种子的乙酸乙酯提取物的抑菌作用最强,其中对大肠杆菌的抑菌圈直径达(22.31±0.05)mm;其对金黄色葡萄球菌和大肠杆菌的最低抑菌浓度MIC小于6.25%,对鼠伤寒沙门氏菌和肠炎沙门氏菌的最低抑菌浓度MIC小于12.5%,旨为燕麦的综合利用及新型天然防腐剂的研发提供理论依据。
燕麦种子 萌发 抑菌
燕麦(Avena L.)为禾本科一年生草本植物,是重要的粮食与饲料兼用作物,也是食品加工的重要原料。燕麦有皮燕麦(A.vena L.)和裸燕麦(A.nuda L.)之分,我国的燕麦以裸燕麦为主[1]。裸燕麦的营养价值在禾谷类作物中居首位,蛋白质含量高达14%~19%[2],氨基酸的含量多、种类齐全。燕麦中还含有亚油酸和皂甙素,能降低血清总胆固醇、甘油三脂和β2脂蛋白T,防治动脉粥样硬化,对预防和治疗高血压、冠心病和糖尿病均属有益[3],因此开发和利用燕麦产品具有重要的实践意义。
化学合成防腐剂的安全性问题,使人们越来越注重植物源天然食品防腐剂的研发[4-5]。目前国内外关于燕麦的研究主要集中在β-葡聚糖[6]、蛋白质[7]、油脂[8]等方面的提取鉴定及其抗氧化活性[9],而燕麦对微生物生长抑制作用的研究不多,主要有以下报道:皮燕麦的根皂甙提取物[10-11]、幼苗的黄酮类和皂苷类提取物[12]、种子的水提取物[13]、皮燕麦中的甾醇提取物[14]和裸燕麦麸皮中的β-谷甾醇提取物[15]均有不同程度的抑菌作用。但对其抑菌作用的研究存在一些局限性:(1)燕麦品种以皮燕麦为主;(2)对抑制食品腐败菌的研究较少;(3)对燕麦萌发过程中抑菌作用的动态变化未见详细报道;这些不足限制了燕麦天然防腐剂的开发和应用推广。因此,本研究以裸燕麦为研究对象,采用滤纸片法和液体倍比稀释法对其种子萌发过程中不同溶剂初提物的抑菌作用和最低抑菌浓度MIC进行了比较研究,旨为我国特色燕麦资源——裸燕麦的综合利用及新型天然防腐剂的研发提供理论依据。
1 材料与方法
1.1 供试材料
燕麦:坝筱1号。
1.2 供试菌株
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、鼠伤寒沙门氏菌(Salmonella typhimurium)、肠炎沙门氏菌(Salmonella enteritidis):山西师范大学生命科学学院微生物实验室。
1.3 仪器与设备
HY-4型调速多用振荡器:江苏金坛市金城国胜实验仪器厂;RE-52旋转蒸发仪:上海亚荣生化仪器厂;YWQ-LS-STT型自动立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;SPX-300BG型生化培养箱:国华电器;722分光光光度计:上海精密科学仪器有限公司。
1.4 方法
1.4.1 燕麦种子提取物的制备
准确称取粉碎的燕麦样品20.0 g,平均分成4份,放入250 mL的三角瓶中,分别加入50 mL的蒸馏水、甲醇、丙酮和乙酸乙酯。30℃下超声30 min后,于8 000 r/min离心15 min,滤渣重复提取1次。合并上清液旋转蒸发,定容10 mL,4℃保存4种提取液备用。
1.4.2 燕麦种子萌发过程中提取物的制备
燕麦种子萌发样品分别是:原种子、浸泡12 h、发芽12 h、发芽24 h、发芽36 h、发芽48 h、发芽60 h,共7个处理。准确称取粉碎的7个萌发过程中的燕麦样品各5.0 g,按照1.4.1中所描述的方法,用乙酸乙酯提取各样品,4℃保存备用。
1.4.3 指示菌液的制备
将保存的各种指示菌种接种于LB斜面培养基中,在37℃恒温培养箱内培养24 h,活化2次。用接种环挑取少量活化管中的指示菌于装有玻璃珠及50 mL LB液体培养基的三角瓶内,振荡培养14 h,采用麦氏浊度法[16]测量菌浓,即用生理盐水配置成梯度菌液,以麦氏0.5标准管为对照,用分光光度计测量560 nm下的OD值,选择与0.5号麦氏浊度相同的菌悬液,指示菌浓度约为108cfu/mL。
1.4.4 燕麦种子提取液的抑菌试验
采用滤纸片法[16]测定燕麦种子萌发过程中提取物的抑菌作用。先用无菌棉签沾取菌液,涂布于LB培养基上,而后用无菌镊子夹取直径8 mm无菌滤纸片,将滤纸片贴在含菌平板上,轻压滤纸片使其与培养基接触良好,每皿贴4片,呈十字形对称放置,在每个滤纸片上,滴加30μL经微孔过滤器过滤的四种提取液,对称的两个滤纸片为对照组。等待检液完全渗入后,将平板放入37℃恒温培养箱中培养20 h,定时观察,并测定抑菌圈的大小,比较抑菌效果。
1.4.5 乙酸乙酯提取液MIC的确定
采用液体倍比稀释法[17],选取发芽24 h燕麦种子的乙酸乙酯提取物(按100%计),稀释成50%、25%、12.5%、6.25%、3.12%5个梯度浓度的稀释液,在无菌条件下,分别取100μL稀释液与1μL 0.5麦氏浊度的各菌液混匀,均匀涂布于平板上,每种指示菌的每个提取稀释液重复3次。同时取1.1 mL 0.5麦氏浊度的菌悬液涂布,作为阴性对照;另取一不加任何物质的平板,作为阳性对照。37℃恒温箱中培养20 h,以不长菌的提取物的最小浓度为该提取物的MIC。
1.5 数据处理
试验重复3次,数据经Excel进行ANOVA分析(P<0.05)。
2 结果与分析
2.1 不同溶剂提取物抑菌效果的比较
用滤纸片法分别对水、甲醇、丙酮、乙酸乙酯的燕麦提取物进行了抑菌试验,结果见表1和图1。

表1 不同溶剂燕麦种子提取物的抑菌效果/mm

图1 不同溶剂燕麦种子提取物的抑菌结果
由表1和图1可以看出,燕麦种子的水提取物对4种指示菌都没有抑制作用,甲醇、丙酮、乙酸乙酯的燕麦种子提取物对4种指示菌都有不同程度的抑制作用,其中,乙酸乙酯提取物的抑菌作用最强,尤其是对金黄色葡萄球菌和大肠杆菌的抑菌效果最为显著,其相对抑菌圈大小分别为(12.75±0.05)mm和(12.54±0.03)mm。所以,选取乙酸乙酯提取物备用。
2.2 燕麦种子萌发过程中乙酸乙酯提取物的抑菌作用
用滤纸片法,对燕麦种子萌发过程中的7个处理乙酸乙酯提取物的抑菌进行了比较,即未处理、浸泡12 h、发芽12 h~60 h(每12 h取1次样),结果见表2和图2。
由表2和图2结果显示,燕麦种子在萌发过程中抑菌效果不同,随种子发芽时间的增长抑菌效果越明显,但达到一定时间后又下降。其中,燕麦种子发芽24 h时的乙酸乙酯提取物的抑菌效果最好(P<0.05),尤其是对大肠杆菌的抑菌作用明显强于其他3种菌(P<0.05),其抑菌大小顺序为大肠杆菌>鼠伤寒沙门氏菌>金黄色葡萄球菌>肠炎沙门氏菌,其中对大肠杆菌的抑菌圈直径达(22.31±0.25)mm。这可能是由于在燕麦种子萌发过程中,抑菌物质的种类和含量发生变化导致的。

表2 燕麦种子萌发过程中乙酸乙酯提取物的抑菌效果/mm
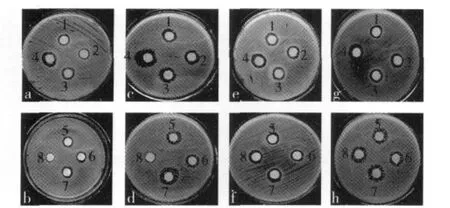
图2 燕麦种子萌发过程中乙酸乙酯提取物的抑菌效果
2.3 乙酸乙酯提取物MIC的测定
经发芽24 h的燕麦种子,用乙酸乙酯提取的抑菌物质,对4种指示菌的MIC结果见表3。

表3 乙酸乙酯提取物对4种指示菌的MIC/%
MIC是衡量抗菌活性大小的一个指标,由表3结果显示,当指示菌为金黄色葡萄球菌和大肠杆菌时,乙酸乙酯提取物的MIC小于6.25%;当鼠伤寒沙门氏菌和肠炎沙门氏菌为指示菌时,乙酸乙酯提取物的MIC小于12.5%,说明燕麦种子萌发24h的乙酸乙酯提取物对前2种指示菌的抑菌作用强于后2种指示菌。
3 讨论与结论
不做任何处理的燕麦种子的4种提取物中,乙酸乙酯提取物的抑菌作用最强,对鼠伤寒沙门氏菌的抑菌圈直径达(13.51±0.03)mm,对大肠杆菌的抑菌圈直径达(12.54±0.03)mm;燕麦种子不同萌发时间的乙酸乙酯提取物,具有不同的抑菌效果,其中萌发24 h的燕麦种子乙酸乙酯提取物的抑菌作用最强,对大肠杆菌的抑菌圈直径达(22.31±0.05)mm;萌发24 h的燕麦种子乙酸乙酯提取物对金黄色葡萄球菌和大肠杆菌的最低抑菌浓度MIC小于6.25%,而对鼠伤寒沙门氏菌和肠炎沙门氏菌的最低抑菌浓度MIC小于12.5%。可见,发芽可作为提高燕麦利用价值的有效手段。燕麦富含多酚、黄酮、甾醇等多种不同极性的活性物质,且这些物质在萌发过程中会有不同的变化[18]。因此,燕麦萌发过程中不同溶剂提取物的组成成分、结构及其抑菌机理有待于进一步研究。
[1]路长喜,王岸娜,周素梅.等.燕麦片加工品质评价及其品种相关性研究[J].中国粮油学报,2009,24(8):42-47
[2]赵世锋,田长叶,王志刚,等.我国燕麦生产和科研现状及未来发展方向[J].杂粮作物,2007,27(6):428-431
[3]任嘉嘉,魏益民,张波,等.高温处理燕麦籽粒对制粉及其营养成分的影响[J].中国粮油学报,2008,23(6):98-102
[4]白秀君,蒋益虹,杨海燕.荷叶提取液的抑菌特性研究[J].中国食品学报,2007,7(3):90-93
[5]蒋立文,彭巧云,易灿,等.纳豆提取物抑菌效果的初探[J].中国食品学报,2008,8(6):86-90
[6]申瑞玲,王志瑞,李宏全.等.燕麦β-葡聚糖对高胆固醇血症大鼠血脂和生长的影响[J].中国粮油学报,2009,24(1):44-48
[7]魏决,罗雯.燕麦中蛋白质的提取、纯化及氨基酸成分分析[J].成都大学学报(自然科学版),2007,26(4):283-285
[8]魏决,郭玉蓉,金小培,等.燕麦油脂的理化性质研究及脂肪酸组成分析[J].食品科技,2006,7:204-206
[9]田斌强,邓乾春,郭珊珊.等.化学发光法对燕麦贮藏蛋白质抗氧化活性的评价[J].中国粮油学报,2010,25(1):28-32
[10]Maizel J V,Burkhardt H J,Mitchell H K Avenacin,an antimicrobial substance isolated from Avena sativa.I.Isolation and antimicrobial activity[J].Biochemistry,1964,3(3):424-426
[11]Burkhardt H J,Maizel JV,Mitchell H K.Avenacin,an antimicrobial substance isolated from Avena sativa.Ⅱ.Structure[J].Biochemistry,1964,3(3):426-431
[12]Bahraminejad S,Asenstorfer R E,Riley I T,et al.Analysis of the antimicrobial activity of flavonoids and saponins isolated from the shoots of oats(Avena sativa L.)[J].Journal of Phytopathology,2008,156:1-7
[13]Sørensen H P,Madsen L S,Petersen J,etal.Oat(Avena sativa)seed extract as an antifungal food preservative through the catalytic activity of a highly abundant class I chitinase[J].Applied Biochemistry and Biotechnology,2010,160:1573-1584
[14]洪庆慈,王梅,姜伟,等.燕麦中主要甾醇的鉴定和效能试验[J].食品科学,2002,23(1):103-106
[15]乌汉其木格.裸燕麦麸皮中β-谷甾醇的分离提取及其特性研究[D].呼和浩特:内蒙古农业大学,2007
[16]李昌灵,沈廷.刺天茄提取物的抑菌作用研究[J].安徽农业科学,2009,30(2):652-667
[17]孙石磊,姚卫蓉.杨梅果实不同溶剂提取物抑菌特性的研究[J].中国微生态学杂志,2009,21(3):229
[18]Jian-guo Xu,Cheng-rui Tian,Qing-ping Hu,et al.Dynamic changes in phenolic compounds and antioxidant activity in oats(Avena nuda L.)During steeping and germination[J].Journal Agricultural and Food Chemistry.2009,57:10392-10398.
Study on the Antimicrobial Effect of Oat Seeds Extracts during the Germination
Hu Qingping1Xu Jianguo2
(College of Life Science,Shanxi Normal University1,Linfen 041004)
(Department of Food Science and Engineering,Shanxi Normal University2,Linfen 041004)
Taking oat(Avena nuda L.)seeds as subject,Paper-disc and double dilution as methods,antibacterial activity of different solvents(water,methanol,acetone and ethyl acetate)from oat and the Minimal Inhibitory Concentration(MIC)of ethyl acetate extract on four food corruption bacteria were investigated.The results showed that the inhibition of ethyl acetate extract on bacteria was better than other solvents extracts.But the antibacterial activity was changing in the germination of oat seeds.If oat seed was germinated for 24 h,the ethyl acetate extracts had the strongest antibacterial activity on four bacteria,about(22.31±0.05)mm of inhibition diameter against Escherichia coli.The Minimal Inhibitory Concentration(MIC)on Staphylococcus aureus and E.coli were less than 6.25%.However,MIC on Salmonella typhimurium and Salmonella enteritidis were less than 12.5%.This paper provides theoretical references for the comprehensive utilization of oat and development of new type of natural antiseptic.
oat seed,germination,antibacterial activity
TS201.3
A
1003-0174(2012)06-0027-04
时间:2012-05-31 16:46
网络出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20120531.1646.004.html
国家自然科学基金项目(31071722),中国博士后基金(2011M501444),山西省优秀人才支撑项目(晋教科[2011]4号),山西省软科学(2010041031-02)
2011-10-12
胡青平,女,1972年出生,副教授,博士,应用微生物
徐建国,男,1971年出生,副教授,博士,植物资源开发利用

