1560例恶性实体肿瘤患者贫血状况分析
姜 慧,杨 雷,白 欧
(吉林大学第一医院 肿瘤中心,吉林 长春130021)
肿瘤相关性贫血(cancer related anemia,CRA)是指由肿瘤本身或经治疗后引起的贫血,为恶性肿瘤常见的伴随疾病之一。CRA与肿瘤患者的低体能状态明显相关,可严重影响生存时间与生活质量。研究表明恶性肿瘤患者贫血最高发病率达67%[1]。肿瘤相关性贫血的发生涉及多种因素,主要与肿瘤的自身因素(失血、溶血、骨髓受侵)以及治疗因素(手术、放疗、化疗)密切相关[2]。本文回顾性分析2010.1.1-2010.12.31期间,吉林大学第一医院住院的未经治疗的1560恶性实体肿瘤患者的年龄、性别、贫血发生率、贫血性质、贫血程度、以及与肿瘤类型的相关性等,报告如下。
1 对象与方法
1.1 病例入选标准 病理诊断为恶性实体肿瘤;未接受手术、放疗、化疗、输血等治疗;既往无其他恶性肿瘤病史;无良、恶性淋巴造血系统疾病导致的血细胞减少。
1.2 贫血分级与分类 分别依据美国国立肿瘤研究所(National Cancer Institute,NCI)贫血分级标准[2]以及全国高等学校教材内科学第7版贫血的细胞学分类标准[3]。
1.3 数据收集 详细查阅恶性实体肿瘤病人1560例,记录首次治疗资料。包括一般资料:性别、年龄;临床资料:肿瘤类型、贫血症状体征;化验检查:血常规、铁代谢、叶酸、维生素B12、促红细胞生成素(EPO)、溶血常规;治疗情况。
1.4 统计学分析 应用SPSS13.0统计软件进行数据处理。计量资料用±s表示,两组间均数比较采用t检验;计数资料采用χ2检验。P<0.05为差异有显著性意义。
2 结果
2.1 不同类型恶性实体肿瘤伴贫血病例构成比1560例恶性实体肿瘤男724例,女836例。不同类型恶性实体肿瘤病例数及构成比分别为:消化系统肿瘤525例(33.7%);乳腺癌385例(24.7%);肺癌275例(17.6%);泌尿系肿瘤198例(12.7%);妇科肿瘤111例(7.1%);头颈部肿瘤61例(3.9%);黑色素瘤5例(0.3%)。伴贫血恶性实体肿瘤293例,各类型恶性实体肿瘤伴贫血的病例数以及构成比分别为:消化系统肿瘤180例(61.4%);肺癌37例(12.6%);妇科肿瘤22例(7.5%);泌尿系肿瘤19例(6.5%);因头颈部肿瘤、黑色素瘤分别占很低比例,所以合并为其他肿瘤11例(3.8%),如图1。
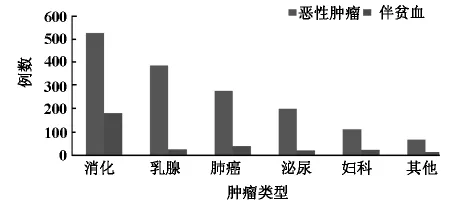
图1 1560例不同类型恶性实体肿瘤伴贫血构成比
2.2 不同类型恶性实体肿瘤伴贫血发生率(表1)
1560例恶性实体肿瘤伴贫血293例,发生率为18.8%。其中消化系统肿瘤伴贫血发生率最高达34.3%,显著高于总体发生率(18.8%),差异有显著(P<0.05)。乳腺、泌尿系肿瘤伴贫血发生率明显低于总体发生率,差异具有显著性(P<0.05)。伴贫血的恶性肿瘤类型中,60%以上是消化系统肿瘤,其次是肺癌。乳腺、泌尿、妇科肿瘤均低于10%。
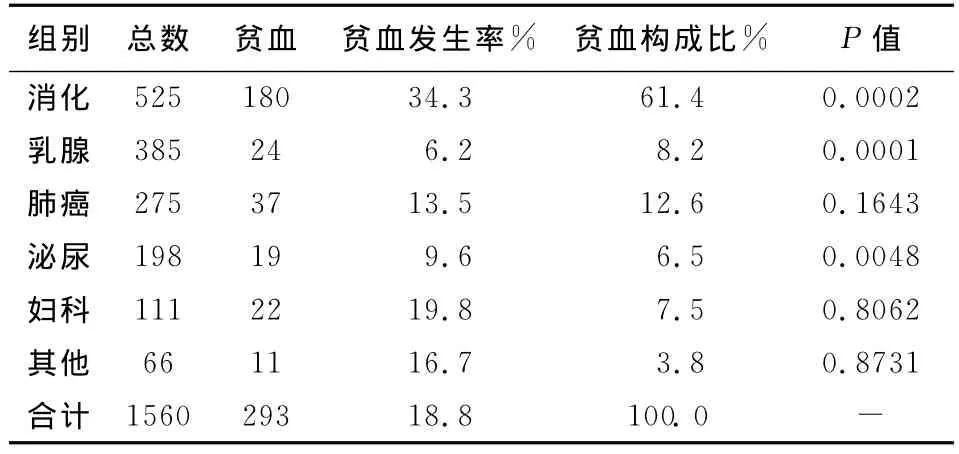
表1 不同类型恶性实体肿瘤伴贫血的发生率及构成比
2.3 不同类型恶性实体肿瘤伴贫血的年龄、性别特点(表2) 与同期同类型恶性实体肿瘤无贫血病人相比,伴贫血肿瘤病人的年龄及性别特点为:乳腺、泌尿系肿瘤,伴贫血病人的平均年龄分别为67.0岁与67.5岁,显著高于不伴贫血病人(P<0.05);性别:消化系统肿瘤,男性病人伴贫血比例显著高于无贫血病人(P<0.05)。

表2 不同类型恶性实体肿瘤伴贫血的年龄、性别特征
2.4 不同类型恶性实体肿瘤伴贫血的严重程度分级(表3) 依据NCI贫血分级标准,对293例恶性实体肿瘤伴贫血病例进行贫血程度分级,结果见表3,35例3-4级贫血病人,妇科及消化系统肿瘤比例较高,分别为18.2%、14.4%。

表3 不同类型恶性实体肿瘤伴贫血的严重程度分级
2.5 不同类型恶性实体肿瘤伴贫血的细胞学分类(表4) 依据血常规中红细胞体积大小,对293例恶性实体肿瘤伴贫血的病人进行细胞学分类,结果为:正细胞性贫血258例,小细胞及大细胞性贫血分别为19例、16例。正细胞性贫血占总贫血88.0%,小细胞性贫血与大细胞性贫血分别为6.5%与5.5%。各种类型肿瘤伴贫血均以正细胞性贫血为主,均达80%以上。258例正细胞贫血中,消化系统肿瘤构成比最高,为60.5%。小细胞性贫血在消化系统肿瘤、妇科肿瘤中所占比例相对较高,分别为7.2%、9.1%,但均不足10%。
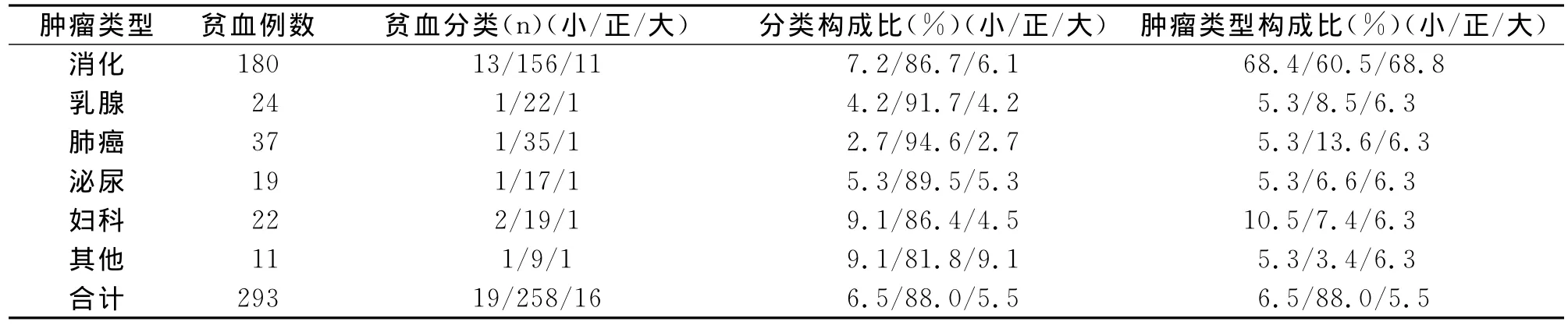
表4 不同类型恶性实体肿瘤伴贫血的细胞学分类特点(小/正/大细胞贫血)
2.6 恶性实体肿瘤伴贫血其它相关实验室检查一般情况,贫血病人,除检测血常规外,还需进行与贫血相关的其它实验室检测,如铁代谢、维生素B12叶酸、EPO、溶血检查、骨髓检查等。本文293例恶性实体肿瘤伴贫血的病人,258例I级贫血的患者均未进行其他相关检查。35例2-4级贫血病人,14例进行其它贫血相关检查,检查率为40%。分别为铁代谢5例,维生素B12叶酸4例,EPO水平1例、溶血检测2例,骨髓检测2例。
2.7 恶性实体肿瘤伴贫血接受治疗情况 1、2级恶性实体肿瘤伴贫血病人均未接受治疗。35例3-4级贫血病人,21例(60%)分别接受输血、补充铁剂等治疗。无应用EPO治疗患者。
3 讨论
3.1 恶性实体肿瘤伴贫血的发生率 我们的结果显示恶性实体肿瘤伴贫血的发生率为18.7%,明显低于欧洲癌症贫血调查(The European Cancer A-naemia Survey,ECAS)的结果(67%)[4]。原因可能为:①ECAS调查对象是包括造血系统恶性肿瘤在内的全部恶性肿瘤,本文仅为恶性实体肿瘤,不存在造血系统恶性疾病的影响;②ECAS的结果中包括接受手术、放疗、化疗的患者;本研究仅为初治,均未经手术、放疗、化疗等治疗,无手术导致失血、放化疗骨髓抑制等因素影响。进一步分析贫血与不同类型肿瘤的关系,消化系统肿瘤伴贫血发生率最高,与文献报道相一致[5]。与肿瘤易发生消化道出血等特点有关。不同类型恶性实体肿瘤中,乳腺癌伴贫血的发生率最低(6.2%),接近欧洲及国内7.2%-12.6%的研究结果[6]。
3.2 恶性实体肿瘤伴贫血患者年龄及性别特点研究表明,随年龄的增长,造血干细胞对EPO的抵抗增强。同时增加炎症因子释放,进一步增加造血干细胞对EPO的抵抗而导致贫血、或加重贫血[5]。我们结果显示,仅是乳腺癌、泌尿系统肿瘤伴发贫血的年龄明显高于无贫血患者,是否年龄与恶性实体肿瘤伴发贫血有关,尚不能明确。
另一方面,我们的分析结果显示,在消化系统肿瘤中,男性病人伴贫血比例显著高于无贫血病人。可能与肿瘤自身因素有关。文献报道在胃癌的发病人群中,男性比例显著高于女性为3:1,但尚未见肠道、胰腺等其他消化系统恶性肿瘤男女明显差别的报道。我们的结果显示,未见恶性实体肿瘤伴发贫血与年龄及性别存在确切相关性。
3.3 恶性实体肿瘤伴贫血的程度、性质分析 恶性实体肿瘤伴贫血以1-2级贫血为主,接近90%。提示未经治疗的恶性实体肿瘤伴发贫血基本为轻中度贫血,恶性实体肿瘤首发症状仍以本系统疾病症状为主,贫血为伴发症状,多在就诊检查时发现贫血。妇科肿瘤易发生中重度贫血,其原因主要与妇科肿瘤多以阴道流血症状为主,失血导致贫血较重。
恶性实体肿瘤伴发贫血的病人,约90%为正细胞性贫血,可能与肿瘤导致酶缺乏、肿瘤产生的炎性细胞因子破坏红细胞、以及肿瘤浸润出血失血等因素有关,临床表现为正常细胞性贫血[2]。一般情况,消化系统及妇科肿瘤易发生出血、失血,导致铁丢失,而发生小细胞性贫血。我们的结果显示,妇科及消化系统肿瘤中,小细胞性贫血比例相对较高。除失血丢失铁以外,铁利用障碍是恶性肿瘤伴发小细胞性贫血的另一主要原因[7]。恶性肿瘤通过激活免疫和炎性细胞因子(TNF、IL-1、IFN-γ),抑制 EPO的生成、储存铁的释放、红系祖细胞的增殖,从而参与恶性实体肿瘤伴发小细胞性贫血的发生机制[2]、[6]。
3.4 恶性实体肿瘤伴贫血的相关检测与临床治疗情况分析 恶性实体肿瘤伴发贫血患者,进行与贫血相关的实验室检测比率极低,主要原因是贫血程度较轻,无明显临床表现,伴随恶性肿瘤的治疗,贫血可以纠正,因此未进行其它检测及接受相关治疗。3-4级贫血患者,伴有临床症状,近半数病人进行相关检查,60%以上病人接受贫血治疗。目前CRA的治疗方法主要包括输血、补充铁剂、EPO等[8,9]。但EPO常见副作用为深静脉血栓形成,而恶性实体肿瘤常伴有高易栓症,因此,应用EPO类药物是否会影响伴有贫血的恶性实体肿瘤的生存期、无疾病进展时间等仍存在争议[10]。我国专家共识是恶性实体肿瘤不适合应用EPO类药物[2]。
不同类型的初治恶性实体肿瘤均可伴发贫血,消化系统肿瘤发生率最高。以轻中度正细胞性贫血为主。恶性实体肿瘤伴发贫血与年龄、性别未见确切相关性。
[1]Suthinee Ithimakin MD.Cancer Anemia Survey in Division of Medical Oncology at Siriarj Hospital(CAS)[J].J Med Assoc Thai,2009,92(Suppl2):S110.
[2]CSCO肿瘤相关性贫血专家委员会.EPO治疗肿瘤相关性贫血中国专家共识(2010-2011版)[J].临床肿瘤学杂志,2010,15(10):925.
[3]陆再英,钟南山.全国高等学校教材内科学[M].第7版.北京:人民卫生出版社,2008:567-570.
[4]M LV Jacober RL.Mamoni Anaemia in patients with cancer:role of inflammatory activity oniron metabolism and severity of anaemia12September 2006/Accepted:21December 2006/Published online:12June 2007.
[5]Pronzato P.Cancer related anaem ia m anagem ent in the 21st cen tu ry[J].Cancer Treat Rev,2006,32(Suppl 2):S1S3.
[6]Nowrousian MR.Recombinant human eryt hropoietin in the treatment of cancer related or chemot herapy induced anaemiain patients with solid tumours[J].Med Oncol,1998,15(Suppl 1):S192.
[7]林雪怡,陈志哲.恶性肿瘤与贫血[J].福建医药杂志,1984,1:049.
[8]Verbeke N,Beguin Y.High prevalence of anaemia and limited use of therapy in cancer patients:a Belgian survey(Anaemia Day 2008)[J].Support Care Cancer,2012,20(1):23.
[9]Fenner M H,Ganser A.Erythropoietin in cancer-related anemia[J].Curr Opi Oncol,2008,20(6):685.
[10]Calabrich A,Katz A.Management of anemia in cancer patients[J].Future Oncol,2011,7(4),507.

