HIF-1α和VEGF在子宫内膜异位症增生期内膜中的表达及意义
赵 洁,薛素萍,曲银娥*,王春红
(1.唐山市妇幼保健院 妇产科,河北 唐山063000;2.河北联合大学基础医学院)
子宫内膜异位症(内异症,Endometriosis,EMs)是生育期女性的常见病[1],HIF-1α(Hypoxia-inducible factor-1α)为核转录因子,介导细胞适应缺氧微环境,在大多数实体瘤中过表达,是肿瘤血管生成的始动环节。VEGF是血管生成中的关键性促进因子,是HIF-1α的靶基因之一。本研究采用免疫组织化学和 Western blot方法,研究 HIF-1α和VEGF蛋白在增生期的EMs异位及在位内膜组织和正常内膜组织中的表达,采用CD34标记微血管密度,探讨VEGF、HIF-1α及MVD之间的相关性,揭示HIF-1α和VEGF蛋白在EMs血管生成中的作用。
1 资料与方法
1.1 资料
选取2009年6月-12月就诊于唐山市妇幼医院、术后经病理检查证实为内异症的患者40例。取异位内膜组织40例,年龄24-53(33.8±4.3)岁,同时通过刮宫或切开手术取对应的在位内膜33例,年龄24-53(34.6±4.8)岁,对照组为同期因子宫肌瘤行子宫切除术的36例正常子宫内膜,年龄25-50(35.3±3.5)岁。根据月经周期及病理所见划分增生期和分泌期,所取内膜组织均为增生期。所有入选对象月经周期规律,术前3个月未应用激素治疗,无其它内外科及内分泌疾病。所有组织术后立即取材,部分液氮30min后-80℃保存,部分经10%甲醛固定,石蜡包埋,5μm连续切片,1张行常规HE染色,余者用于免疫组织化学染色。
1.2 方法
1.2.1 主要试剂 鼠抗人VEGF单克隆抗体为SANTA CRUZ公司产品,兔抗人HIF-1α单克隆抗体为Epitomics公司产品、兔抗人β-actin多克隆抗体为Sigma公司产品,鼠抗人CD34单克隆抗体、山羊血清、SP免疫组化试剂盒、DAB显色试剂盒均为北京中杉金桥生物技术有限公司产品。
1.2.2 SP法检测 HIF-1α和 VEGF蛋白 石蜡切片经二甲苯脱蜡,梯度酒精至水,SP法进行免疫组织化学染色,以0.01mol/L PBS缓冲液代替一抗作为阴性对照,用已知乳腺癌标本为阳性对照。
1.2.3 免疫组化阳性判断标准 HIF-1α和VEGF阳性信号为子宫腺上皮细胞胞质中出现棕黄色颗粒。通过Imageproplus图像分析软件,高倍视下选择10个视野,测定每张切片中阳性细胞的平均光密度(MOD)值,代表蛋白表达量。
CD34标记的微血管判定标准:根据 Weidner[2]方法,以与背景有明显区别的任何一个染成棕色的内皮细胞或细胞丛作为一个血管,分支结构只要不相连续也作为一个血管计数。先在低倍镜下选择微血管密度最多的区域,再转到×200倍率下计数3个视野的微血管数,取其平均值作为该例标本的MVD。
1.2.4 Western blot法检测内膜组织 HIF-1α和VEGF蛋白 将-80℃保存的异位内膜、在位内膜、正常内膜取出,加入组织裂解液后提取蛋白,BCA蛋白定量后上样30μg,SDS-PAGE电泳,半干转至PVDF膜,5%脱脂奶粉封闭2小时,TBST洗膜10 min,加入 VEGF、HIF-1α 一 抗,4℃孵育过夜,TBST洗膜3×10min,加入二抗室温孵育1-2小时,ECL显色,扫描图像经分析软件处理,结果与βactin蛋白表达水平相比较进行半定量分析。
1.3 统计学处理
所有数据以±s表示,应用SSPS16.0进行统计学处理,采用单因素方差分析及SNK法比较组间差异,指标间相关性采用Pearson相关分析。
2 结果
2.1 VEGF蛋白主要在子宫腺上皮细胞及血管内皮细胞胞质中表达,间质细胞胞质中也有散在表达。免疫组化及Western blot统计结果均显示:VEGF蛋白表达异位内膜高于在位内膜,而在位内膜高于对照组内膜,且各组之间比较差异均有统计学意义(见表1)。
表1 VEGF蛋白在各组内膜的表达情况(±s)
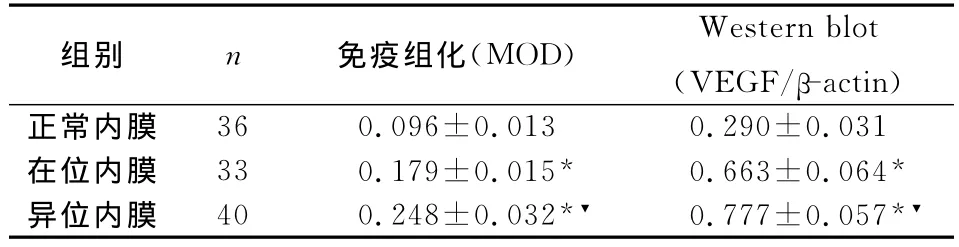
表1 VEGF蛋白在各组内膜的表达情况(±s)
注:与正常内膜比较*P<0.01;与在位内膜比较▼P<0.01
组别 n 免疫组化(MOD) Western blot(VEGF/β-actin)36 0.096±0.013 0.290±0.031在位内膜 33 0.179±0.015* 0.663±0.064*异位内膜 40 0.248±0.032*▼ 0.777±0.057*▼正常内膜
2.2 HIF-1α蛋白阳性反应为棕黄色颗粒,表达于子宫腺上皮细胞及间质细胞胞质,异位内膜高于在位内膜和对照组内膜,在位内膜高于对照组内膜,组间比较差异均有统计学意义,Western blot检测结果与免疫组化结果一致(见表2)。
表2 HIF-1α蛋白在各组内膜的表达情况(±s)

表2 HIF-1α蛋白在各组内膜的表达情况(±s)
注:与正常内膜比较*P<0.01;与在位内膜比较▼P<0.01
组别 n 免疫组化(MOD) Western blot(HIF-1α/β-actin)48 0.074±0.012 0.235±0.029在位内膜 40 0.139±0.014* 0.645±0.058*异位内膜 56 0.189±0.026*▼ 0.718±0.057*▼正常内膜
2.3 CD34定位于血管内皮细胞胞质,呈棕黄色,异位内膜、在位内膜和正常内膜组织的间质中均有表达。异位内膜、在位内膜和正常内膜组织中MVD值分别为104.19±9.10、76.80±7.86和44.07±4.97,两两比较差异均有统计学意义(P<0.05)。
2.4 异位内膜组织中VEGF、HIF-1α蛋白与 MVD Pearson相关分析显示,异位内膜组织中VEGF与HIF-1α、VEGF与 MVD及 HIF-1α与 MVD之间均存在正相关关系,差异均有统计学意义(r=0.972,P=0.000;r=0.903,P=0.000;r=0.890,P=0.000)。
3 讨论
EMs虽属良性疾病,但具有侵袭、扩散等恶性肿瘤的生长特征,而血管生成在肿瘤发生侵袭、转移的过程中发挥重要作用。VEGF是迄今发现的最强促血管生成因子之一,可特异性地与内皮细胞上的Flt-1/KDR受体结合,刺激内皮细胞生长,直接参与血管生成;也可诱导内皮细胞表达MMPs等多种组织蛋白酶和组织因子,降解细胞外基质,有利于内皮细胞迁移和浸润,诱导血管生成。推测在内异症发生发展过程中,一方面VEGF增多,通过降解细胞外基质、削弱基质的屏障作用,使新生血管基底膜缺损加重,促进血管生长,利于异位内膜的种植、存活;另一方面异位内膜的生长可表达更多的VEGF,又进一步促进血管增生,形成了一种恶性循环。在内异症裸鼠模型中,外源性VEGF能促进内异症病灶发生,而VEGF中和抗体或可溶性受体则可阻止种植灶形成,提示子宫内膜在异位种植需要新生血管提供营养[3,4]。Lu XE等[5]发现,从 EMs患者异位内膜移植到小鼠腹腔内的病灶,VEGF和 MMP-2的表达显著高于对照组,VEGF和 MMP-2可能会加速EMs的早期阶段形成。
HIF-1α是一种介导细胞适应缺氧环微环境的关键性转录调控因子,该因子可以调节一系列基因和蛋白参与肿瘤的恶性转化。HIF-lα在子宫内膜癌[6]等多种肿瘤组织中过表达,提示肿瘤发生的全过程普遍存在缺氧现象并可诱导HIF-lα蛋白表达。HIF-1α作为低氧应答时血管生成的主要的正性调节因子,可在上游基因水平调控VEGF等多种血管生成相关因子的表达,直接参与血管生成的调控。在内异症发生的初期,由于新生血管没有形成,缺乏相应的血液供应,必然会出现缺血、缺氧状态,因此HIF-1α被大量激活。研究表明,异位内膜 HIF-lα蛋白表达高于正常内膜,提示HIF-lα的激活可能与内异症的发病密切相关[7]。张翠敏等[8]发现 HIF-lα在内异症异位内膜及在位内膜表达均高于正常内膜,但与r-AFS无关,提示HIF-1α在内异症早期缺氧状态下高表达,而一旦新生血管形成,缺氧状态得到改善,则 HIF-1α表达不再增加,表明 HIF-1α可能与内异症发生有关,而与内异症发展关系不大。
CD34为常用的血管内皮细胞标记物之一,显示血管内皮细胞时,其特异性高于VⅢ因子和CD31,且CD34抗体检测所得MVD与患者的生存时间最具相关性。宋炯等[9]用免疫组化方法研究发现直肠癌组织中HIF-1α、VEGF蛋白表达和 MVD明显高于正常对照组,且 HIF-1α、VEGF与 MVD的表达呈显著正相关。我们研究发现,异位症异位内膜组织VEGF、HIF-1α蛋白及MVD均高于在位内膜和正常内膜,且VEGF、HIF-1α蛋白与 MVD呈正相关关系,与国内外大多数学者[10,11]的研究结果一致。推测HIF-1α在内异症早期的缺氧微环境中被激活,上调VEGF蛋白表达,通过降解细胞外基质等机制诱发了新生血管的生成,促进内异症异位内膜的黏附和侵袭。然而新生血管结构不完善,如周细胞少、基膜薄、细胞间缺乏紧密连接等,易发生渗漏和出血,不但不能改善组织缺氧,反而诱发更多的生长因子和新生血管形成,促进内异症的进一步发展。因此,HIF-1α与VEGF可能协同作用,共同促进了内异症的血管生成。本研究果还发现,内异症在位内膜组织中VEGF、HIF-1α蛋白及 MVD高于正常对照组,提示内异症在位内膜的生物学特性不同于正常内膜,发生了微观改变。
[1]齐 漩,辛晓燕.基质金属蛋白酶及其抑制剂与子宫内膜异位症[J].国外医学·妇幼保健分册,2002,13(1):14.
[2]Weidner N,Folkman J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic indicator in early-stage breast carcinoma[J].Natl Cancer Inst.1992,84(24):1875.
[3]Grummer R,Schwarzer F,Bainczyk K,et al.Peritoneal endometriosis:validation of an in-vivo model[J].Hum Reprod,2001,16(8):1736.
[4]蒋红清,刘亚杰,李亚里.血管内皮生长因子抗体对子宫内膜异位症小鼠皮下模型作用的实验研究[J].中国妇产科临床杂志,2008,9(6):453.
[5]Lu XE,Ning WX,Dong MY,et al.Vascular endothelial growth factor and matrix metalloproteinase-2expedite formation of endometriosis in the early stage ICR mouse model[J].Fertil Steril,2006,86(4):1175.
[6]Sivridis E,Giatromanolaki A,Gatter KC,et al.ssociation of hypoxia-inducible factors 1alpha and 2alpha with activated angiogenic pathways and prognosis in patients with endometrial carcinoma[J].Cancer,2002,95(5):1055.
[7]Beeker CM,Rohwer N,Funakoshi T,et al.2-Methoxyestradiol inhibits hypoxia-inducible factor-lαand supresses growth of lesions in a mouse model of endometriosis[J].Am Pathol,2008,172:534.
[8]张翠荣,张敬伟,王淑侠,等.FHIT和HIF-1α在子宫内膜异位症中的表达及意义[J].中国妇幼保健,2011,26(19):2987.
[9]宋 炯,刘 丰,傅仲学.缺氧诱导因子-1α、VEGF和 MVD在直肠癌中的表达及临床意义[J].实用肿瘤杂志,2004,19(4):314.
[10]Di Carlo C,Bonifacio M,Tommaselli GA,et al.Metalloproteinases,vascular endothelial growth factor,and angiopoietin 1and 2 in eutopic and ectopic endometrium[J].Fertil Steril,2009,91(6):2315.
[11]刘晶华,冷维春,刘俊宝,等.MIF和VEGF在子宫内膜异位症组织中的表达及临床意义[J].中国实验诊断学,2010,14(9):1405.

