基于液滴微流控芯片的单细胞分离
洪龙烨,郭峰,国世上,赵兴中
(武汉大学物理科学与技术学院,人工微结构教育部重点实验室,湖北 武汉 430072)
微流控芯片(又称微全分析系统或芯片实验室),现在已经广泛用于化学合成、生物化学分析、药物筛选、DNA测序等领域.微流控系统能够将几乎整个化学室的功能,包括采样、稀释、进样、反应、分离和检测等集成在可重复使用的微芯片上,具有高通量、高灵敏度、低试剂量消耗、无交叉污染、反应速度快和易于集成化等诸多优点[1].生物系统是非常复杂的,即使是同类的细胞彼此之间也是千差万别的.针对单个细胞的差异性的分析试验中,单细胞操控将是关键问题.高效的单细胞操控技术往往成本比较昂贵,在常规实验中难以实现.比如,临床肿瘤样本总是细胞总量少,但又极具研究价值.所以如何将其收集并进行有效的单细胞的分析是一个很有科学价值和挑战性的课题[2-3].
目前流式细胞仪(flow cytometry)已经被广泛地应用于细胞分离和检测,其可以对104以上数量的细胞进行有效的操作.但是流式细胞仪昂贵,体积庞大,需要专门技术人员操作,很难在医院和实验室进行广泛的应用.微流控芯片具成本低廉、体积微小、操作简单、样品消耗少等特点,可以更好地适合102~105细胞的操作和分离[4],可以非常好地克服上述局限,并可以实现类似仪器的小型化、集成化、便携带化和自动化.微流控芯片尺寸在微米级和细胞大小相当,非常适合用于细胞的物理操控以及相关生化反应操作[5].以微流控芯片为平台的细胞分离技术主要有两类:一是根据采集到信号(荧光、散射光或者阻抗)的有无或者强弱为判断标准施加外部操控措施进行筛选;二是按照细胞本身特定的物理化学特性(大小、介电常数)在不同电场驱动作用下进行筛选.美国加州理工大学的学者开发了一种基于荧光诱发细胞分选的微流控芯片,他们首先对待分选的细胞进行荧光标记,然后利用多层PDMS制作的微阀对以激光激发出的荧光信号的有无和强弱为检测信号来控制细胞流向,成功地实现了对表达和没有表达绿色荧光蛋白的大肠杆菌进行分选.光镊分选也可以用于激光诱导荧光激发细胞的分选.在这种细胞分选过程中,包在鞘流中的单个细胞在488 nm激光束的照射下,通过绿色荧光蛋白表达发出荧光,经光电倍增管转换为电信号进入计算机处理,当光强达到计算机所设范围时,近红外激光启动光镊作用,细胞流动方向发生偏转,目标细胞流向收集通道,非绿色荧光蛋白表达的细胞则未受到光镊的作用而流向废液通道[6].Gwards等设计了一种用PDMS和玻璃芯片制作的集成化细胞分选芯片,通过检测不同细胞阻抗值的变化来实现分选[7],在玻璃芯片内利用高分子化合物作为盐桥,当细胞通过盐桥时,引起阻抗响应变化,这种变化与细胞大小有关,因此可以用于人的红细胞和白细胞的分选.当然还有磁力分选法,将特定的细胞表面抗原与包被在磁球上的特异性抗体结合,在外磁场作用下,含有特异性抗原的细胞会被吸附而停留在磁场中[8].
以上的实验和操作多是在鞘流或有沟道的微流体芯片中进行的,与之相对比,液滴微流控芯片具有通量高、高灵敏度、无交叉污染、方便集成等特点,其为我们进行细胞操控和分析提供了一个强有力的平台[3-4],很多技术有如光[9]、声[10]、机械阀[11-12]、流体动力、磁[13]、电[4,14-17]等已经应用到基于液滴微流控芯片的单细胞操控中.相对于以上的物理手段,电学方法有步骤简单、操作力强、无需特异性的标记、反应迅速等优点.我们发展了一种利用静电作用力和流体动力相结合的将单细胞分离形成微液滴并富集的方法.在实验室前期对微液滴的研究中,我们惊奇地发现在对通常利用的流聚焦沟道产生的微量液滴未有任何其他额外操作的情况下,微量液滴表现出“自带电”的独特行为,并对微液滴的带电量进行了进一步研究[17].受此启发,我们通过集成微电极的方法对包裹有单细胞的微液滴进行分离和筛选,改善了传统液滴微流控技术收集单细胞液滴较少的问题.
1 实验设计原理
在本文中,我们应用带有流聚焦沟道的微流控芯片来制备微液滴.连续相(油相)由左侧的孔注入到芯片,分散相(水相)由左侧第二个孔进入到芯片.水相被油相在十字型流聚焦缩口处被油相的剪切力夹断,形成连续的液滴.当微电极上没有作用直流电压时,所有的微液滴流动到流体阻力较小的左侧的出口中.当微电极作用上直流电压,微液滴将受到静电作用力的影响,全部被引导流向右侧的废物通道;随着短时间内停止直流电压,含有单细胞的微液滴将只受到流体动力流向左侧的收集通道,如图1(a)所示.
2 微流控芯片制作
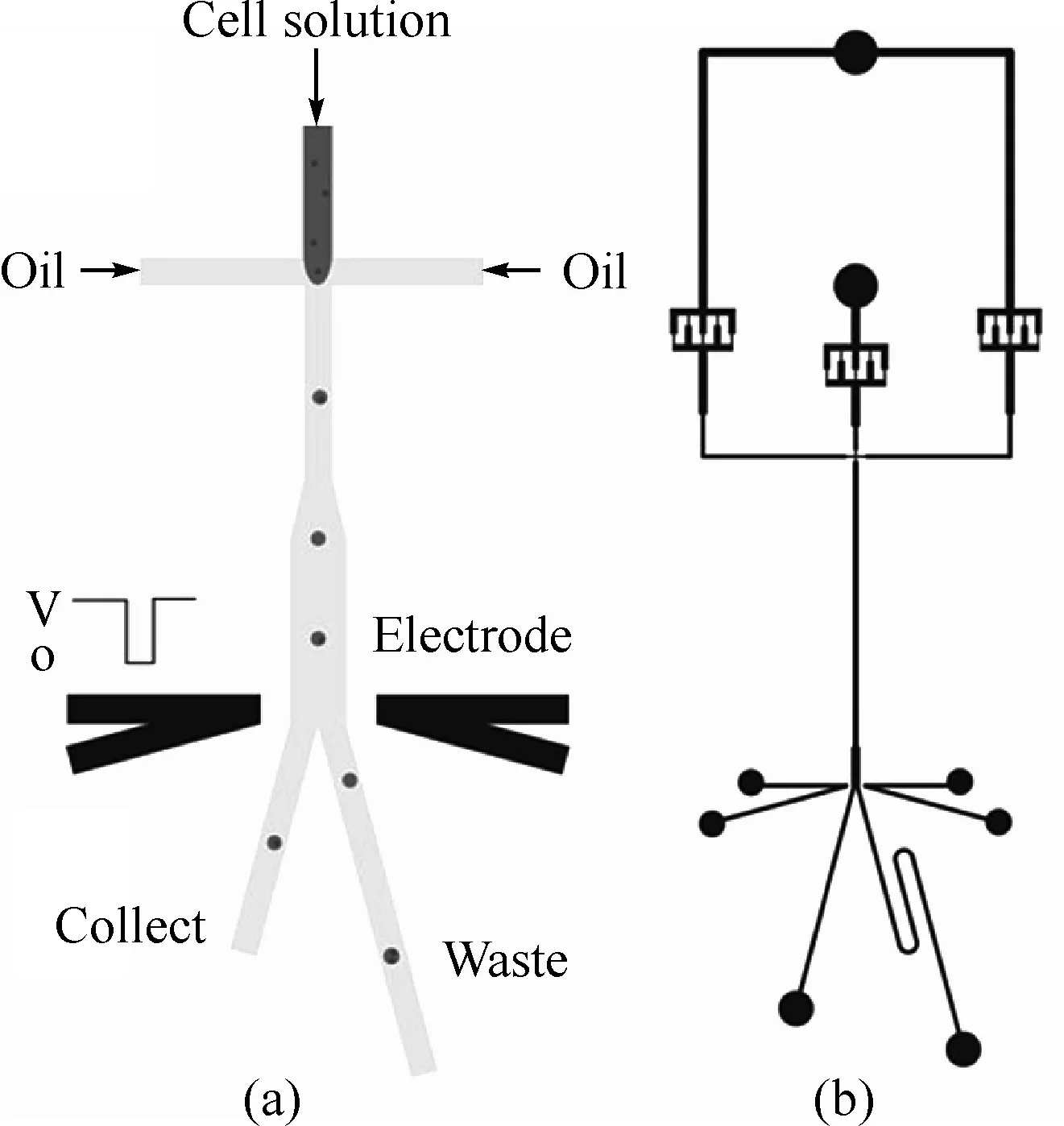
图1 (a)单细胞被封进装液滴以及液滴分离进入收集通道的示意图 (b)基于微流控芯片设计图
微流控芯片设计如图1(b)所示,用标准光刻技术加工制备微流体芯片并将微电极用银浆灌注方法集成于芯片中.我们先利用CorelDraw软件设计出实验所需图样,再交由专业打印机构精确打印,从而得到掩膜.清洗好硅片后,在其表面均匀涂上一层黏性好、厚度适当的光刻胶后,进行曝光.将掩模置于光源与光刻胶之间,用紫外线等透过掩膜对光刻胶进行选择性照射.在光照到的地方,光刻胶发生化学反应,从而改变感光部位胶的性质.把此曝光过的基片用显影液除去应去掉的部分光刻胶,获得与掩模相同(正光刻胶)或相反(负光刻胶)的图形.在我们的实验中,采用的是AZ50正光刻胶,把显影完的基片清洗后,在一定温度下烘烤一段时间.在此光刻好的模板上浇注PDMS(聚二甲基硅氧烷)静置0.5 h以上,使气泡在重力作用下逸出.再将硅片放入电热恒温箱烘烤固化,进行切片,便得到了我们实验所设计的PDMS基片.按实验所设计图样用空心管切割法对PDMS基片打孔,和玻璃片一起经过氧等离子处理,使得PDMS基片与洁净的玻璃盖片较好地键合在了一起,然后置于80 ℃的烘箱中烘烤两到三天使芯片内管道壁具有疏水性.最后再将银浆灌注到事先切割好的PDMS槽中制成微电极.至此我们便制得了实验所需的微流体芯片.
3 实验操作和结果分析

图2 单细胞微液滴的形成

图3 (a)无细胞的微液滴或含有多个细胞的微液滴在静电力的作用下直接进入废物通道;(b)单细胞微液滴通过一个10 ms直流电压的停顿被分离出来.
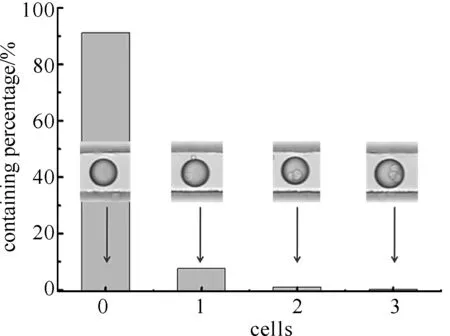
图4 微液滴内细胞数目的数据图
3.1实验操作步骤把2×106细胞配置在在1 mL PBS缓冲液中,将其以1∶1比例和3%的海藻酸钠溶液相混合,充分混匀后作为分散相;把悬浮有细胞的海藻酸钠溶液作为连续相分别加入到1 mL 注射器内,并在针头上接好软管,然后装配到注射泵上;把芯片固定在显微镜的载物台上;之后,将针头上的软管与芯片入口处的金属管对接;调节注射泵流速,待油水两相交汇并稳定后,利用显微镜上的CCD进行拍摄.图2所示即为通过CCD拍摄的单细胞微液滴的形成过程.通过控制油相和分散相的流速可以很好地控制液滴的大小或者产生频率,通过控制细胞的密度来控制包裹在每个微量液滴中的细胞数量分布.
为了富集单细胞微液滴,用于筛选无细胞的海藻酸钠微液滴、含有多个细胞的海藻酸钠微液滴进入右侧废物通道的直流电压达到400 V.在显微镜的观察下,通过停止直流电压一个较短时间(相当于一个瞬间的低电压脉冲),单细胞微液滴在流体动力的作用下直接进入左侧收集通道,如图3(a)、3(b)所示.
3.2结果分析和讨论无细胞的海藻酸钠微液滴、含有单细胞的海藻酸钠微液滴、含有2个细胞的海藻酸钠微液滴以及含有多个细胞的海藻酸钠微液滴的数量比例如图4所示.如图所示,流聚焦方法得到的含有单细胞的海藻酸钠微液滴不到总液滴数的10%.采用此种方法得到的含有单细胞的微液滴,在细胞悬液充分打散无团聚的情况下,液滴中的细胞数目和其微液滴数是按泊松分布的,其中含单细胞的微液滴数较少.本实验,正是通过电分选的方法将这种数目较少的含有单细胞的微液滴筛选收集起来,从而达到富集的效果.
对于微液滴表现出的“自带电”的独特行为,由于微量液滴体积微小,不便于观察操作,直接测量电学性质相对还是比较困难的,因此到目前也没有得出普遍接受的结论,猜测微量液滴带电的原因可能是感应带电,或者由微滴与油流之间电子与离子的转移带电,或是两者同时作用.如图3所示实验结果表明通过这种电学操控方法可以有效地筛选单细胞微液滴,并富集由流聚焦沟道产生的较少的单细胞微液滴,大大改善了传统液滴微流控技术收集单细胞液滴较少的弊端.
4 结论
流聚焦结构的微流控芯片提供了一种单分散性微液滴形成的方式.从上述实验结果中可以看到,这种结合了流体动力的单细胞微液滴收集方法将会成为一种简单有效的单细胞操控分析平台;并且这种方法相比于直接用电筛选的方法,细胞更不易受到影响和破坏,从而将获得细胞存活率较好的单细胞微液滴,更有利于后期有效的单细胞分析.
[1] 林炳承,秦建华. 微流控芯片实验室[M]. 北京:科学出版社,2006:1-11.
[2] Schaerli Y, Hollfelder F. The potential of microfluidic water-in-oil droplets in experimental biology[J]. Molecular Biosystems, 2009, 5(12):1392-1404.
[3] Sims C E, Allbritton N L. Analysis of single mammalian cells on-chip[J]. Lab Chip, 2007, 7(4):423-440.
[4] Baret J C, Miller O J, Taly V, et al. Fluorescence-activated droplet sorting (FADS):efficient microfluidic cell sorting based on enzymatic activity[J]. Lab Chip, 2009, 9(13):1850-1858.
[5] El-Ali J, Sorger P K, Jensen K F. Cells on chips[J]. Nature, 2006, 442(7101):403-411.
[6] Wang M M, Tu E, Raymond D E,et al. Microfluidic sorting of mammalian cells by optical force switching[J]. Nat Biotech, 2005, 23(1):83-87.
[7] Gawad S, Schild L, Renaud P. Micromachined impedance spectroscopy flow cytometer for cell analysis and particle sizing[J]. Lab Chip, 2001, 1(1):76-82.
[8] Furdui V I, Harrison D J. Immunomagnetic T cell capture from blood for PCR analysis using microfluidic systems[J]. Lab Chip, 2004, 4(6):614-618.
[9] He M Y, Edgar J S, Jeffries G D M, et al. Selective encapsulation of single cells and subcellular organelles into picoliter and femtoliter-volume droplets[J]. Anal Chem, 2005,77(6):1539-1544.
[10] Franke T, Abate A R, Weitz D A, et al. Surface acoustic wave (SAW) directed droplet flow in microfluidics for PDMS devices[J]. Lab Chip, 2009, 9(18):2625-2627.
[11] Zeng S J, Li B W, Su X O, et al. Microvalve-actuated precise control of individual droplets in microfluidic devices[J]. Lab Chip, 2009, 9(10):1340-1343.
[12] Guo F, Liu K, Ji X H, et al. Valve-based microfluidic device for droplet on demand operation and static assay[J]. Appl. Phys. Lett., 2010, 97(23):233701.
[13] Zhao L B, Pan L, Zhang K, et al. Generation of Janus alginate hydrogel particles with magnetic anisotropy for cell encapsulation[J]. Lab Chip, 2009, 9(20):2981-2986.
[14] Ahn K, Kerbage C, Hunt T P, et al. Dielectrophoretic manipulation of drops for high-speed microfluidic sorting devices[J]. Appl Phys Lett, 2006, 88(2):024104.
[15] Fidalgo L M, Whyte G, Bratton D, et al. From microdroplets to microfluidics:selective emulsion separation in microfluidic devices[J]. Angew Chem, Int Ed, 2008, 47(11):2042-2045.
[16] Link D R, Grasland-Mongrain E, Duri A, et al. Electric control of droplets in microfluidic devices[J]. Angew Chem, Int Ed, 2006, 45(16):2556-2560.
[17] Guo F, Ji X H, Liu W, et al. Droplet electric separator microfluidic device for cell sorting[J]. Appl Phys Lett, 2010, 96(19):193701.

