固相微萃取联用气相色谱测定水中的多环芳烃
胡庆兰
(湖北第二师范学院化学与生命科学学院,湖北 武汉 430205)
多环芳烃(PAHs)是一组稠环芳香化合物,主要是由于有机物(如煤和木材等)在高温下不完全燃烧产生的[1-2].PAHs广泛存在于大气、水、土壤和植物等自然环境中[3].其中萘、苊等16种PAHs因具有致癌、致畸及致突变性而被美国环境保护局(EPA)列入优先控制和监测的有毒有机污染物黑名单中,国家环境保护总局也把16种PAHs作为检测对象[4].
环境中PAHs存在的浓度很低,通常须经过预处理后才能进行分析.现多采用液-液萃取,该方法操作较烦琐、费时,且需大量使用对人体有害的有机溶剂.固相微萃取(SPME)技术是20世纪90年代发展起来的一种新型的样品预处理技术.操作过程无需使用有机溶剂[5],且受基体影响小,集采样、浓缩于一体,克服了传统的样品前处理技术的缺点,是一种有利于环境保护的样品预处理方法.
目前对环境中多环芳烃的分析有高效液相色谱法[6-8],气相色谱法[9-10]等.由于PAHs大多是分子量大、不易被气化的化合物(高沸点),而且这类化合物在紫外或荧光检测器上具有相当灵敏的响应,故环境中多环芳烃的分析大多采用高效液相色谱法的方法.而高效液相色谱法分析PAHs样品预处理时间长;罗世霞等采用SPME与气相色谱法(GC)联用,选用100 μm PDMS的商用涂层分析饮用水中的16种PAHs,线性范围为0.01~30 μg/L[11];张廉奉等用自制涂层测定了土壤中的PAHs,线性范围为3个数量级,检出限为0.008~0.440 μg/L[9].目前用SPME-GC分析PAHs的涂层主要是商用涂层及自制涂层.商用涂层种类少,且存在着热稳定性差和使用寿命短及价格贵等缺陷,涂层与纤维之间是通过物理作用吸附的;本研究选用固相微萃取联用气相色谱,并采用溶胶-凝胶法制备纤维表面键合的离子液体键合SPME涂层.该涂层热稳定性好,涂层与纤维之间形成化学键合的三维空间网络结构,适宜于高沸点的化合物的分析.并对萃取温度、萃取时间及离子强度等进行了优化.在最优化的条件下,采用HS-SPME-GC对水中的5种多环芳烃进行了分析,结果令人满意.
1 实验部分
1.1仪器和试剂GC-9710气相色谱仪(福立分析仪器有限公司,配有FID检测器);KQ-50B型超声波清洗仪(昆山市超声有限公司);XT-1氮氢空气发生器(北京信和诚科技发展有限公司);固相微萃取手柄(Supelco公司);纤维(140 μm.o.d,河北永年光纤厂);DF-101S智能集热式恒温加热磁力搅拌器;自制离子液体键合固相微萃取涂层(厚度为50 μm,萃取头长度为1 cm),四乙氧基硅烷(98%)、二苯基二甲氧基硅烷(DDS)、含氢硅油(PMHS)购于武汉大学有机硅新材料股份有限公司;端羟基硅油(OH-TSO,成都硅树脂研究中心)使用前均未做任何处理;甲醇、氯化钠、Naphthalene(萘)、Biphenyl(联苯)、Fluorene(芴)、Phenanthrene(菲)、Fluoranthene(荧蒽)均为分析纯,购于中国医药上海化学试剂公司,已处理的离子液体(本室合成).
标准储备溶液的配制:分别准确称取萘,联苯,芴,菲及荧蒽各10 mg,置于10 mL容量瓶中,用溶剂甲醇稀释到刻度,摇匀,得到浓度为1.0 g/L的混标溶液,保存于冰箱中(4 ℃).使用时根据需要用甲醇稀释成所需浓度.
1.2色谱条件HP-5毛细管色谱柱(30 m×0.32 mm i.d×0.25 μm),检测器温度300 ℃,进样口温度280 ℃,程序升温条件:初温80 ℃,保持2.0 min,以15 ℃/min升至250 ℃,保持2.0 min;以N2为载气,线速度为20 cm/s, 尾吹气流速为45 mL/min.,不分流进样.
1.3 实验方法
1.3.1 自制涂层 石英纤维先经硫酸及氢氧化钠预处理.然后在1.5 mL聚乙烯离心管中加入离子液体、四乙氧基硅烷、含氢硅油、端羟基硅油及溶剂,经三氟乙酸(含水5%)催化水解,经溶胶-凝胶法发生缩聚反应形成化学键合的三维空间网络结构.离子液体在涂层中的含量为6%,且在460 ℃不分解.
1.3.2 SPME条件的优化 在25 mL顶空瓶中加入已处理过的磁子、一定量的氯化钠、10 mL蒸馏水和10 μL的多环芳烃混标溶液,盖上瓶盖,水浴恒温并以一定速度搅拌15 min后,萃取头插入瓶中的顶空部分进行萃取.一段时间后,拨出萃取头立即插入GC进样口(280 ℃),进行热解吸.优化条件包括萃取温度、萃取时间、离子强度等.
1.3.3 实际水样中多环芳烃的检测 采集武汉东湖中的水样,经检测,未检出5种多环芳烃.在最优化条件下,加入多环芳烃混标溶液配成10 μg/L的样品溶液进行回收率测试.
2 结果与讨论
2.1萃取温度的选择固相微萃取过程中,升高温度,使分子运动速度加快,从而加快待测物的扩散速度,提高分析速度;但萃取涂层的吸附是一个放热的过程,过高的温度会使分析物的分配系数下降,使萃取涂层对待测物的吸附能力降低.因此需要综合考虑温度对SPME萃取量的影响.图1为5种多环芳烃化合物的萃取量(以峰面积计)随着萃取温度的变化曲线.各个化合物的最佳萃取温度都有差异,在50~90 ℃,萘及联苯是随温度上升呈单边下降趋势;芴,菲及荧蒽随温度上升萃取量增加.综合考虑以上因素,本实验选取70 ℃为最佳萃取温度.
2.2萃取时间的影响萃取温度为70 ℃,保持其他条件不变,在20~60 min范围内,考察不同萃取时间对萃取量的影响.由图2可见,在20~50 min,5种化合物的萃取量随萃取时间的延长而增加,50 min后增加缓慢,故本实验选取50 min为其最佳萃取时间.
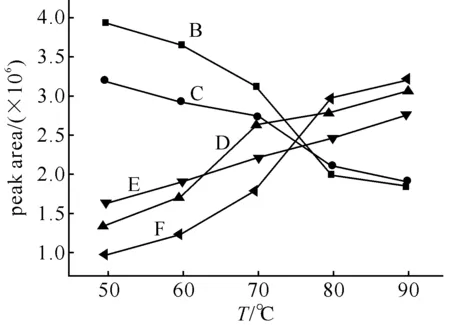
图1 萃取温度对萃取量的影响B:萘;C:联苯;D:芴;E:菲;F:荧蒽.
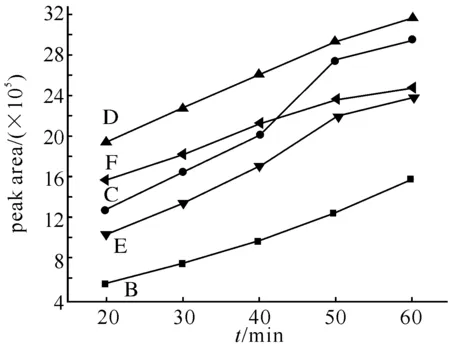
图2 萃取时间对萃取量的影响B:萘;C:联苯;D:芴;E:菲;F:荧蒽.
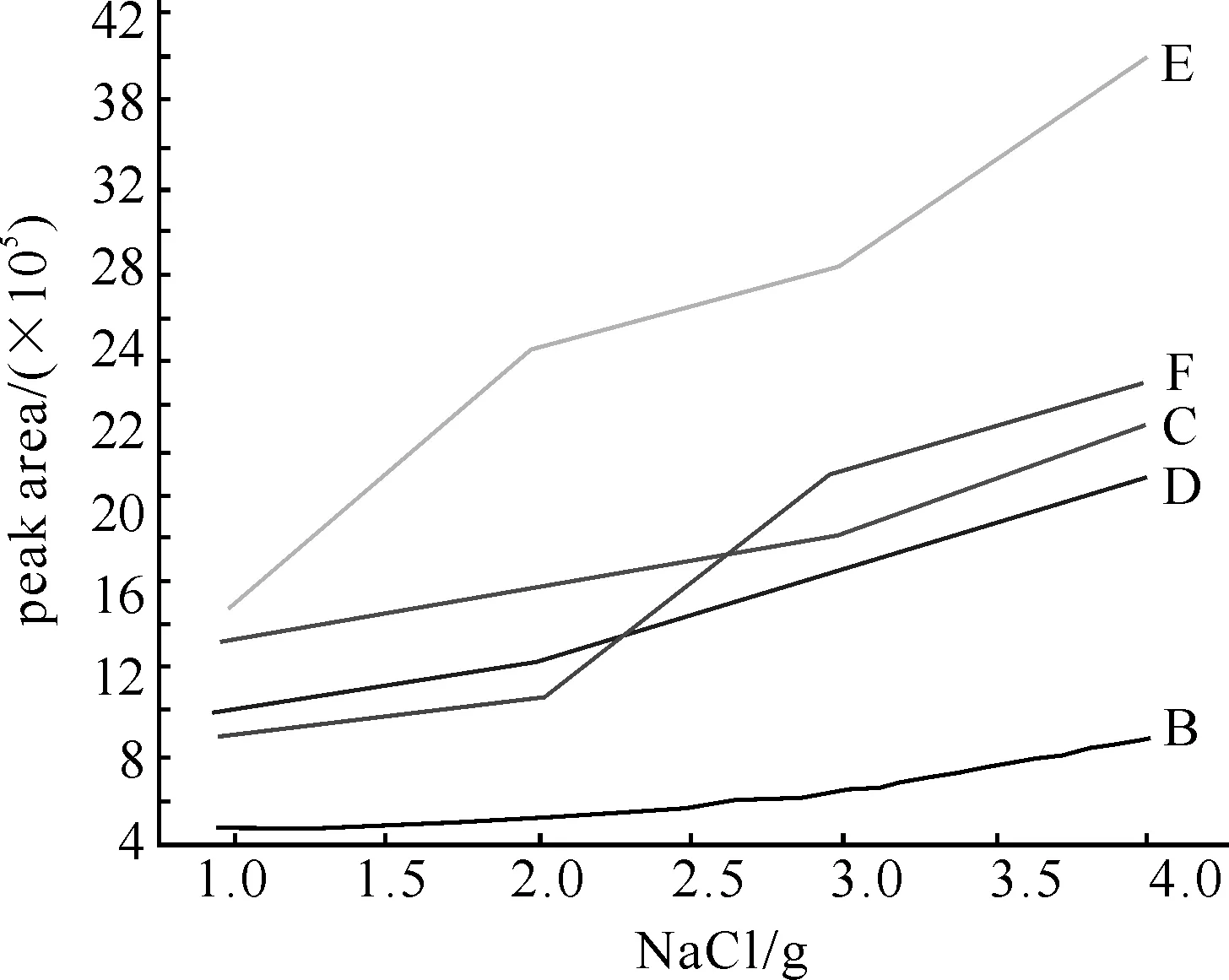
图3 NaCl用量对萃取量的影响B:萘;C:联苯;D:芴;E:菲;F:荧蒽.
2.3离子强度的影响在顶空固相微萃取中通常加入盐,增强分析物的离子强度,可降低多环芳烃在溶液中的溶解度,提高气液分配系数,并通过搅拌,加速气液间平衡,从而提高分析速度,使分析物尽可能多地进入气相被涂层所吸附,提高萃取量.萃取温度为70 ℃,萃取时间50 min,保持其他条件不变,试验离子强度对多环芳烃萃取量的影响.结果表明,在搅拌与饱和NaCl溶液条件下,萃取量最大.如图3所示.故实验选取加入4 g NaCl作为离子强度调节剂.
实验中还对解析温度及解析时间进行了优化,结果表明,在280 ℃下解析4 min,解析效果最好.通过实验得出SPME最优化条件为:70 ℃顶空萃取50 min,280 ℃下解析4 min,4 g NaCl,并以一定速度搅拌.
2.4方法的检出限、线性范围、相关系数、重现性配制0.01 μg/L、0.1 μg/L、1.0 μg/L、10 μg/L、100 μg/L、1 000 μg/L的多环芳烃化合物的混标溶液.在最优萃取条件下测得5种多环芳烃化合物的线性范围与线性相关系数、检出限(S/N=3)与精密度,并对10 μg/L溶液的5种多环芳烃化合物连续5次进行测定,结果列于表1中.表2将自制涂层与近几年文献报道的SPME涂层萃取多环芳烃的线性范围及检出限作对比,可以看出,自制涂层无论是线性范围还是检出限均比文献报道的要好.
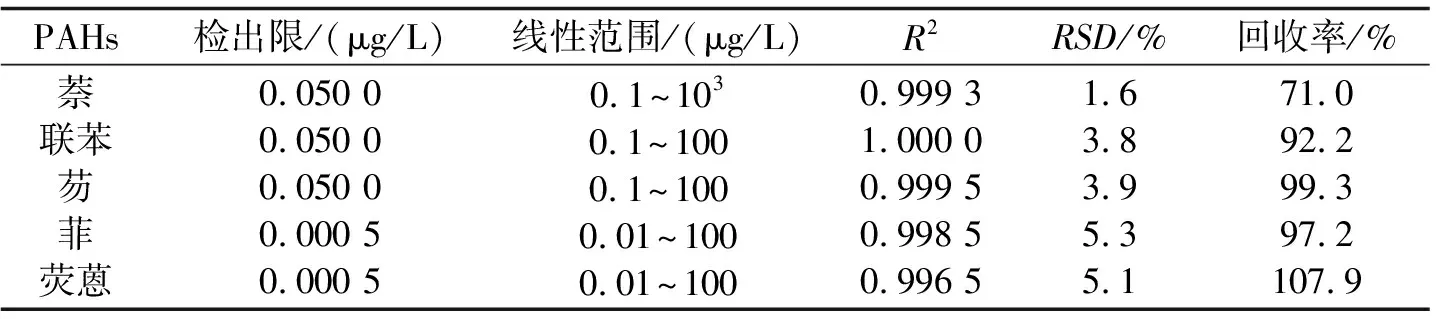
表1 多环芳烃化合物的检出限、线性范围和回收率(n=5)
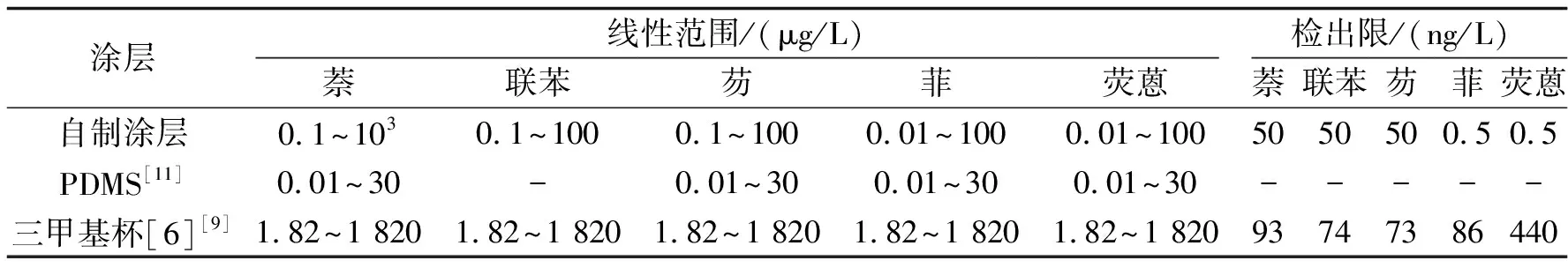
表2 自制涂层与文献报道的涂层萃取多环芳烃的线性范围及检出限的比较
2.5实际水样中回收率的测定从东湖采集500 mL水样,在最优条件下进行了HS-SPME-GC-FID测定,未检出5种多环芳烃化合物.然后向东湖水样中加入适量的混标溶液,得到10 μg/L的加标溶液,进行回收率实验,回收率为71.0%~107.9%,见表1.图4为实际水样加标前后的HS-SPME-GC色谱图.
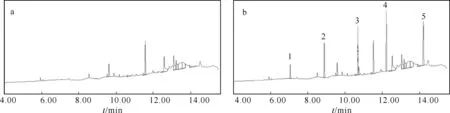
图4 实际水样(a)和实际加标水样(b)的HS-SPME-GC色谱图1:萘;2:联苯;3:芴;4:菲;5:荧蒽.
3 结论
本文采用顶空固相微萃取-气相色谱法(HS-SPME-GC)用自制溶胶-凝胶新型的离子液体键合固相微萃取涂层,对水中5种多环芳烃化合物进行了测定,并对萃取条件进行了优化.该方法的线性范围宽(3至4个数量级),检出限低(0.000 5~0.05 μg/L),重现性好(小于5.3%).用加标法对东湖水样中的多环芳烃进行了测定,回收率为71.0%~107.9%.
[1] Basheer C,Obhard J P,Keeiee H.Persistent organic pollutants in singapore,s coastal marine environment:Part I,sediments[J].Water,Air and Soil Pollution, 2003,149:315-323.
[2] Yang X P,Shi B F,Zhang Y H,et a1.Identification of polycyclic aromatic hydrocarbons(PAHs)in soil by constant energy synchronous fluorescence detection[J].Spectrochimica Acta: Part A,2008,69:400-406.
[3] 张玲金,苏建茹,周立军,等.固体模拟样品中多环芳烃有机污染物提取方法研究[J].岩矿测试,2003,22(2):113-116.
[4] 国家环境保护总局.全国土壤污染调查分析测试方法技术规定[S].2006.
[5] 刘俊亭.新一代萃取分离技术-固相微萃取[J].色谱,1997,15(2):118-119.
[6] 李茉,马继平,朱世文,等.竹炭固相萃取-高效液相色谱法测定河水中多环芳烃[J].分析试验室,2010,29(6):89-92.
[7] 饶竹,李松,何淼,等.高效液相色谱-荧光-紫外串联测定土壤中16种多环芳烃[J].分析化学,2007,35(7):954-958.
[8] 邓樱花,孙敏,侯汉娜,等.高效液相色谱法检测土壤中的5种多环芳烃[J].湖北大学学报:自然科学版,2010,32(4):454-457.
[9] 张廉奉,李秀娟,刘翠霞,等.三甲基杯[6]芳烃固相微萃取-气相色谱法测定土壤中的多环芳烃[J].分析化学,2007,35(9):1269-1273.
[10] Bordajandi Luisa R,Dabrio Marta,Ulberth Franz,et al.Optimisation of the GC-MS conditions for the determination of the 15 EU foodstuff priority polycyclic aromatic hydrocarbons[J].Journal of Separation Science, 2008,31(10):1769-1778.
[11] 罗世霞,朱淮武,张笑一.固相微萃取-气相色谱法联用分析饮用水源中的16种多环芳烃[J].农业环境科学学报,2008,27(1):395-400.

