RNA干扰survivin基因对宫颈癌细胞中survivin蛋白表达及caspase-3酶活性的影响
李元宏 常冰梅
1.山西医科大学,山西太原 030006;2.山西医科大学汾阳学院,山西汾阳 032200
RNA干扰survivin基因对宫颈癌细胞中survivin蛋白表达及caspase-3酶活性的影响
李元宏1,2常冰梅1
1.山西医科大学,山西太原 030006;2.山西医科大学汾阳学院,山西汾阳 032200
目的 观察RNA干扰survivin基因对宫颈癌细胞中survivin蛋白表达及caspase-3酶活性的影响。 方法 针对survivin mRNA序列设计合成3对编码小干扰RNA(siRNA)的DNA模板,构建shRNA重组质粒,转染Hela细胞,筛选获得转染效率最高的阳性克隆,阴性对照为阳性克隆随机打乱序列。Western blot方法检测survivin蛋白表达,分光光度法检测caspase-3酶活性。 结果 干扰48 h时,siRNA-168载体干预组干预效果最好,siRNA阳性质粒干扰组(实验组)survivin蛋白表达量为阴性对照组中survivin蛋白表达量的13%,是空白组survivin蛋白表达量的16%。干扰后caspase-3活性表达升高,实验组与阴性对照组、实验组与空白组相比差异均有统计学意义(P<0.05)。 结论 siRNA可有效抑制Hela细胞survivin蛋白表达,升高caspase-3酶活性。
survivin基因;宫颈癌细胞;survivin蛋白;caspase-3
宫颈癌是女性近年来常见的恶性肿瘤之一,是由人类乳头瘤病毒(HPV)引起,在全世界,发展中国家宫颈癌发病率较高,我国每年新增病例13万以上[1],每年有20多万名女性死于该病。survivin是凋亡抑制蛋白家族的新成员,具有肿瘤特异性,表达于肿瘤组织[2]。RNA干扰是与靶基因同源的双链RNA诱导的特异转录后基因沉默现象,其作用机制是双链RNA被特异的核酸酶降解,产生干扰小RNA(siRNA),这些siRNA与同源的靶RNA互补结合,特异性酶会降解靶RNA[3],该技术已经发展成为基因治疗、基因结构功能研究的常用技术。本研究拟采用RNA干扰技术[4],针对人survivin基因mRNA序列构建3个siRNA重组质粒,转染人宫颈癌Hela细胞,观察其对细胞survivin蛋白表达的变化及细胞内caspase-3酶活性的变化,进而了解细胞凋亡变化,为宫颈癌的预防、检测、治疗提供新的靶点。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒与细胞株 siRNA重组质粒及阴性对照由上海瑞赛生物技术公司构建,人宫颈癌Hela细胞由山西医科大学生物化学与分子生物学实验室提供。
1.1.2 试剂 脂质体LipofectamineTM2000(美国Gibco公司),DMEM培养基(美国Gibco公司),Opti-MEMRⅠ培养基(美国Gibco公司),胎牛血清(杭州四季青),survivin及GAPDH一抗、二抗(爱博生公司)。
1.2 方法
1.2.1 实验分组 根据实验目的分为实验组、阴性对照组及空白组。实验组采用构建阳性重组质粒转染;阴性对照组采用随机打乱的阳性质粒序列进行转染;空白组无干扰。
1.2.2 细胞转染 Hela细胞用含10%胎牛血清的DMEM培养基常规培养,每2~3天传代1次。重组质粒的转染在细胞对数生长期进行,调整细胞密度为 4×106~5×106/mL,转染前 1 d,将细胞悬液接种至6孔板。以250 μL Opti-MEMⅠ稀释5 μL LipofectamineTM2000,轻轻混匀,室温下孵育 5 min。以 250 μL Opti-MEMⅠ稀释7.5 μL siRNA,轻轻混匀,孵育5 min后,将稀释的siRNA和稀释的LipofectamineTM2000轻轻混合,在室温下孵育20 min,以便允许复合物的形成。将siRNA-LipofectamineTM2000复合物加入到6孔板中,轻轻摇动混合,37℃,5%CO2培养箱孵育48 h,进行荧光检测。分别取5个视野观察干扰效果,取平均值,公式计算干扰率(%)=(阴性对照组-实验组)/阴性对照组。
1.2.3 Western blot法检测survivin蛋白表达量 6孔板中每孔加入1 mL总蛋白提取液,充分吹打,在冰上放置10~20 min后,再吹打5~20 min,将匀浆液吸出置于 1.5 mL离心管中,超声 3 次,每次 3 s,9 000 r/min,离心 5 min,取适量上清置于新的1.5 mL离心管中。取上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,将目的条带电转移至硝酸纤维素膜,用含5%脱脂奶粉的TTBS封闭1 h。加入一抗,37℃孵育l h,加入二抗,室温孵育45 min,化学发光法显色。
1.2.4 caspase-3活性检测 采用分光光度法利用caspase-3活性检测试剂盒进行caspase-3活性检测。首先制作pNA浓度/A405吸光度的标准曲线,绘制标准曲线方程式,然后在被检测标本中加入底物Ac-DEVD-pNA 2 mmol/L后混匀,37℃孵育60~120 min,发现颜色变化比较明显时即可测定A405。样品的A405扣除空白对照的A405,即为样品中caspase-3催化产生的pNA产生的吸光度。由标准曲线方程Y=98.6946X-23.9127(Y为pNA浓度,X为A405吸光度值)求出各样本pNA浓度。Braford法测定样本蛋白浓度,caspase-3活性=Y/蛋白浓度,计算出caspase-3酶活力大小。
1.3 统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,三组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 干扰效果观察
光镜下观察干扰48 h效果可见,阳性质粒干扰后,成功干扰细胞数占细胞总数70%以上,可以进行后续试验。见图1。
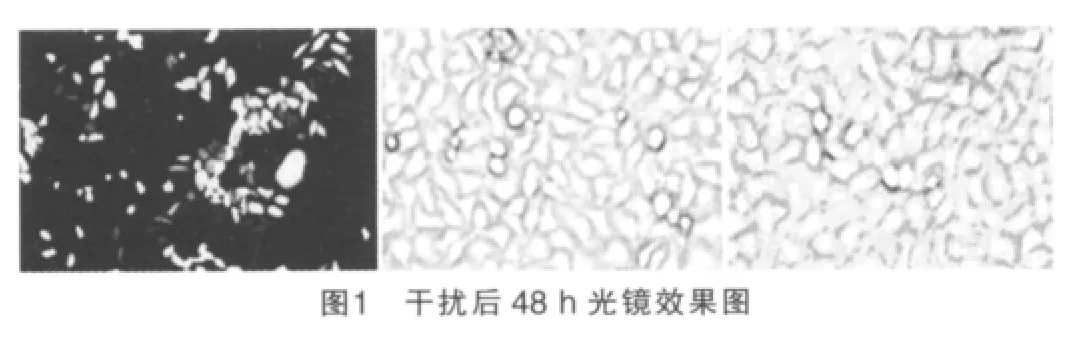
2.2 三组survivin蛋白表达量比较
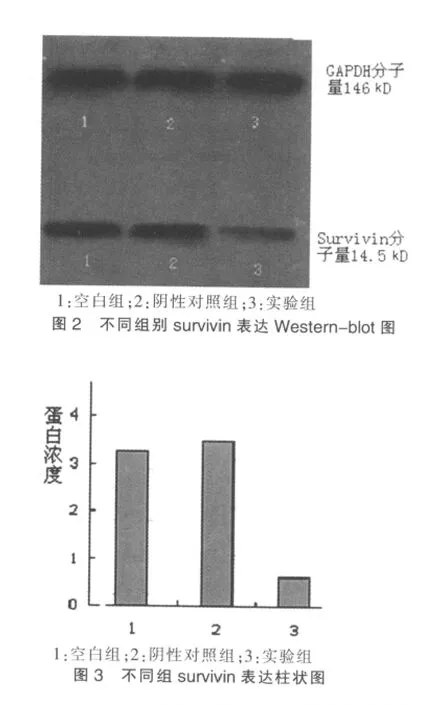
转染48 h后,用灰度扫描软件测量Western blot实验结果显示:实验组survivin蛋白表达量为阴性对照组survivin蛋白表达量的13%,是空白组survivin蛋白表达量的16%。见图 2、3。
2.3 三组caspase-3活性检测情况
各组酶活力单位检测结果显示,空白组为(1.32±0.10),阴性对照组为(1.61±0.20),实验组为(3.40±0.26),实验组与阴性对照组、空白组相比差异均有统计学意义(P<0.05),即siRNA干扰组显著升高了caspase-3酶活性。
3 讨论
survivin基因是一个抗凋亡基因,因为其抑制凋亡有利于肿瘤细胞存活而得名为“存活素”,其组织学分布具有特异性,且具有强大的抗细胞凋亡能力和特殊的作用途径及位点[5]。研究表明,survivin基因决定簇缺失的突变体能诱导细胞自发性凋亡,从而抑制肿瘤的生长进,使其逐渐成为肿瘤病因及治疗研究热点。RNAi是一种转录后的基因缄默,它能触发某种转录后监控程序,导致特定mRNA单链的降解。survivin蛋白在参与细胞凋亡过程中有两条途径:外源性凋亡途径和内源性凋亡途径。外源性凋亡途径又称为死亡受体通路,是由胞外肿瘤坏死因子(TNF)超家族的死亡配体引发。内源性凋亡途径又称为线粒体/细胞色素C介导的通路[6]。实验表明,细胞色素C从线粒体释放是细胞凋亡的关键步骤,释放出的的细胞色素C在dATP存在下能与凋亡相关因子1(Apaf-1)结合,使其形成多聚体,并促使caspase-9与其结合形成凋亡小体,caspase-9被激活,被激活的caspase-9进一步激活其他的caspase,如caspase-3等,从而诱导细胞凋亡[7]。survivin蛋白还可直接作用于caspase,主要抑制caspase-3和caspase-7的活性,同时,survivin也可通过P21间接抑制caspase。目前凋亡过程的详细机制还不完全清楚[8],但是caspase在凋亡过程中发挥重要的作用,细胞凋亡的过程实际上是caspase不可逆的水解底物的级联放大反应过程,到目前为止,已发现至少14种caspase。caspase活化有两种机制,即同源活化和异源活化。被异源活化的caspase又称为执行caspase,包括 caspase-3、caspase-6 和 caspase-7。
笔者应用RNAi技术将survivin siRNA转染survivin高表达的宫颈癌Hela细胞株,使survivin基因表达下调,结果显示,Hela细胞的生长速度减慢,survivin蛋白表达也相应下降,caspase-3的酶活性增加,细胞凋亡率增加。这表明survivin siRNA能够成功下调细胞内survivin基因的表达,有效降低survivin对caspase的抑制作用,进而引发一系列细胞和分子生物学的改变,促进细胞凋亡,抑制细胞生长。这些现象提示我们survivin过度表达与宫颈癌的发生、发展密切相关,是该病治疗的重要靶标,为宫颈癌的治疗研究提供重要的依据。
[1]Heymann WR.The human papillomavirus vaccine[J].J Am Acad Dermatol,2008,58(6):1047-1048.
[2]Tamm I,Wang Y,Sausville E,et al.IAP-famiIy protern survivn inhibits caspase activity and apoptosis 1nduced by Fas(CD95),Bax,caspases,and anticancer drugs[J].Cancer Res,1998,58:5315-5320.
[3]Joseph S.分子克隆实验指南[M].黄培堂,译.2版.北京:科学出版社,1992:888-898.
[4]Hiroshi K,Toshihiiko T,Ichiya H,et al.Expression and antigenicity of Survivin,an inhibitior of apoptosis family member,in bladder cancer:implication for specific immunotherapy[J].Urology,2006,67:955-959.
[5]Tanaka K,Iwamoto S,Gon G.Expression of survivin and its relationship to loss of apoptosis in breast carcinomas[J].Cancer Res,2000,21:437-441.
[6]Zha J,Weiler S,Oh KJ,et al.Posttranslational N-myristoy-lation of Bid as a molecular switch for targeting mitochondria and apoptosis[J].Science,2000,290 (5497):1761-1765.
[7]Ambrosini G,Adida C,Ahieri DC.A novel anti-apoptosis gene survivin expressed in cancer and lymphoma[J].Nat Med,1997(3):917-921.
[8]Ashkenazi A.Targeting the extrinsic apoptosis pathway in cancer[J].Cytokine Growth Factor Rev,2008,19(3-4):325-331.
The effects of RNA interference survivin gene on the expression of survivin protein and caspase-3 enzyme activity in cervical cancer cells
LI Yuanhong1,2CHANG Bingmei1
1.Shanxi Medical University,Shanxi Province,Taiyuan 030006,China;2.Fenyang College Shanxi Medical University,Shanxi Province,Fenyang 032200,China
ObjectiveTo investigate the effect of RNA survivin interference gene on the expression of survivin protein and the activity of caspase-3 enzyme in cervical cancer cells.MethodsAccording to the survivin mRNA sequence,3 pairs of DNA template for small interference RNA(siRNA)was designed and synthetized,shRNA recombination plasmid was built,Hela cells was transfected.The positive clones with the highest transfection efficiency was isolated,and negative control was the randomly upseted sequence of positive clones.Western blot method was used to detect the expression of survivin protein and spectrophotometry was used to detect the activity of caspase-3 enzyme.ResultsAt 48 h of interference,the siRNA-168 vectors intervention group had the best effect.The survivin protein expression of the siRNA positive plasmid interfern group(experimental group)was 13%of the negative control group,which was 16%of the blank control group.After interference,the activity of caspase-3 rised and there was significant difference not only between experimental group and negative control group,but also between experimental group and blank control control(P<0.05).ConclusionsiRNA can inhibit the expression of survivin protein in Hela cells effectively and increase caspase-3 activity.
Survivin gene;Cervical cancer cell;Survivin protein;Caspase-3
R737.3
A
1673-7210(2012)08(a)-0022-03
李元宏(1974.9-),男,硕士研究生,山西医科大学汾阳学院讲师;研究方向:肿瘤分子生物学。
常冰梅,女,博士研究生,山西医科大学副教授。
2012-03-01 本文编辑:程 铭)

