生物素标记试剂的合成方法改进及其在DNA合成中的应用
杨明蓉, 唐 卓, 陈应春
(1. 四川大学 华西药学院,四川 成都 610041; 2. 中国科学院 成都生物研究所,四川 成都 610041)
近年来,核酸探针杂交技术在医疗科研和临床中被广泛采用,成为一项直接检查病原体、癌基因、遗传病基因突变等的重要手段。用于杂交的核酸探针必须先进行标记,可分为同位素标记和非同位素标记两大类。生物素标记的核酸探针属于非同位素标记,它是利用亲和素对生物素有极高亲和力的原理,分子杂交后用亲和素或链霉亲和素进行检测[1~4]。生物素标记探针稳定,不失活,并能配用多种检测系统,简单方便。
Richard T Pon[5]设计合成了一种较为理想的生物素标记试剂——[1-N-(4,4′-二甲氧基三苯甲基)-生物素-6-氨基己基]-2-氰乙氧基-N,N-二异丙基亚磷酰胺(3)。3所含的6-氨基己基侧链显著增加了生物敏感性[6],同时3中的二甲氧三苯基增加了稳定性,不仅有利于寡核苷酸链的合成与纯化,而且还可以在DNA合成仪上通过颜色变化检测连接效率。
为了推进3的应用,本文改进文献[5]方法,先将生物素与DMTrCl(4,4′-二甲氧基三苯基氯甲烷)反应制得1-N-(4,4′-二甲氧基三苯甲基)生物素(1); 1与6-氨基-1-己醇在氯甲酸乙酯中缩合制得1-N-(4,4′-二甲氧基三苯甲基)生物素-6-氨基己醇(2); 2与磷试剂2-氰乙氧基-双(N,N-二异丙基)亚磷酰胺(Ⅰ)[7]反应合成了3(Scheme 1),总收率51.0%,其结构经1H NMR,13C NMR,31P NMR和MS确证。
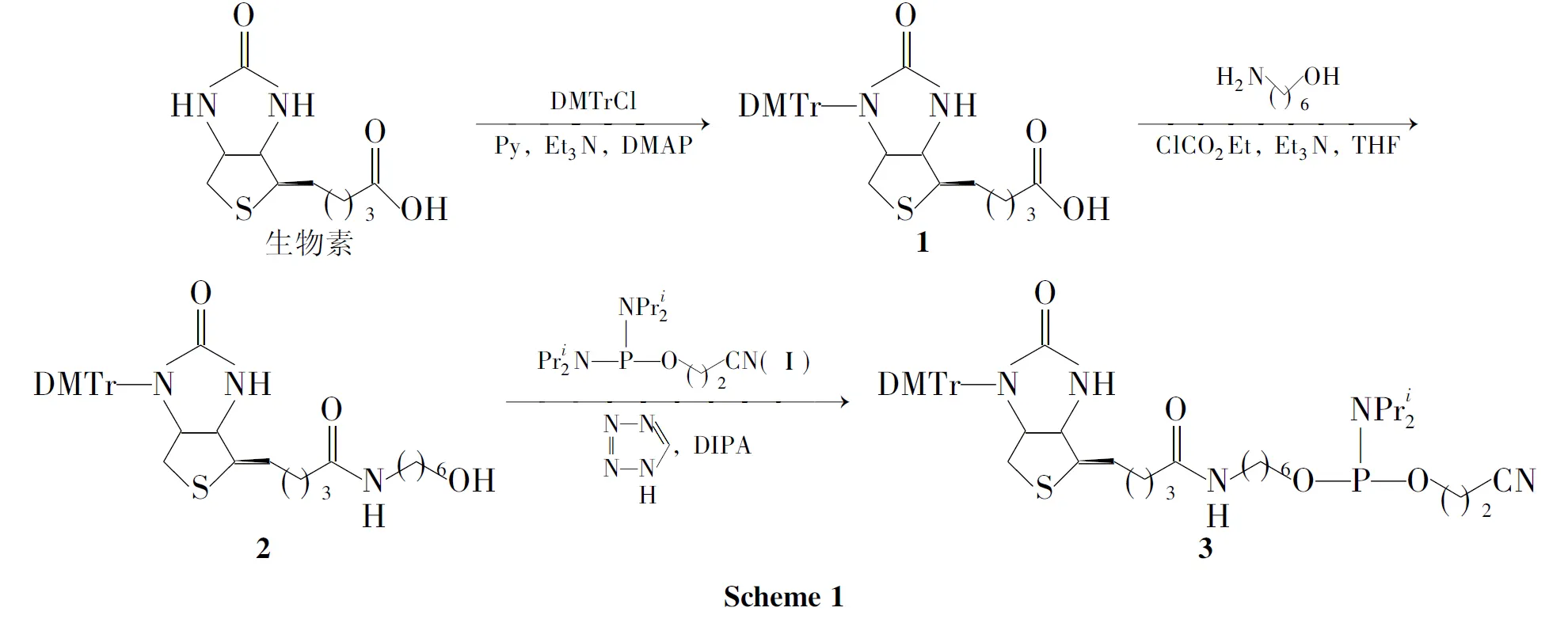
改进方法将文献[5]路线由5步简化为3步,提高了生物素的转化率,同时避免了昂贵的硅试剂及TBAF(四丁基氟化铵)的使用。
为了验证改进方法的可行性,本文还采用固相亚磷胺三酯法,应用3合成了一段含有十个碱基的5′-端Biotin标记的寡核苷酸链Biotin-A-A-A-A-A-A-A-A-A-A(记为Biotin-A10)[8~11],其结构经MS确证。
1 实验部分
1.1 仪器与试剂
Yanaco型显微熔点仪(温度计未校正);Brucker-600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Alltech HPLC 1500型液相色谱仪(HPLC); Bruker Daltonics ESI-Bio TOF-Q型高分辨质谱仪;ABI 394型DNA合成仪。
硅胶300目~400目,其余所用试剂均为分析纯;反应均在无水条件下进行,所用试剂都需作无水处理。
1.2 合成
(1)1的合成
在反应瓶中依次加入生物素2 g(8.2 mmol)的吡啶(40 mL)溶液, DMTrCl 8.32 g(24.6 mmol), Et3N 828 mg(8.2 mmol)和DMAP(4-二甲氨基吡啶) 250.4 mg(2.08 mmol),搅拌下于70 ℃反应4 h。浓缩后用氯仿稀释,分液,有机相用5%柠檬酸钠溶液洗涤三次,无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:V(甲醇) ∶V(二氯甲烷)=3 ∶97]纯化得橙红色固体13.36 g,收率75.0%;1H NMR(DMSO-d6)δ: 1.43~1.64(m, 6H, CH2), 2.16~2.19(m, 4H, SCH2, COCH2), 3.11(m, 1H, SCH), 3.72(s, 6H, OCH3), 4.27~4.33(m, 2H, NCH), 6.70(s, 1H, NH), 6.84(d, 4H, ArH), 7.22(m, 9H, ArH), 11.94(s, 1H, CO2H)。
(2)2的合成
在圆底烧瓶中加入11.65 g(3.02 mmol)的THF(16 mL)溶液和Et3N 306 mg(3.02 mmol),搅拌下于0 ℃缓慢滴加氯甲酸乙酯654 mg(6.04 mmol),滴毕,反应1 h;冷却至-20 ℃,加入6-氨基-1-己醇608 mg(6.04 mmol),反应过夜。加水稀释后用氯仿(3×100 mL)萃取,合并萃取液,用无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:V(甲醇) ∶V(二氯甲烷)=1 ∶20]纯化得白色固体21.56 g,收率79.3%;1H NMRδ: 1.24~1.70(m, 14H, CH2), 2.15(t, 2H, NCH2), 2.25~2.60(m, 2H, COCH2), 3.08~3.23(m, 3H, CHS), 3.60(t, 2H, OCH2), 3.80(s, 6H, OCH3), 4.36(m, 2H, NCH), 5.10(s, 1H, NH), 5.63(s, 1H, NH), 6.81(d, 4H, ArH), 7.22(m, 9H, ArH)。
(3)3的合成
在反应瓶中依次加入2645 mg(1 mmol)的无水乙腈(10 mL)溶液,四氮唑140 mg(2 mmol), DIPA(N,N-二异丙胺)242.3 mg(2.4 mmol)和Ⅰ 600 mg(2 mmol),搅拌下于室温反应2 h。用二氯甲烷(200 mL)稀释,分液,有机相依次用5%碳酸氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:V(Et3N) ∶V(氯仿)=1 ∶19]纯化得白色固体3724 mg,收率85.7%, m.p.148 ℃~150 ℃;1H NMRδ: 1.21(m, 12H, CH3), 1.24~1.90(m, 14H, CH2), 2.17(t, 2H, NCH2), 2.22~2.60(m, 2H, COCH2), 2.65(t, 2H, CH2CN), 3.08~3.30(m, 3H, CHS), 3.53~3.78(m, 4H, OCH2), 3.80(s, 6H, OCH3), 4.35(m, 2H, CHN), 5.13(s, 1H, NH), 5.61(s, 1H, NH), 6.81(d, 4H, ArH), 7.22(m, 9H, ArH);13C NMRδ: 11.44, 24.55, 24.60, 24.66, 25.23, 25.61, 26.63, 29.50, 39.31, 42.96, 43.01, 46.20, 54.41, 55.23, 58.20, 59.66, 65.40, 72.74, 112.79, 117.77, 126.86, 127.48, 129.74, 131.30, 135.83, 135.91, 143.86, 158.39, 161.81, 172.92;31P NMRδ: 147.81(s); ESI-MSm/z: 868{[M+Na]+}。
1.3 3在合成DNA中的应用
在反应瓶中加入0.1 mol·L-13的乙腈溶液,置DNA合成仪上,在一段含10个A碱基的寡核苷酸链(A10)的5′-端连接3;其N-DMT(N-上的4,4′-二甲基三苯基甲基保护基)经5%三氯乙酸/二氯甲烷脱去后于55 ℃氨解10 h。经反相HPLC纯化(条件见表1)得目标序列Biotin-A10; ESI-MSm/z: 3 474。
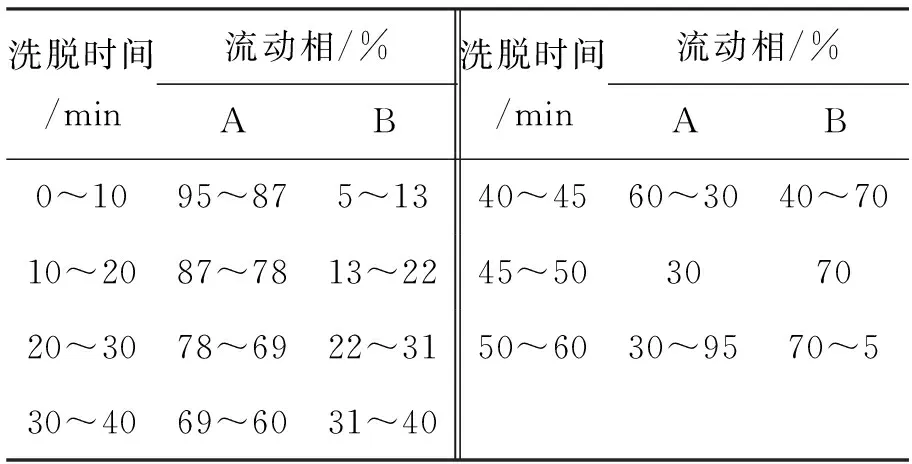
表 1 Biotin-A10的反相HPLC纯化条件*Table 1 Purification conditions of reversed-phase HPLC for Biotin-A10
*Apollo C18柱(4.6 m×250 mm, 5 μm);柱温30 ℃;检测波长260 nm;流动相A: Et3N·AcOH buffer(pH 7.0),流动相B:乙腈,流速1.0 mL·min-1;进样量20 μL; tA10=17.86 min, tBiotin-A10=21.44 min
2 结果与讨论
本文以文献[5]工作为基础,改进合成3的方法。由1合成2采用混合酸酐法,利用氨基与羟基反应活性的差异一步生成酰胺,避免了羟基的保护与脱保护,简化了反应步骤。
由2合成3选用Ⅰ为磷试剂比2-氰基乙氧基-N,N-二异丙基氯代亚磷酰胺(Ⅱ)[5]的稳定性更好、后处理方便、且原料转化率高,3总收率达51.0%。此外,Ⅰ可大量合成,相对于昂贵的Ⅱ成本大大降低,有利于工业化生产。
本文将3应用于合成DNA,成功地制得Biotin-A10,充分显示了3在合成DNA中的广阔应用前景。
为了提高生物素的转化率,DMTrCl, 6-氨基-1-己醇, Ⅰ均要过量;因为Ⅰ易被氧化,由2合成3应在氮气保护下进行。
[1] Merr Wilchek, Bayer E A. The avidin-biotin complex in bioanalytical applications[J].Analytical Biochemistry,1988,171:1-32.
[2] 马风林. 生物素标记核酸探针技术[J].生物化学与生物物理进展,1989,16(27):15-17.
[3] Fang S Y, Guan Y S, Ernest R Blatchley. Conjugation of (E)-5-[2-(methoxycarbonyl)ethenyl]cytidine to hydrophilic microspheres:Development of a mobile microscale UV light actinometer[J].Bioconjugate Chem,2008,19:592-597.
[4] Misiura K, Durrant I, Evans M R. Biotinyl and phosphotyrosinyl phosphoramidite derivativesuseful in the incorporation of multiple reporter groups on synthetic oligonucleotides[J].Nucleic Acids Research,1990,18(15):4345-4354.
[5] Richard T Pon. A long chain biotin phosphoramidite reagent for the automated synthesis of 5′-biotinylated oligonucleotides[J].Tetrahedron Letters,1991,32(14):1715-1718.
[6] Al-Hakim A H, Hull R. Studies towards the development of chemically synthesized non-radioactive biotinylated nucleic acid hybridization probes[J].Nucleic Acids Research,1986,14(24):9965-9976.
[7] 阎汝连,张思骞. DNA合成用化学试剂-2-氰乙氧基-双(N,N-二异丙基)亚磷酸胺的合成[J].化学试剂,1992,14(4):237-238.
[8] Germann M W, Pon R T, van de Sande J H. A general method for the purification of synthetic oligodeoxyribonucleotides containing strong secondary structure by reversed-phase high-performance liquid chromatography on PRP-1 resin[J].Analytical Biochemistry,1987,165:399-405.
[9] Alves A M, Holland D, Edge M D. A chemical method of labelling oligodeoxyribonucleotides with biotin:A single step procedure using a solid phase methodology[J].Tetrahedron Letters,1989,30(23):3089-3092.
[10] Paul S Nelson,Mark Kent. Sylvester muthini.Oligonucleotide labeling methods.3.Direct labeling of oligonucleotides employing a novel,non-nucleosidic,2-aminobutyl-1,3-propanediol backbone[J].Nucleic Acids Research,1992,20(23):6253-6259.
[11] Mitsuo Sekine, Kazuhisa Okada, Kohji Seio,etal. Synthesis of a biotin-conjugate of phosmidosineO-ethyl ester as a G1 arrest antitumor drug[J].Bioorganic & Medicinal Chemistry,2004,12(24):6343-6349.

