Migrastatin母核9-羟基的衍生化
钟川龙, 辜玲慧, 吴小艾, 范成中
(1. 四川大学 a. 华西药学院 靶向药物教育部重点实验室; b. 华西医院 核医学科,四川 成都 610041)
靶向抑制癌细胞转移是近年来癌症治疗领域的研究热点。Imoto等[1,2]从链霉菌属培养液中首次分离得到Migrastatin,经生物活性测试发现其具有与肿瘤细胞特异性结合的能力,其构效关系研究发现Migrastatin十四元内酯环母核是与肿瘤细胞特异结合的有效结构单元[3]。本研究组为了借助其良好的靶向性对Migrastatin母核及其衍生物进行合成研究,希望利用未见报道的Migrastatin母核的9-羟基衍生[4~6]并通过引入示踪元素和一系列可与示踪元素络合的官能团,从而获得用于肿瘤的早期诊断和治疗[4]的新型靶向试剂。
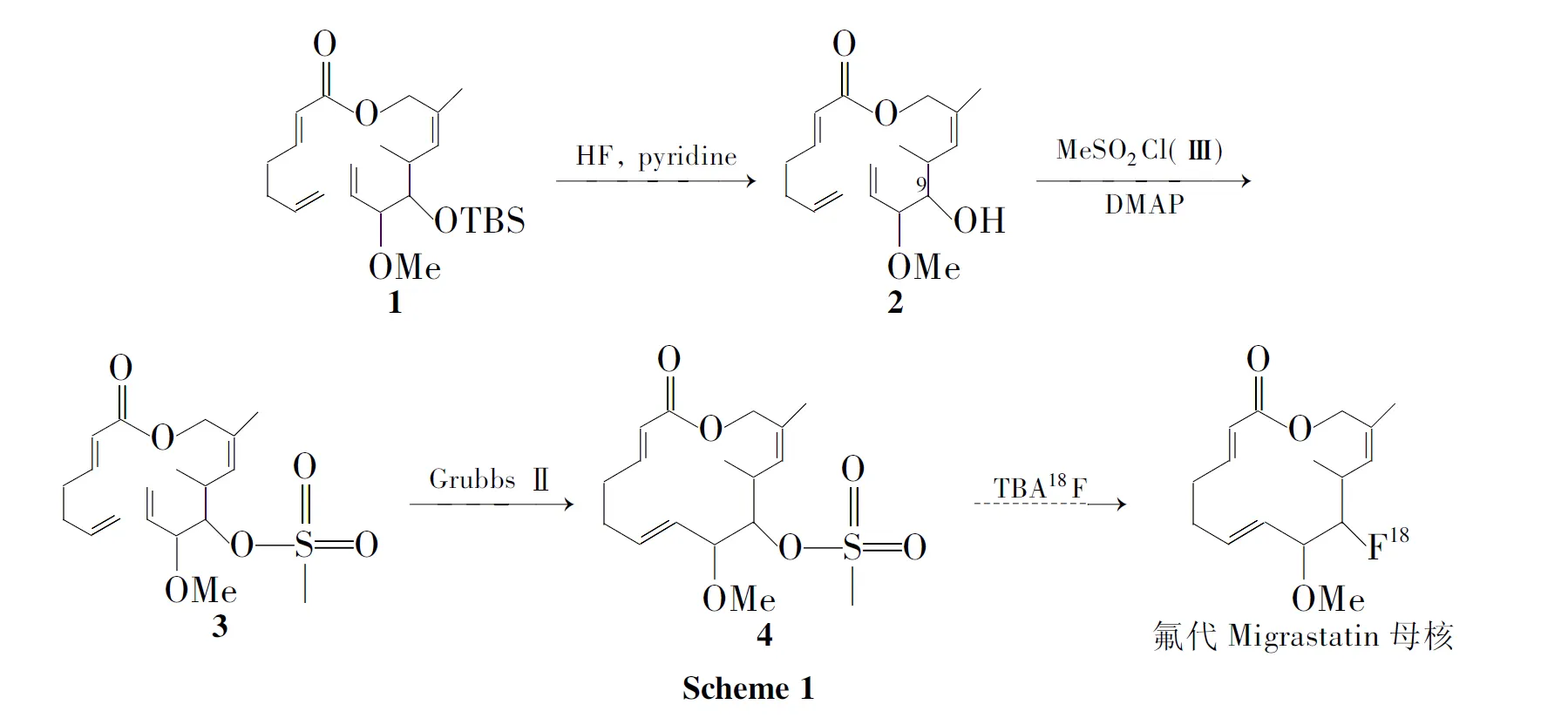
本文在Migrastatin母核全合成研究的基础上,首先尝试直接在Migrastatin母核9-羟基上进行衍生,但均未获得成功。最终选择关环之前,以2,6-二烯庚酸-5-(叔丁基二甲硅氧基)-6-甲氧基-2,4-二甲基-2,7-二烯酯(1)为起始原料,经过脱TBS保护、酯化和烯烃复分解关环反应,成功地合成了易被放射性氟(18F)代的Migrastatin母核9-甲磺酸酯[7](4, Scheme 1),总收率15.3%,其结构经1H NMR和ESI-MS表征。为实现其用于肿瘤早期诊断和治疗研究奠定了技术基础。
1 实验部分
1.1 仪器与试剂
Varian Inova 400型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker Daltonics Data Analysis 3.2型质谱仪。
1按文献[4]方法合成;THF在氮气保护下经金属钠干燥重蒸;二氯甲烷在氮气保护下经五氧化二磷干燥重蒸;甲苯在氮气保护下由氢化钙干燥重蒸;柱层析硅胶(硅胶H),青岛海洋化工有限公司;氢氟酸吡啶盐,Grubbs Ⅱ, MeOTMS,分析纯,北京百灵威试剂有限公司;甲磺酰氯,分析纯,成都爱斯特试剂有限公司。
1.2 合成
(1) 2的合成
在干燥反应瓶中加入1130 mg(0.3 mmol)的THF(9 mL)溶液,冰浴冷却,搅拌下缓慢滴加氢氟酸吡啶盐1.8 mL,氮气保护下于室温反应15 h(析出大量白色沉淀)。加入MeOTMS(甲氧基三甲基硅烷),搅拌5 min,过滤,滤饼用乙酸乙酯洗涤,合并滤液与洗涤液,减压浓缩后经硅胶柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=12 ∶1]纯化得淡黄色油状液体2,产率90%;1H NMRδ: 7.01~6.94(m, 1H), 5.87~5.68(m, 3H), 5.39~5.31(m, 2H), 5.08~5.00(m, 2H), 4.69~4.53(m, 3H), 3.51~3.46(m, 2H), 3.27(s, 3H), 2.73~2.65(m, 1H), 2.35~2.19(m, 4H), 1.77~1.74(m, 3H), 1.02~1.00(m, 3H)。
(2)3的合成
在干燥反应瓶中加入2100 mg(0.32 mmol)的吡啶(8 mL)溶液和DMAP(二甲氨基吡啶)3.9 mg,冰浴冷却,搅拌下缓慢滴加稍过量的甲磺酰氯(Ⅲ,立即有白色沉淀生成),滴毕,于室温反应2 h(TLC跟踪)。加入少量水,分液,水层用二氯甲烷萃取,合并有机层,用无水硫酸镁干燥,减压浓缩后经硅胶柱层析(洗脱剂:A=12 ∶1)纯化得无色油状液体3,产率85%;1H NMRδ: 6.98~6.94(m, 1H), 5.85~5.55(m, 3H), 5.43~5.34(m, 3H), 5.07~4.99(m, 2H), 4.66~4.45(m, 3H), 3.70~3.65(m, 1H), 3.26(s, 3H), 3.08(s, 3H), 2.95~2.90(m, 1H), 2.31~2.20(m, 4H), 1.78~1.76(m, 3H), 1.04~1.01(m, 3H)。
(3)4的合成
氮气保护,在反应瓶中加入319 mg(0.05 mmol)的甲苯(80 mL)溶液,搅拌下于120 ℃(甲苯微沸)加入Grubbs Ⅱ 8.3 mg(0.01 mmol),回流反应25 min。冷却至室温,过闪层硅胶柱除去甲苯,用乙酸乙酯冲洗柱子,收集液减压浓缩后经硅胶柱层析(洗脱剂:A=10 ∶1)纯化得无色油状液体4,产率20%;1H NMRδ: 6.80~6.72(m, 1H), 5.78~5.74(d,J=16 Hz, 1H), 5.72~5.64(m, 1H), 5.48~5.33(m, 2H), 5.18~5.12(m, 1H), 4.78~4.59(m, 2H), 3.69~3.65(t,J=8.8 Hz, 1H), 3.25(s, 3H), 3.12(s, 3H), 2.51~2.21(m, 5H), 1.68(s, 3H), 0.92~0.91(m, 3H); ESI-MSm/z: 359.153 1{[M+H]+}。
2 结果与讨论
2.1 Migrastatin母核9-羟基的反应活性
在全合成得到Migrastatin母核后,我们首先尝试直接对9-羟基进行衍生。为了能引入示踪元素和一系列可与示踪元素络合的官能团,分别以具有三氮中心的氨基酸(Ⅰ, Chart 1),对甲苯磺酰氯(Ⅱ)和Ⅲ为酰化剂,对Migrastatin母核9-羟基进行衍生,其反应条件及结果见表1。由表1可以看出,Migrastatin母核9-羟基的反应活性非常低,在缩合剂DCC/DMAP和EDCI/DMAP的条件下,Migrastatin与Ⅰ完全没有反应,反应进行72 h后大量原料剩余。换用酰氯法及混酐法也同样未检测到酰化产物生成,如以Ⅱ或Ⅲ为酰化剂,室温反应48 h仍然未检测到产物。可能是由于十四元环的特殊空间构型,9-羟基处于大位阻处,其反应活性极差,无法直接完成衍生化。
本文改变合成策略,先将1的9-羟基脱TBS保护制得2; 2酯化得3;3在Grubbs Ⅱ催化下关环即完成Migrastatin母核9-羟基衍生成功地合成了4。

a1. A, SOCl2,回流反应2 h; 2. Migrastatin母核,CH2Cl2, 25 ℃。b1. A, 2,4,6-三氯苯甲酰氯,二异丙基乙胺,甲苯,25 ℃; 2. Migrastatin母核,吡啶,甲苯,25 ℃
2.2 3关环反应的条件优化
以Grubbs Ⅱ试剂催化3复分解反应关环合成4,该步反应收率较低,溶剂种类、溶剂用量以及反应时间和温度对收率都有明显影响,其条件筛选见表2。因该反应是分子内的烯烃复分解反应,我们通过控制溶剂用量以减少分子间的副反应,从表2可以看出,当甲苯量为150 mL·(0.1 mmol)-1时,收率最高,继续增大溶剂量并不能使收率再提高。在反应时间及温度方面,以甲苯为溶剂,于120 ℃回流25 min即可反应完全,降低反应温度或更换溶剂种类均不利于反应的进行。

表 2 3的关环反应条件Table 2 Reactions conditions of 3 cyclization
*mL·(30.1 mmol)-1
[1] Nakae K, Yoshimoto Y, Imoto M,etal. Migrastatin a new inhibitor of tumor cell migratition from streptomycessp MK929-43F1,taxonomy,fermentation isolation and biological activities[J].J Antibiotics,2000,53(10):1130-1136.
[2] Woo E J, Starks C M, Carney J R,etal. Migrastatin and a new compoundiso-migrastatin from streptomyces platensis[J].J Antibiotics,2002,55(2):141-146.
[3] Njardarson J T, Gual C, Shan D,etal. Discovery of potent cell migration inhibitors through total synthesis:Lessons from structure-activity studies of (+)-Migrastatin[J].J Am Chem Soc,2004,126(4):1038-1040.
[4] 唐柏杨,吴小艾,谢蒋平,等. Migrastatin母核的全合成[J].华西药学杂志,2011,26(2):103-107.
[5] Ebastien R, Janine C. Synthesis of Migrastatin and its macrolide core[J].Tetrahedron,2007,63(26):918-5929.
[6] Njardarson J T, Gual C, Shan D,etal. The Migrastatin family:Discovery of potent cell migration inhibitors by chemical synthesis[J].J Am Chem Soc,2004,126(36):11326-11337.
[7] Zhu L, Liu Y J, Plössl K,etal. An improved radiosynthesis of [18F]AV-133:A PET imaging agent for vesicular monoamine transporter 2[J].Nuclear Medicine and Biology,2010,37:133-141.

