1,3-交替构象杯[4]芳烃-香豆素衍生物的合成
王鹤文, 冯亚青, 孟舒献
(1. 黄冈师范学院 化工学院,湖北 黄冈 438000; 2. 天津大学 化工学院,天津 300072)
基于荧光识别试剂识别检测金属离子的荧光分析法具有灵敏度高、选择性好、反应时间短等优点,荧光识别试剂的设计与合成一直是非常重要的课题[1]。
杯芳烃是继冠醚和环糊精后的第三代环腔结构超分子主体化合物,是优良的分子设计平台。以杯芳烃为骨架构筑的荧光识别试剂在离子选择识别和检测方面表现出了很好的性质,在此基础上设计合成具有更高选择性和更佳灵敏度的荧光识别试剂势在必行[2]。杯[4]芳烃具有锥式、半锥式、1,2-交替和1,3-交替四种构象。其中1,3-交替构象是用于构建具有特殊用途的复杂分子的优良骨架,被誉为杯芳烃的“智能”构象[3]。
金属离子荧光识别试剂一般由识别基团和荧光基团两部分组成。由于香豆素类荧光基团具有荧光量子产率高,Stokes位移大,光物理和光化学性质可调、光稳定性好等优点,是荧光识别分子设计中的优选的荧光基团[4]。将香豆素基团作为荧光基团引入杯芳烃得到的荧光分子具有很好的离子和分子识别性能[5,6]。
本文以对叔丁基杯[4]芳烃(1)为原料,通过醚化、原位硝化、还原、缩合四步反应合成了三个新型的具有1,3-交替构象的杯芳烃-香豆素衍生物5,11,17,23-四(6-甲基-2H-苯并吡喃酮-4-甲亚胺基)-25,26,27,28-四丙氧基杯[4]芳烃(1,3-交替构象)(6a), 5,11,17,23-四 (7-甲氧基-2H-苯并吡喃酮-4-甲亚胺基)-25,26,27,28-四丙氧基杯[4]芳烃(1,3-交替构象)(6b)和5,11,17,23-四(2H-苯并[h]吡喃酮-4-甲亚胺基)-25,26,27,28-四丙氧基杯[4]芳烃(1,3-交替构象)(6c)(Scheme 1),其结构经1H NMR,13C NMR, IR和MS 表征。

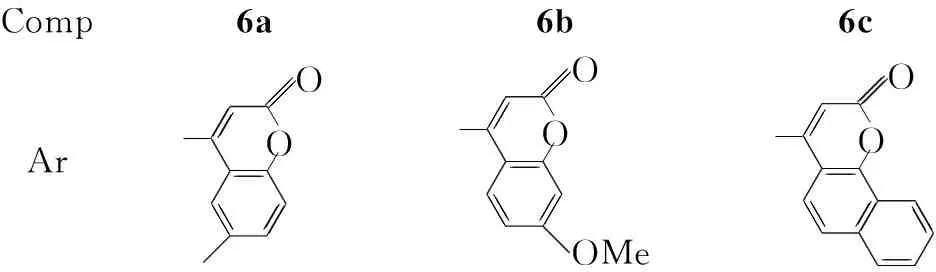
Comp6a6b6cAr -O O OMe -O O -O O
Scheme1
1 实验部分
1.1 仪器与试剂
X4型数字显微熔点仪(温度未校正);Varian INOVA-500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);FTS 3000型红外光谱仪(KBr压片);LCQ型质谱仪。
1[7],3[8], 5,11,17,23-四氨基杯芳烃衍生物(4)[9]按文献方法合成;其余所用试剂均为分析纯。
1.2 合成
(1) 2的合成
在反应瓶中依次加入叔丁醇钾2.24 g(20 mmol),苯40 mL和1 0.65 g(1 mmol),搅拌下于60 ℃活化1 h;加入溴代正丙烷1.82 mL(20 mmol)和碘化钾0.1 g,搅拌下回流反应至终点[TLC跟踪,展开剂:V(二氯甲烷) ∶V(石油醚)=1 ∶3]。冷却至室温,旋蒸除溶,残余物用CH2Cl2溶解,依次用1 mol·L-1盐酸(2×50 mL),饱和食盐水(2×50 mL)洗涤,无水MgSO4干燥,旋蒸脱溶,残余物用正己烷溶解,过滤,滤饼干燥得白色固体2,收率25%, m.p.340 ℃~343 ℃(339 ℃~341 ℃[10]);1H NMRδ: 6.96(s, 8H, ArH in calixarene), 3.82(s, 8H, CH2in calixarene), 3.31(t,J=7.5 Hz, 8H, OCH2), 1.27(s, 36H, CH3in Bu), 1.02~0.95(m, 8H, CH2in Pr), 0.62(t,J=7.5 Hz, 12H, CH3in Pr)。
(2)6a~6c的合成
氮气保护,在反应瓶中依次加入4 0.33 g(0.5 mmol),香豆素醛(5a~5c) 5 mmol,乙醇 30 mL和冰醋酸0.5 mL,搅拌下回流反应至终点[TLC跟踪,展开剂:V(石油醚) ∶V(乙酸乙酯)=1 ∶8]。冷却至室温,旋蒸除溶,残余物用CH2Cl2和无水甲醇重结晶得黄色固体6a~6c。
6a: 收率73%, m.p.>350 ℃;1H NMRδ: 8.45(s, 4H, ArH in cumarin), 8.32(s, 4H, N=CH), 7.32(t,J=9.0 Hz, 2H, ArH in cumarin), 7.13(s, 8H, ArH in calixarene), 7.08(t,J=8.0 Hz, 8H, ArH in cumarin), 6.45(s, 4H, ArH in cumarin), 3.86(t,J=7.5 Hz, 8H, OCH2), 3.66(s, 8H, CH2in calixarene), 2.44(s, 12H, CH3in cumarin), 2.21~2.14(m, 8H, CH2in Pr), 1.24(t,J=7.5 Hz, 12H, CH3in Pr);13C NMRδ: 160.66, 156.54, 154.20, 152.24, 145.19, 144.22, 134.09, 134.06, 133.35, 126.13, 123.28, 118.21, 117.15, 116.35, 76.00, 35.35, 29.94, 24.87, 11.27; IRν: 1 735, 1 612 cm-1; MSm/z: Calcd for C84H76N4O12{[M+H]+} 1 333.0, found 1 334.2。
6b: 收率63%, m.p.>350 ℃;1H NMRδ: 8.69(d,J=9.0 Hz, 4H, ArH in cumarin), 8.33(s, 4H, N=CH), 7.12(s, 8H, ArH in calixarene), 6.72(t,J=9.0 Hz, 8H, ArH in cumarin), 6.20(s, 4H, ArH in cumarin), 3.95(s, 12H, OCH3), 3.87(t,J=7.5 Hz, 8H, OCH2in Pr), 3.63(s, 8H, CH2in calixarene), 2.18~2.11(m, 8H, CH2in Pr), 1.33(t,J=7.5 Hz, 12H, CH3in Pr);13C NMRδ: 162.92, 160.95, 156.75, 156.12, 155.05, 145.38, 143.83, 134.06, 128.14, 123.36, 116.36, 112.35, 110.07, 101.12, 75.72, 55.96, 35.34, 24.91, 11.50; IRν: 1 735, 1 612 cm-1; MSm/z: Calcd for C84H76N4O16{[M+H]+} 1 397.0, found 1 398.5。
6c: 收率65%, m.p.>350 ℃;1H NMRδ: 8.62(d,J=9.0 Hz, 4H, ArH in cumarin), 8.51(s, 4H, N=CH), 7.90(d,J=9.0 Hz, 4H, ArH in cumarin), 7.67(d,J=8.0 Hz, 4H, ArH in cumarin), 7.56(t,J=8.0 Hz, 4H, ArH in cumarin), 7.46(t,J=9.0 Hz, 4H, ArH in cumarin), 7.40(d,J=9.0 Hz,4H, ArH in cumarin), 7.19(s, 8H, ArH in calixarene), 6.59(s, 4H, ArH in cumarin), 3.93(t,J=7.0 Hz, 8H, OCH2), 3.70(s, 8H, CH2in calixarene), 2.25~2.18(m, 8H, CH2in Pr), 1.40(t,J=7.5 Hz, 12H, CH3in Pr);13C NMRδ: 160.35, 156.85, 155.32, 151.21, 146.29, 144.20, 134.51, 134.14, 129.08, 127.40, 127.12, 123.79, 123.44, 122.76, 122.64, 121.87, 118.68, 112.13, 75.72, 35.47, 25.00, 11.54; IRν: 1 725, 1 632 cm-1; MSm/z: Calcd for C96H76N4O12{[M+H]+} 1 477.0, found 1 478.6。
2 结果与讨论
以1为原料合成1,3-交替构象的四取代醚化衍生物2常用的碱催化剂有碳酸铯和叔丁醇钾两种。虽然碳酸铯为催化剂时产率略高,但是价格较贵。本实验采用叔丁醇钾为催化剂,产物为1,3-交替构象和半锥式构象的混合物。由于1,3-交替构象的醚化产物在正己烷中的溶解度很小,而半锥式构象的醚化产物则完全溶解于正己烷,故通过加入正己烷溶解后可以分离出1,3-交替构象醚化产物,且纯度较好。
在6的IR谱中,内酯基团的伸缩振动吸收谱带分别出现在1 735 cm-1,1 735 cm-1和1 725 cm-1;位于1 612 cm-1, 1 612 cm-1和1 632 cm-1处的吸收峰指派为甲亚胺基团的伸缩振动谱带。6的1H NMR分析表明,杯芳烃桥联亚甲基质子分别在3.66, 3.63和3.70出现一单峰,说明6的杯芳烃为1,3-交替构象。6的13C NMR桥联亚甲基C原子分别在35.35, 35.34 和35.47出现信号也证明6为1,3-交替构象型[11]。6在8.32, 8.33和8.51处出现的单峰表明亚胺基团中的双键采取E-构型[12]。
[1] Bernard V, Isabelle L. Design principles of fluorescent molecular sensors for cation recognition[J].Coord Chem Rev,2000,205(1):3-40.
[2] Kim J S, Quang D T. Calixarene-derived fluorescent probes[J].Chem Rev,2007,107:3780-3799.
[3] L Baklouti, J Harrowfield, B Pulpoka,etal. 1,3-Alternate,the smart conformation of calix[4]arenes[J].Mini-Rev Org Chem,2006,3:355-384.
[4] 马文辉,彭孝军,徐群,等. 香豆素类荧光传感器[J].化学进展,2007,19(9):1258-1266.
[5] Leray I, Asfari Z, Vicens J,etal. Photophysics of calix[4]biscrown-based ditopic receptors of caesium containing one or two dioxocoumarin fluorophores[J].J Fluoresc,2004,14(4):451-458.
[6] Lee S H, Kim H J, Lee Y O,etal. Fluoride sensing with a PCT-based calix[4]arene[J].Tetrahedron Lett,2006,47:4373-4376.
[7] C D Gutsche, M Iqbal.p-tert-butylcalix[4]arene[J].Org Synth,1990,68:234-236.
[8] E Kelderman, L Derhaeg, G J T Heesink,etal. Nitrocalix[4]arenes as molecules for second-order nonlinear optics[J].Angew Chem Int Ed Engl,1992,31(8):1075-1077.
[9] G Mislin, E Graf, M W Hosseini. Synthesis of an exo-ditopic receptor based on calix[4]arene and catechol[J].Tetrahedron Lett,1996,37(26):4503-4506.
[10] K Iwamoto, K Araki, S Shinkai. Conformations and structures of tetra-O-alkyl-p-tert-butylcalix[4]arenes.How Is the conformation of calix [4]arenes immobilized[J].J Org Chem.1991,56,4955-4962.
[11] Jaime C, de Mendoza J, Prados P,etal.13C NMR chemical shifts. A single rule to determine the conformation of calix[4]arenes[J].J Org Chem,1991,56:3372-3376.
[12] Struck O, Chrisstoffels L A J, Lugtenberg R J W. Head-to-head linked double calix[4]arenes:convenient synthesis and complexation properties[J].J Org Chem,1997,62:2487-2493.

