早期肠内营养对胃癌根治术后患者机体恢复及免疫功能的影响
许现芬 叶航
胃癌患者普遍存在不同程度的蛋白质-热量营养不良,加之手术创伤打击,使机体的脂肪储备进一步消耗,机体的免疫防御功能下降,使术后并发症发生的概率增加。目前认为术后早期肠内营养(EEN)有助于维持肠黏膜的结构和功能的完整,减少内毒素的细菌异位,改善肠黏膜缺血症状,提高防御机制,调节免疫反应,降低术后炎症反应,减少感染等并发症的发生。为探讨胃癌根治术后患者术后早期肠内营养的可行性及护理,我们对2009年12月至2011年12月因胃癌行胃癌根治术的患者术中经鼻置空肠营养管术后早期予以肠内营养治疗与护理,并与肠外营养患者的治疗护理进行比较分析,现报告如下。
1 资料与方法
1.1 一般资料 选取我院2009年12月至2011年12月行胃癌根治术患者78例,随机分为术后早期肠内营养组39例,术后肠外营养组39例。早期肠内营养组男24例,女15例,年龄42~70岁,平均(58.9±11.7)岁;肠外营养组男25例,女14例,年龄39~68岁,平均(57.5±12.1)岁。所有病例术前均常规行胃镜、病理活组织检查证实,术前均未化疗、放疗及应用激素等,无合并感染;两组患者在手术前营养状况、性别、年龄、病变部位、手术方式、失血及输血量、病理分期等方面进行比较,差异无统计学意义(P>0.05)。
1.2 营养及护理方法
1.2.1 术后早期肠内营养方法 术中置鼻肠管(无锡华瑞公司复尔凯鼻肠管)至空肠上段;术后24 h内给予早期的肠内营养支持。置患者于床头抬高30°~45°,防止胃内容物返流和潴留。术后12 h经鼻肠管缓慢输入等渗盐水500 ml,24 h起选用瑞素和等渗盐水按1∶1比例混合,由喂养泵24 h均匀输入,辅以加热器控制温度38℃~41℃,过冷易加快肠蠕动或导致肠痉挛。第1天的速度为30 ml/h,以后逐日增加20 ml/h,最快调速至120 ml/h,同时能量不足部分辅以肠外营养。
1.2.2 肠外营养方法 术后第1~6天每天输注脂肪乳剂、复方氨基酸及葡萄糖,热量为125 kJ/(kg·d),氮量为0.29/(kg·d)及多种维生素,微量元素等。
1.3 观察项目 监测生命体征,观察两组患者术后肠通气时间及住院时间,并于术前1 d和术后1、7 d分别采静脉血,采用流式细胞仪检测患者外周血 T细胞亚群(CD3+、CD4+、CD8+)及NK细胞(CD16+56)活性。
2 结果
2.1 两组患者术后通气时间及住院时间比较 术后早期肠内营养组患者术后通气时间早于肠外营养组 (P<0.05);肠内营养组患者平均住院时间短于肠外营养组 (P<0.05),见表1。
表1 两组患者术后通气时间及住院时间比较()
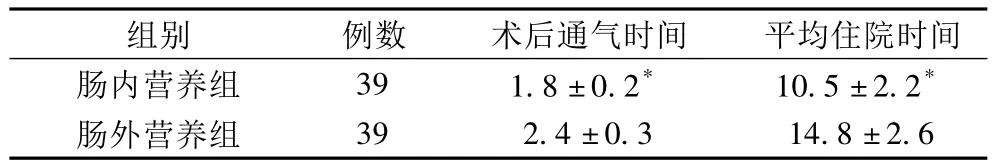
表1 两组患者术后通气时间及住院时间比较()
注:与肠外营养组比较,*P<0.05
组别 例数 术后通气时间 平均住院时间肠内营养组 39 1.8±0.2* 10.5±2.2*39 2.4±0.3 14.8±2.6肠外营养组
2.2 两组患者术前、术后T细胞亚群及NK细胞活性变化情况 两组患者术前T细胞亚群及NK细胞活性无显著差异(P>0.05);术后第1天,两组患者外周血 CD3+、CD4+、CD4+/CD8+及NK细胞活性较术前均显著降低(P<0.05),但两组之间比较无显著性差异(P>0.05);术后7 d,肠内营养组患者外周血CD3+、CD4+、CD4+/CD8+及NK细胞活性恢复至接近术前水平(P>0.05),而肠外营养组仍显著低于术前水平(P<0.05),且显著低于肠内营养组(P<0.05),见表2。
表2 两组患者术前术后T细胞亚群及NK细胞活性的动态变化()
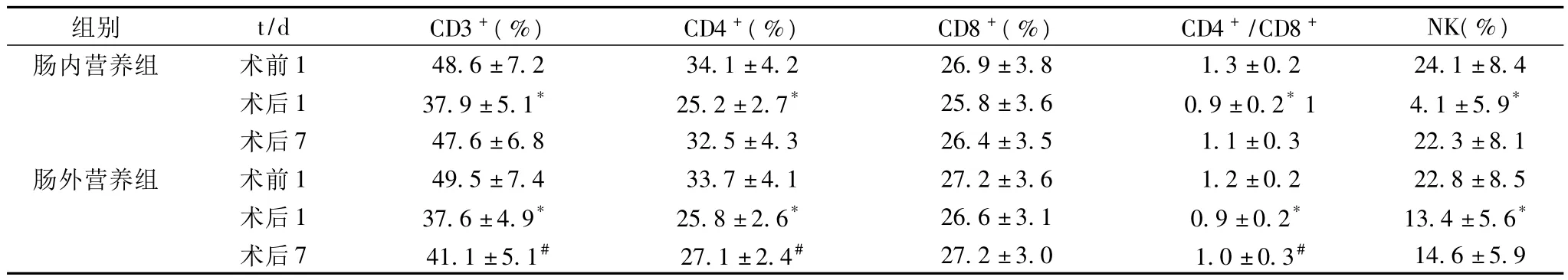
表2 两组患者术前术后T细胞亚群及NK细胞活性的动态变化()
注:术后第1天与术前比较,*P<0.05;术后第7天与术前比较,#P<0.05;
组别 t/d CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+ NK(%)肠内营养组 术前1 48.6±7.2 34.1±4.2 26.9±3.8 1.3±0.2 24.1±8.4术后1 37.9±5.1* 25.2±2.7* 25.8±3.6 0.9±0.2*1 4.1±5.9*术后7 47.6±6.8 32.5±4.3 26.4±3.5 1.1±0.3 22.3±8.1肠外营养组 术前1 49.5±7.4 33.7±4.1 27.2±3.6 1.2±0.2 22.8±8.5术后1 37.6±4.9* 25.8±2.6* 26.6±3.1 0.9±0.2* 13.4±5.6*术后7 41.1±5.1# 27.1±2.4# 27.2±3.0 1.0±0.3#14.6±5.9
3 讨论
近年来随着肿瘤免疫学研究的不断深入,已经明确细胞免疫是机体抗肿瘤免疫的主要方式,而NK细胞和T淋巴细胞是细胞免疫中的主要效应细胞。其中NK细胞是一类不需要特异性抗体参与即可杀伤肿瘤细胞的淋巴细胞,起着免疫监视的作用,是机体防御肿瘤的天然屏障;而根据T细胞表面分化抗原将成熟的T细胞分为CD4+和CD8+两大亚群,CD4+为辅助/诱导T细胞,具有协助体液免疫及细胞免疫的功能,CD8+为抑制性杀伤T细胞。CD4+协调B细胞分化产生抗体,CD8+则抑制抗体的合成、分泌及T细胞的增殖,两者的稳态维持着机体正常的免疫应答,比值降低说明机体免疫功能低下[1,2]。
胃癌患者往往需要行根治性胃切除术,该手术对患者打击大,加上此类患者长期不能正常进食而造成患者营养不良以及诸种因素,使患者免疫功能低下,术后并发症及死亡率较高。因此围术期应大力保护患者的营养及免疫功能[2]。早期肠内营养能提供足够的热量和氮源,促进总蛋白和应激蛋白的合成,尽快纠正机体的负氮平衡[3]。本组资料显示,胃癌患者术后早期CD3+、CD4+、CD4+/CD8+及NK细胞活性下降明显;但行早期肠内营养后1周患者外周血 CD3+、CD4+、CD4+/CD8+及NK细胞活性恢复至接近术前水平,而肠外营养患者仍显著低于术前水平,且显著低于早期肠内营养组;此外,早期肠内营养组患者肠功能恢复较快,住院时间相对较短;本研究结果说明早期肠内营养使患者机体恢复快,对机体免疫功能影响小;但是在进行肠内营养时要认真做好喂养管的护理,保证喂养管的有效固定,严格掌握输注方法以及相关知识,把握营养液的温度和输注速度,在输注过程中认真观察,定期监测患者血糖等[4-6],妥善固定喂养管道,按时冲管,避免管道堵塞。
[1]Crew KD,Neugut AL.Epidemiology of gastric cancer.World J Gastroenterol,2006,12(3):354-362.
[2]Yachida S,Sasako M,Tobinai K,et al.Successful treatment of a primarygastricT-cell lymphoma lacking the human T-cell leukemia virus type 1.Hepatogastroenterology,2010,57(98):383-387.
[3]夏铭,杨廷旭,王伟,等.胃癌患者T细胞亚群变化的临床意义.临床医学,2009,29(1):105-107.
[4]杜映,吴晓玲.肠内营养在胃癌患者两种术式中的应用效果探讨.护理进修杂志,2010,25(17):1577-1578.
[5]胡晓,王春菊,朱佳立.肠内免疫营养对老年胃癌患者的疗效观察及护理.护理实践与研究,2011,8(2):36-37.
[6]杨卯竹,温大翠,赵高平,等.合并糖尿病消化道肿瘤患者术后早期肠内营养支持的护理研究.护理实践与研究,2010,7(1):12-14.

