防黏连材料预防术后盆腔黏连的动物模型的构建
任 常,朱 兰,孙继超
1中国医学科学院 北京协和医学院 北京协和医院妇产科,北京 1007302中国医学科学院 北京协和医学院 医学实验动物研究所新药安全评价研究中心,北京 100032
·论著·
防黏连材料预防术后盆腔黏连的动物模型的构建
任 常1,朱 兰1,孙继超2
1中国医学科学院 北京协和医学院 北京协和医院妇产科,北京 100730
2中国医学科学院 北京协和医学院 医学实验动物研究所新药安全评价研究中心,北京 100032
目的在实验动物大耳白兔体内构建子宫术后盆腔黏连的动物模型,并观察黏连情况,以进一步评价防黏连材料对防止子宫创伤术后盆腔黏连的效果,探讨其可能的机制。方法制备大耳白兔双子宫角创伤术后盆腔黏连模型,对其围手术期及术后黏连情况进行观察。分别于术后3、7、14、28、42 d处死并观察实验动物盆腔黏连情况并评分。结果手术建模过程顺利,大耳白兔双子宫角模型可在三维状态下评价其盆腔黏连形成情况;纱布磨损、针持夹伤和直接损伤缝合均可引起大耳兔子宫手术后盆腔黏连,其中直接损伤大耳兔子宫更能模拟妇科术后盆腔情况。术后3 d是纤维蛋白吸收的关键时期,7 d是腹膜间皮修复所需要的时间,而胶原在术后14 d左右达峰值。术后28 d防黏连材料应已吸收,此时观察可以证实其防黏连效果以及防黏连材料的吸收。术后42 d能帮助了解防黏连材料消失后其防黏连效果是否能持续存在。结论直接损伤大耳白兔双子宫角模型是理想的妇科术后黏连实验动物模型。术后3、7、14、28及42 d 5个观察时间点可以帮助全面了解盆腔黏连的形成过程。
子宫;兔;动物模型;手术;盆腔黏连;防黏连材料
ActaAcadMedSin, 2012,34(2):109-115
腹腔黏连是正常情况下处于分离状态的腹腔脏器或组织间的异常纤维结构[1-2]。既往手术史、子宫内膜异位症、盆腔炎性疾病史等均可引起盆腹腔黏连,其中最常见的是盆腹腔手术史。盆腹腔黏连可能造成不孕、慢性盆腹腔疼痛、性交痛、肠梗阻等疾病[3-5],还会影响腹腔化疗的效果。有超过1/3的女性在妇科手术后会因为黏连相关问题再次入院[6]。而在患有黏连相关小肠梗阻的女性中,有50%的患者曾接受过妇科手术。黏连的形成也常使腹腔镜手术难度增加,甚至无法进行[7],即使能够进行,再次手术损伤的风险也增加。据统计,肠道损伤的发生率在再次开腹手术中达19%[8],而在腹腔镜黏连松解中也高达10%~25%[9]。理想的防黏连措施是能选择性阻断一个或多个主要因子的作用,而又不影响创面和组织的修复和愈合。针对这一点,目前已经开发出多种商品化防黏连材料。本研究通过在实验动物日本大耳白兔体内构建子宫创伤模型后,放置防黏连材料,观察其防黏连的效果,从而为临床防黏连材料的选择和使用提供参考。
材料和方法
实验动物日本大耳白兔,雌性,5~6月龄,性成熟,未孕未产,体重(2.48±0.32)kg,由中国医学科学院实验动物研究所提供,单笼饲养。术前至少隔离观察3 d。
实验材料和器械液态防黏连材料为水溶性医用几丁糖(上海其胜生物制剂有限公司),1 ml规格;隔膜防黏连材料为Interceed防黏连膜[强生(上海)医疗器材有限公司],7.6 cm×10.2 cm规格;麻醉药物戊巴比妥钠(美国Sigma公司);生理盐水(北京双鹤药业股份有限公司);手术材料和器械包括3-0薇乔可吸收缝线、1-0慕丝丝线、镊子、持针器等。
实验设计
预实验:目前文献报道最多的兔术后黏连模型主要是侧腹壁模型和双子宫角模型两种[10-11],而制造子宫创面的方法主要包括:机械损伤(磨损)、直接损伤(包括切开或局部切除器官或组织)、缺血损伤[10,12-13]。本研究预实验采用3种方法尝试构建兔子宫手术后盆腔黏连模型,每组2只大耳白兔,随机选择侧别,分别采取:(1)纱布擦伤子宫角部浆膜面直到出现点状出血;(2)持针器夹伤子宫角部浆膜面直到出现点状出血;(3)切开子宫角部浆膜及浅肌层后用3-0薇乔可吸收线缝合创面。术后14 d处死动物进行观察。
正式实验:采用随机对照盲法前瞻性实验研究,共分术后3、7、14、28和42 d 5个观测时间点,每个时间点实验动物采用计算机随机数方法随机分入。(1)对照组:手术制造子宫创面;(2)液态防黏连材料组:手术制造子宫创面+子宫创面涂布液态防黏连材料; (3)隔膜防黏连材料组:手术制造子宫创面+子宫创面覆盖隔膜防黏连材料。
确定样本量实验共有对照组、液态防黏连材料组和隔膜防黏连材料组3组,因此γ=3,取α=0.05,β=0.10,查表得λ=12.65。文献报道隔膜防黏连材料组盆腔手术后黏连发生的比例为25%,而对照组为78%[14];液态防黏连材料组腹部手术后肠黏连发生的比例为1.2%,而对照组为11%[15],根据公式

计算,n=20.2,样本量扩大1.1倍后为22,总的实验样本量为22×3×5=330只。
制备兔子宫手术后盆腔黏连模型
动物麻醉与准备:实验大耳白兔术前禁食10~12 h,称重并记录。3%戊巴比妥钠按0.8 ml/kg的剂量自耳缘静脉推注,一般可持续2~3 h。部分对戊巴比妥钠不敏感的大白兔,追加相当于初始剂量30%的戊巴比妥钠,可维持1.5~2 h。不需要呼吸机,术后也无须镇痛。实施麻醉成功后,动物取仰卧位,四肢妥善固定于动物专用手术台,剃除手术部位被毛,用络合碘消毒腹部术野,铺消毒洞巾。
手术步骤:手术操作均由同一术者按照实验设计施行。
(1)开腹探查。①取腹部正中纵形切口,距耻骨2 cm,长约4 cm,依次进腹;②找到子宫,双子宫,粉红,宫角长(图1);③观察并记录子宫及其周围脏器情况,注意有无黏连存在。
(2)制造子宫创面。①于宫体旁开2~3 cm部位纵行切开子宫浆膜及浅肌层,切口长度3 cm,避免伤及黏膜(图2);②3-0薇乔可吸收线间断全层缝合子宫创面浆膜及肌层,针距约1 cm,压迫后仍有出血的部位间断缝合止血(图3)。
(3)放置防黏连材料。①液态防黏连材料组:还纳子宫,恢复正常解剖结构后在子宫创面上喷涂液态防黏连材料,使之完全涂布于子宫创面(图4);②隔膜防黏连材料组:将隔膜剪成2.6 cm×3.8 cm大小,确保充分止血后,放置隔膜完全覆盖子宫创面,观察有无变色。如隔膜变成深棕色或黑色,弃去膜,再次止血后放置隔膜。证实其无变色后滴加1 ml生理盐水使之湿润,充分粘着于创面(图5)。还纳子宫,恢复其正常解剖结构。注意还纳过程中隔膜无移位。
(4)关腹:1-0慕丝丝线间断全层缝合腹壁(图6)。

图1 找到子宫及附件,子宫呈双角形Fig 1 Finding uterus and adnexa, the uterus is bicorn in shape
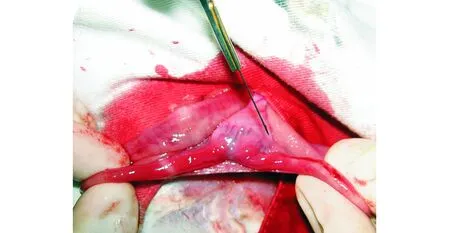
图2 纵行切开子宫浆膜及浅肌层Fig 2 Opening uterine serosa and superficial myometrium longitudinally

图3 缝合子宫创面Fig 3 Suturing uterine incision
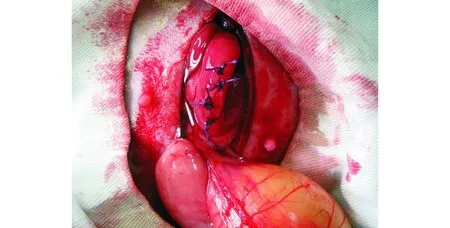
图4 还纳子宫后喷涂液态防黏连材料Fig 4 Returning uterus and applying liquid anti-adhesive material

图5 覆盖隔膜防黏连材料并湿润Fig 5 Covering with wet barrier anti-adhesive material

图6 关腹Fig 6 Closing abdomen
(5)手术完毕,大白兔一侧臀大肌肌注青霉素钠40万IU,置温暖处,注意保温,头部侧卧,保持呼吸道通畅,待其苏醒后送回兔笼。
术后护理:(1)术后12 h可进水,次日可进食;(2)术后3 d内,青霉素40万IU肌肉注射,每天2次,预防感染。
术后黏连评分的盲法判读由不清楚实验动物分组情况的术者对按实验设计时间点处死的实验动物进行解剖并判读,结果由专人记录。所有判读均由同一术者作出。
结 果
手术建模过程(1)在兔双子宫角术后盆腔黏连模型的构建中,发现雌性大耳白兔的内生殖器官解剖特点为:①子宫为双子宫,两个子宫颈分别开口于阴道,两侧宫角长约7 cm;②子宫血运主要来源于子宫血管,血管网分支供应双侧角部,出现创伤后出血多为渗血;③未孕未产的子宫肌层较薄,出现创伤后无明显的收缩止血反应;④双侧阔韧带厚,内有大血管走行;⑤膀胱位于宫颈及阴道上段前方,表面可见丰富血管网;⑥子宫与周围组织,如直肠的间隙较为疏松。(2)正式实验中1只白兔死于麻醉意外。1只白兔于第1次麻醉后出现呼吸困难、紫绀,未行手术,给予保温后逐渐恢复。1周后再次麻醉,未再出现症状,手术顺利实施。另有2只白兔分别于剃毛和切皮时出现躁动,麻醉加量后顺利实施手术。其余白兔麻醉均满意。所有白兔手术过程均顺利,术中出血不多,平均手术时间(17±5)min,术中生命体征平稳。
术后观察术后每日观察动物的活动及进食情况并记录。术后24~48 h食欲基本恢复,术后4 d运动量基本恢复同术前。术后28 d组有1只白兔于术后4 d出现意外死亡,尸检肝脏被膜下可见点状出血,其余各重要脏器外观未见明显异常。
动物处死时间与取材所有大耳白兔按照实验设计分别于术后3、7、14、28和42 d经耳大静脉注射空气栓塞处死。消毒手术野后于距离原手术切口3 cm位置“U”字形剪开腹壁,充分暴露盆腹腔脏器及腹膜,见所有实验动物腹膜均愈合良好。
预实验:术后14 d处死动物,纱布擦伤组两只动物分别出现:(1)创面与肠管膜状黏连1.5 cm,创面下方阔韧带与膀胱后壁膜状黏连4 cm;(2)创面与肠管膜状黏连2.5 cm。持针器夹伤组的黏连分别表现为:创面与对侧子宫角致密黏连1 cm和创面与膀胱致密黏连3 cm。切开子宫+缝合组的黏连情况分别为:(1)创面与膀胱后壁膜状黏连3 cm,创面与周围子宫浆膜致密黏连,术侧子宫后壁与肠管疏松黏连1 cm;(2)创面与膀胱后壁膜状黏连2 cm, 自身疏松黏连1.5 cm。3种方法均可造成子宫术后盆腔黏连,直接切开子宫+缝合的方式更接近妇科子宫手术,故其后的正式实验选择直接损伤造成子宫创面。
正式实验:盲法观察并记录所见子宫及其与周围脏器之间的黏连情况、盆腹腔其他异常情况,如:腹水性状等。术后14 d组有1只白兔打开腹壁后见大量新鲜的出血,探查发现腹主动脉于肾动脉水平破裂,破裂部位远离“U”字形切口范围。
术后盆腔黏连发生的部位:术后盆腔黏连主要发生在子宫自身(包括与对侧)、子宫与阔韧带、子宫与膀胱、子宫与肠管(包括肠系膜)、子宫与前腹壁(表1)。

表 1 术后不同时间盆腔黏连的发生部位分布(%)
因同一动物模型可能存在多个部位的黏连,故各时间点黏连分布例数之和超过该时间点动物模型总数
Since adhesions of several locations can be observed in one animal model, the sum of all adhesions is greater than the whole number of animals employed at one time point
讨 论
盆腔黏连研究中实验动物的选择目前应用于盆腹腔黏连研究的实验动物包括大鼠、小鼠、家兔、犬、猪等多个品系,其中大鼠和家兔是目前文献报道应用最广的两种实验动物[10-13,16-21]。与大鼠相比,家兔虽然价格更高、术后护理要求也更高,但其体型更适合手术操作及术后黏连情况的观察。本研究显示雌性大耳白兔的内生殖器官解剖特点为:(1)完全的双子宫,角部长,手术操作的范围较大,故手术部位适合选择子宫角部;(2)子宫血运主要来源于子宫血管,血管网分支供应双侧角部,出现创伤后出血多为渗血,所以在缝合子宫创面时避免缝合过密、打结过紧造成缺血;缝合后如仍有渗血,可先压迫数秒钟,此时部分渗血即可止住,而不需要再增加创面的缝线数量,影响黏连形成;(3)未孕未产的子宫肌层较薄,故而在切开和缝合时应注意深度,以免伤及黏膜层;(4)双侧阔韧带厚,内有大血管走行,在手术过程中要尽量避免损伤阔韧带;(5)膀胱位于宫颈及阴道上段前方,血运丰富;而子宫与肠管间的间隙较为疏松,这可能是本研究发现膀胱与子宫间黏连形成比例较高的原因[10]。选择家兔另一个重要的原因是家兔的纤溶系统跟人的最为接近[18-19],而纤溶系统的变化是黏连形成机制中最重要的一环[20-21]。
子宫术后盆腔黏连动物模型的构建目前已有多种家兔动物模型被用于研究术后盆腹腔黏连,其中应用较广的主要是侧腹壁模型和双子宫角模型两种[10-11]。前者是通过磨损等方法造成肠道的损伤(通常是盲肠),同时通过切除部分腹膜及肌层造成腹壁的创面,用于观察肠道与侧腹壁的黏连情况,因此侧腹壁模型通常被用来进行外科手术研究。而双子宫角模型由于其手术操作及黏连形成部位的原因,更适合用于妇科手术相关黏连情况的研究。从解剖结构上说,应用双子宫角模型研究黏连比侧腹壁模型更复杂,因为后者形成的黏连只是二维的(仅在腹壁和肠道的创面之间),而双子宫角模型是在三维状态下评估盆腔脏器的黏连形成情况。本研究充分证实了这一点:黏连可以形成于子宫创面与其旁的子宫浆膜之间,也可以形成于子宫与前方的膀胱和后面的肠管之间,还可以形成于子宫与前腹壁之间。子宫创面可能形成的黏连的维度之广充分证明双子宫角模型对研究盆腔手术后黏连形成是适合的。
同样在各项实验研究中造成创伤的方法也是多种多样的,总结起来主要有机械损伤(磨损)、直接损伤(包括切开或切除部分器官或组织)、缺血损伤、腹腔内放置异物(例如:滑石粉、移植物等)等[10,12-13,22-23]。本研究的预实验结果显示不论是磨损、夹伤还是直接切开子宫造成创面均能有效地引起盆腔黏连。因此在都能引起盆腔黏连的情况下,本研究采用直接切开子宫浆膜及浅肌层的方法以更准确地模拟临床中子宫切口情况。
子宫术后盆腔黏连形成的部位本研究预实验可以看出子宫术后黏连的发生率较高。英国的一项临床研究显示每25例子宫手术后即有1例因术后相关黏连入院,仅次于附件手术[24]。尽管盆腔术后黏连的发生日渐受到妇产科医生的重视,但针对其黏连好发部位的研究却相对较少,并且不同文献报道也存在差异。Cheong等[25]的临床研究显示盆腹腔术后各部位黏连发生比例为:子宫、侧腹壁及直肠窝100%,肠管88%,附件、大网膜和前腹壁75%,膀胱反折63%,膀胱25%。另一项研究报道妇科术后肠道黏连的发生率明显低于前者:小肠黏连发生率仅为9%,结肠黏连的发生率约为17%[26]。
本研究子宫自身及其与对侧的黏连最为常见,占50%以上,而子宫与膀胱的黏连占35%以上,居第2位。阔韧带的黏连约为10%,仅次于膀胱的黏连。其他部位的黏连,包括肠管、前腹壁等相对较少。与前述临床研究结果不相同的原因主要为体位关系。人类由于大部分时间都是直立行走,因此,直肠窝等低垂部位常是富含纤维蛋白和细胞成分的腹腔液积聚的位置,为黏连的形成提供了有利条件。而人类的乙状结肠和直肠由于生理性黏连的关系,位置相对比较固定,因此相对较易形成黏连。本研究的实验动物—兔通常为匍匐状态,子宫由于重力作用紧贴膀胱,并且血运丰富,在创伤条件下有利于黏连的形成,这可能是本研究发现膀胱与子宫之间黏连形成比例较高的原因[10]。而子宫与肠管间的间隙较为疏松,且兔子的肠管活动性较大,因此子宫与肠管的黏连比较少见。同时由于其子宫的特殊形态使其双侧子宫之间接触的机会较多,在手术创伤后易于形成自身或与对侧的黏连。家兔的阔韧带内有丰富的血管,且具有较大面积,因此也是黏连好发的部位。
盆腔黏连动物模型观察时间点的选择文献报道盆腔黏连实验研究观察时间点的选择有术后3 d、7 d、10 d、2周、3周、4周、5周、6周及8周,有的甚至在术后52周再处死动物进行观察[11,13,16-21,24]。目前尚无一种时间点的选择获得所有学者的一致认可。
本研究根据实验研究对象决定各组实验终止和观察的时间。术后黏连形成过程是一个涉及炎症反应、组织修复、血管生成和神经支配及其相互作用的复杂的生化过程[27]。其中纤溶系统的异常是重要的机制[20-21]。正常情况下,大部分纤维蛋白性黏连都会在3 d内被纤溶系统溶解,从而阻断后续纤维黏连的形成[2]。选择该时间点能帮助了解两种防黏连材料是否在这个阶段即对黏连的形成进行阻断,进而可以推测其作用机制。
术后7 d,间皮的细胞结构基本恢复正常,创面为间皮所覆盖,腹膜得以愈合。此时观测可以了解防黏连材料是否会影响腹膜的愈合。
在细胞因子和各类细胞作用的同时,基质内的胶原蛋白发挥着重要的作用[28]。一般在术后10d胶原开始合成,到了术后2周,胶原的形成达到峰值[28],因此此时取材能更好地了解动物体内胶原的形成情况,进而更好地了解其黏连形成情况。作为一种可吸收的防黏连材料,隔膜会在4周内完全降解吸收[28-29]。选择这个时间点进行观测可以证实膜已消失并评价此时的防黏连效果。
术后6周作为最后一个观测点可以帮助了解在两种防黏连材料都完全消除之后,其防黏连的作用是否能持久。选择术后3、7、14、28和42 d这5个时间点有利于全面了解这两种材料在不同时期的防黏连效果并帮助了解其防黏连作用的机制。
[1]Vrijland WW, Jeekel J, van Geldorp HJ, et al. Abdominal adhesions: intestinal obstruction, pain, and infertility[J]. Surg Endosc,2003, 17(7):1017-1022.
[2]Sulaiman H, Dawson L, Laurent GJ, et al. Role of plasminogen activators in peritoneal adhesion formation[J]. Biochem Soc Trans, 2002,30(2):126-131.
[3]Practice Committee of the American Society for Reproductive Medicine,Society of Reproductive Surgeons. Pathogenesis, consequences and control of peritoneal adhesions in gynecologic surgery[J]. Fertil Steril, 2007,88(1):21-26.
[4]Ido K, Urushidani H. Fibrous adhesive entrapment of lumbosacral nerve roots as a cause of sciatica[J]. Spinal Cord, 2001,39(5):269-273.
[5]Howard FM, El-Minawi AM, Sanchez RA. Conscious pain mapping by laparoscopy in women with chronic pelvic pain[J]. Obstet Gynecol, 2000, 96(6):934-939.
[6]Lower AM, Hawthorn RJS, Ellis H, et al. The impact of adhesions on hospital readmissions over ten years after 8849 open gynaecological operations: an assessment from the Surgical and Clinical Adhesions Research Study[J]. Br J Obstet Gynaecol, 2000,107(7):855-862.
[7]Dijkstra FR, Nieuwenhuijzen M, Reijnen MM, et al. Recent clinical developments in pathophysiology, epidemiology, diagnosis and treatment of intra-abdominal adhesions[J]. Scand J Gastroenterol, 2000,232( Suppl):52-59.
[8]Van Der Krabben AA, Dijkstra FR, Nieuwenhuijzen M, et al. Morbidity and mortality of inadvertent enterotomy during adhesiotomy[J]. Br J Surg, 2000, 87(4):467-471.
[9]Swank DJ, Swank-Bordewijk SCG, Hop WCJ, et al. Laparoscopic adhesionlysis in patients wityh chronic abdominal pain: a blinded randomised controlled multi-centre trial[J]. Lancet, 2003, 361(9365):1247-1251.
[10]Müller SA, Weis C, Odermatt EK, et al. A hydrogel for adhesion prevention: characterization and efficacy study in a rabbit uterus model[J]. Eur J Obstet Gynecol Reprod Biol, 2011,158(1):67-71.
[11]Cooper K, Young J, Wadsworth S, et al. Reduction of post-surgical adhesion formation with tranilast[J]. J Surg Res, 2007,141(2):153-161.
[12]Molinas CR, Elkelani O, Campo R, et al. Role of the plasminogen system in basal adhesion formation and carbon dioxide pneumoperitoneum-enhanced adhesion formation after laparoscopic surgery in transgenic mice[J]. Fertil Steril, 2003,80(1):184-192.
[13]Martín-Cartes J, Morales-Conde S, Surez-Grau J, et al. Use of hyaluronidase cream to prevent peritoneal adhesions in laparoscopic ventral hernia repair by means of intraperitoneal mesh fixation using spiral tacks[J]. Surg Endosc, 2008,22(3):631-634.
[14]Franklin RR. Reduction of ovarian adhesions by the use of Interceed. Ovarian Adhesion Study Group[J]. Obstet Gynecol, 1995,86(3):335-340.
[15]王卫英, 单人骥. 医用几丁糖预防术后肠黏连1496例[J]. 江西医药, 2009,44(7):44-45.
[16]Asano T, Takazawa R, Yamato M, et al. Transplantation of an autologous mesothelial cell sheet prepared from tunica vaginalis prevents post-operative adhesions in a canine model[J]. Tissue Eng, 2006,12(9):2629-2637.
[17]Aysan E, Ayar E, Aren A, et al. The role of intra-peritoneal honey administration in preventing post-operative peritoneal adhesions[J]. Eur J Obstet Gynecol Reprod Biol, 2002,104(2):152-155.
[18]Häggroth L, Mattsson C, Friberg J. Inhibition of the human tissue plasminogen activator in plasma from different species[J]. Thromb Res, 1984,33(6):583-594.
[19]Abrahamsson T, Nerme V, Strömqvist M, et al.Anti-thrombotic effect of a PAI-1 inhibitor in rats given endotoxin[J]. Thromb Haemost, 1996,75(1):118-126.
[20]Xu X, Pappo O, Garbuzenko E, et al. Mast cell dynamics and involvement in the development of peritoneal adhesions in the rat[J]. Life Sci, 2002,70(8):951-967.
[21]Pryor HI 2nd, O’Doherty E, Hart A, et al.Poly(glycerol sebacate) films prevent postoperative adhesions and allow laparoscopic placement[J]. Surgery, 2009,146(3):490-497.
[22]Dörr PJ, Vemer HM, Brommer EJ, et al. Prevention of postoperative adhesions by tissue-type plasminogen activator (t-PA) in the rabbit[J]. Eur J Obstet Gynecol Reprod Biol, 1990,37(3):287-291.
[23]Snoj M, Ar’Rajab A, Ahren B, et al. Phospholipase-resistant phosphatidylcholine reduces intra-abdominal adhesions induced by bacterial peritonitis[J]. Res Exp Med, 1993,193(2):117-122.
[24]Bakkum EA, Emeis JJ, Dalmeijer RA, et al. Long-term analysis of peritoneal plasminogen activator activity and adhesion formation after surgical trauma in the rat model[J]. Fertil Steril, 1996,66(6):1018-1022.
[25]Cheong YC, Laird SM, Shelton JB, et al. The correlation of adhesions and peritoneal fluid cytokine concentrations: a pilot study[J]. Hum Reprod Update, 2002,17(4):1039-1045.
[26]Ellis H. The clinical significance of adhesions: focus on intestinal obstruction[J]. Eur J Surg Suppl, 1997,577:5-9.
[27]Reed KL, Fruin AB, Bishop-Bartolomei KK, et al. Neurokinin-1 receptor and substance P messenger RNA levels increase during intraabdominal adhesion formation[J]. J Surg Res, 2002,108(1):165-172.
[28]Gago LA, Saed G, Elhammady E, et al. Effect of oxidized regenerated cellulose (interceed) on the expression of tissue plasminogen activator and plasminogen activator inhibitor-1 in human peritoneal fibroblasts and mesothelial cells[J]. Fertil Steril, 2006,86(Suppl 4):1223-1227.
[29]Reddy S, Santanam N, Reddy PP, et al. Interaction of interceed oxidized regenerated cellulose with macrophages: a potential mechanism by which Interceed may prevent adhesions[J]. Am J Obstet Gynecol, 1997,177(6):1315-1320; discussion 1320-1321.
CreationofAnAnimalModelforPost-operativeAdhesionPrevention
REN Chang1, ZHU Lan1, SUN Ji-chao2
1Department of Obstetrics amp; Gynecology, PUMC Hospital, CAMS and PUMC, Beijing 100730, China
2Centre of Drug Safety Evaluation and Research, Institute of Laboratory Animal Sciences,
CAMS and PUMC, Beijing 100032,China
ZHU Lan Tel:010-65295647, Fax:010-65295284, E-mail:zhu_julie@vip.sina.com
ObjectiveTo establish a rabbit double uterine horn model for assessing the time-course of pelvic adhesions and evaluating the effectiveness of different anti-adhesive materials in reducing adhesions.MethodsA total of 330 Japanese white rabbits underwent laparotomy, followed by uterine horn incision. Animals were euthanized after 3, 7, 14, 28, and 42 days, respectively.ResultsThe surgical procedure was smooth. Rabbit double uterine horn model was applied for the evaluation of pelvic adhesions in a three-dimension fashion. Each of the three means-gauze abrasion, needle holder clamping, and direct uterine incision induced postoperative pelvic adhesions, among which direct uterine incision was the best to mimic conditions after gynecological operations. Under normal circumstances, degradation of filmy fibrinous adhesions by locally released proteases of the fibrinolytic system occured within 3 days of injury. The regeneration of the mesothelium was completed within 7 days. Collagen reached its peak by day 14. Anti-adhesive materials were supposed to be completely absorbed by day 28, and their effectiveness in preventing pelvic adhesions was confirmed at this time point. Whether their effect can be maintained after the absorption of the anti-adhesive materials was investigated in 42 days.ConclusionsThe animal model was successfully established. It well mimics the postoperative pelvic adhesions after direct uterine horn injury and thus is a suitable model for studying site-specific adhesions. Observations on the 3rd, 7th, 14th, 28th, and 42nd post-operative days provided a full picture of the adhesion formation process.
uterus; rabbit; animal model; surgery; pelvic adhesion; anti-adhesive barrier
朱 兰 电话:010-65295647,传真:010-65295284,电子邮件:zhu_julie@vip.sina.com
R713.1
A
1000-503X(2012)02-0109-07
10.3881/j.issn.1000-503X.2012.02.003
2011-06-30)

