微矩阵电极在人类多功能干细胞分化的心肌细胞上的应用
卢珺 Heming Wei张广钦
微矩阵电极系统(Multielectrode array,MEA)是一个进行体外实验的简易且具有创新意义的研究工具。其包括数据采集系统,MEA信号放大器和温控系统,MEA信号放大器的核心部件含有60个钛金微电极。通过MEA信号放大器可记录到细胞及组织(心肌,脑片和肌肉)的电生理信号。数据可由内置软件计算分析。
自MEA问世30多年以来,相关的技术不断改进。因其高效快捷的特点,MEA技术受到越来越多研究者的重视。其应用范围从最初的脑片扩展到到体外培养的细胞以及多功能干细胞,如小鼠和人类的胚胎干细胞 (Embryonic stem cells,ESC)以及诱导多功能干细胞分化为神经细胞或者心肌细胞。多功能干细胞分化的心肌和神经细胞可反映人类在体细胞的生理特性,故可作为有价值的体外(细胞)疾病模型和药物筛选工具,甚至自体细胞治疗。目前,包括抗心律失常药在内的许多心血管药物都作用于不同的离子通道。然而,抗心律失常药同样会导致心律失常的副作用[1]。诸如小鼠等动物模型被应用于研究遗传型心律失常患者的基因突变的功能性改变。但因为小鼠与人类在心肌上离子通道的类型和分布存在差异,且小鼠动作电位时程更短,心律更快(=600bpm),因此小鼠模型不能显现出与人类相同的表现型[2]。2007年,科学家利用 c-Myc,Oct3/4,SOX2,Klf4这4种转录因子组合或者Oct-4,Sox2,Nanog,Lin 28将人的体细胞重编程为iPS细胞[3,4]。iPS的问世,为药物开发的早期工作中,特别是对药理、代谢和毒性评价提供了人类各种细胞的生理模型。MEA系统作为一个简单新颖的实验工具,可对iPS分化的心肌细胞进行长期的体外研究。其具有简单高效的优点,可广泛应用于离子通道药物筛选和基础研究。本实验将hiPSC-CMs与MEA系统的有机结合,可直接评估心血管药物的有效性。从长远考虑,我们的模型可用于个体化用药研究,并有利于检测心血管药物的安全性和有效性。
本文旨在探讨应用MEA系统研究人类多功能干细胞分化的心肌细胞电生理特性,并建立稳定高效的心血管药物筛选平台。本文主要探讨MEA技术在人类诱导性多功能干细胞分化的心肌细胞的应用。
1 材料与方法
1.1 MEA系统仪器与软件 仪器:微矩阵电极系统(MultichannelSystems,Reutlingen,Germany)。微矩阵电极芯片(MultichannelSystems,Reutlingen,Germany)60个钛金微电极(30 μm),电极间距为200 μm。温度控制系统(MultichannelSystems,Reutlingen,Germany)。软件:MC_Rack采集分析软件(Multichannel Systems)。
1.2 细胞和培养基 人类诱导性多功能干细胞分化的心肌细胞(新加坡国家心脏中心提供)。培养基:低糖基础培养基+20%胎牛血清 +1%谷氨酰胺+1%青霉素+1%链霉素(Sigma公司购买)。其他材料:0.1% 明胶。
1.3 方法
1.3.1 微矩阵电极芯片的清洗和处理 实验前,将微矩阵电极芯片浸泡于75% 酒精2 h,擦干后置于超净台,紫外光照射20 min,备用。
1.3.2 心肌细胞团选择与转移 显微操作下,选择节律性跳动,强力收缩,心律为30~60/min,且直径在500 μm以上iPS分化的心肌细胞团为操作对象,将其切割下来,并置于0.1% 明胶处理的MEA芯片上,确保心肌细胞团置于并覆盖在微电极表面。(图1和图2)。小心地加入细胞培养基。将芯片置于直径为100毫米的细胞培养皿中并放入37℃的CO2培养箱内培养72 h。

图1 微矩阵电极
1.3.3 实验记录 至细胞团稳定贴附于MEA芯片后,启动加热系统,调节温度至37℃。将微矩阵电极芯片放入微矩阵记录系统,打开MC_Rack采集分析软件,开始采集心肌细胞电生理信号。待场电位信号稳定后,开始记录,记录时间为180 s,整个实验在37℃下进行,心肌细胞团维持在培养基中。
1.3.4 数据分析 应用MC_Rack分析软件对记录到的hiPSC-CMs的场电位(FPD)和心率进行分析,利用Bazzet公式cFPD=FPD/√(RR interval)计算场电位时程。
2 结果
2.1 人类多功能干细胞分化的心肌细胞培养与电生理记录本实验成功将分化的心肌细胞团贴附于微矩阵电极芯片,并保持节律性跳动,为进行长时间的心血管药物筛选和基础研究提供了保障。该实验成功记录到人类多功能干细胞分化的心肌细胞的场电位。由于心肌细胞团的大小和所处的位置不同,并非所有微电极都可检测到电信号,图3为60个电极分别记录的细胞团体外电信号的变化。

图2 人类多功能干细胞分化的心肌细胞
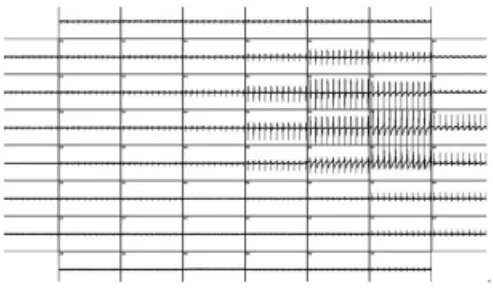
图3 60个电极记录的心肌细胞场电位

图4 TTX对iPS心肌细胞的影响
2.2 河豚毒素(TTX)对人类多功能干细胞分化的心肌细胞 场电位的影响 由图4可见,场电位含有快速去极化下降支,平台期和复极相。河豚毒素为Na+通道特异性阻断剂,10 M的TTX降低心率,并阻断Na+电流,缩短FP min的幅度(图 5a,b)。
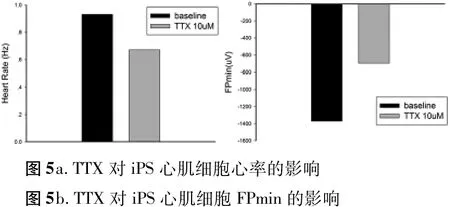
图5
3 讨论
人类多功能干细胞分化的心肌细胞形成的体外模型与MEA系统相结合可作为临床高效安全的心血管药物筛选平台。本实验旨在通过应用MEA系统研究人类多功能干细胞分化的心肌细胞电生理特性,并建立稳定高效的心血管药物筛选平台。
为证明MEA系统是否可作为理想的心血管药物筛选工具,我们以人类多功能干细胞分化的心肌细胞团作为体外试验的对象,将其贴于微矩阵电极芯片,记录心肌细胞的电生理信号以及药物反应,研究心肌细胞场电位和心率。本实验记录到的电生理信号与人类胚胎干细胞分化的心肌细胞相似,并保持节律性跳动,从而可进行长时间的心血管药物筛选测试和基础研究。
文献报道场电位时程与动作电位时程存在线性关系[5]。此外,场电位快速负偏倚与Na+通道活动有关,FPslow反映的是动作电位平台期L型Ca2+通道的活动[5,6]。因此,依据其良好的时间空间分辨率,MEA系统可用于研究类似于动作电位的场电位特性。
不同心血管药物可作用于不同的离子通道,动作电位的去极化是由于大量的钠通道开放引起的钠离子大量、快速内流所致。河豚毒素(TTX)作为钠通道阻断剂,可阻断钠离子活动。实验结果显示心肌细胞团经10 M的TTX处理过后,心率降低,FP min明显缩短。证明MEA系统可用于药物对心肌细胞电生理特性的研究。
同胚胎干细胞一样,小鼠iPS细胞和人类iPS细胞均可以分化成心肌细胞[7-9]。解决了由于缺少人自身的细胞模型而造成的药物检测程序费时费力,价格昂贵,效率低下和不准确等不良因素。Moretti等[10]成功的从LQT患者的皮肤成纤维细胞诱导成iPS并定向分化成心肌细胞,重现了心电图所观察的QT间期的延长。人类胚胎干细胞和人类诱导的多功能干细胞诱导的心肌细胞(hESC-CMs和hiPSC-CMs)均可用于对心脏毒性筛选的研究[11]。而且,心血管药物直接作用于患者自身的hiPSC-CMs更具有临床意义[12-13]。MEA系统可成功记录心肌细胞的电生理信号并可评价药物对心肌细胞的作用,有利于在药物研发过程中评价剂量依赖性和不良反应的关系[14]。
在实验过程中,需注意以下三点:①选择心肌细胞团时,以节律性强力收缩,心律在0.5~1 Hz范围,且直径在500 μm以上的心肌细胞为宜。在切割心肌细胞团时可适当切取心肌细胞团周围的成纤维细胞,有利于心肌细胞团贴附于MEA芯片。②因为在培养过程中,由于心肌细胞团的强力自发跳动,会出现移位现象,而导致电极不能检测到电信号。故hiPSC-CMs必需稳定的覆盖于MEA芯片电极表面,确保电极可采取到新信号。③在进行数据分析时,须利用Bazzet公式cFPD=FPD/√(RR interval)计算场电位时程,排除心率对场电位时程的干扰。
本实验以人类多功能干细胞分化的心肌细胞为研究对象,应用MEA系统记录细胞外电生理特性。在证实MEA系统可用于长期的体外模型实验,并为因缺乏适合的疾病模型而导致的生理病理研究铺平道路。其次,与一般急性分离的心肌细胞相比,多功能干细胞分化的心肌细胞可长时期培养,有利于研究者进行短期或长期研究。hPSC-CMs培养于微矩阵电极芯片上可进行多次反复的检测。另外,MEA系统具有操作简单,高效快速的特点,在未来的临床研究中,作为高通量心血管药物临床筛选工具进行大规模的药物试验研究。
[1]Morganroth J.Proarrhythmic effects of antiarrhythmic drugs:evolving concepts.Am Heart J,1992,123(4):1137-1139.
[2]Papadatos GA,Wallerstein PM,Head CE,et al.Slowed conduction and ventricular tachycardia after targeted disruption of the cardiac sodium channel gene Scn5a.ProcNatl Acad Sci U S A,2002,99:6210-6215.
[3]Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors.Cell,2007,131:861-872.
[4]Yu J,Vodyanik MA,Smuga-Otto K,et al.Induced pluripotent stem cell lines derived from human somatic cells.Science,2007,318:1917-1920.
[5]Halbach M,Egert U,Hescheler J,et al.Estimation of action potential changes from field potential recordings in multicellular mouse cardiac myocytes cultures.Cell Physiol Biochem,2003,13:271-284.
[6]Morad M,Tung L.Ionic events responsible for the cardiac resting and action potential.Am J Cardiol,1982,49:584-594.
[7]Schenke-Layland K,Rhodes KE,Angelis E,et al.Reprogrammed mouse fibroblasts differentiate into cells of the cardiovascular and hematopoietic lineages.Stem Cells,2008,26:1537-1546.
[8]Narazaki G,Uosaki H,Teranishi M,et al.Directed and systematic differentiation of cardiovascular cells from mouse induced pluripotent stem cells.Circulation,2008,118:498-506.
[9]Zhang J,Wilson GF,Soerens AG,et al.Functional cardiomyocytes derived from human induced pluripotent stem cells.Circ Res,2009,104:30-41.
[10]Moretti A,Bellin M,Welling A,et al.Patient-speci cinduced pluripotent stem-cell models for long-QT syndrome.N Engl J Med,2010,363:1397-1409.
[11]Braam SR,Tertoolen L,van de Stolpe A,et al.Prediction of drug-induced cardiotoxicity using human embryonic stem cell-derived cardiomyocytes.Stem Cell Res,2010,4(2):107-116.
[12]Shiba Y,Hauch KD,Laflamme MA.Cardiac applications for human pluripotent stem cells.Curr Pharm Des,2009,15(24):2791-2806.
[13]Kamp TJ,Lyons GE.On the road to iPS cell cardiovascular applications.Circ Res,2009,105(7):617-619.
[14]Tanaka T,Tohyama S,Murata M,et al.In vitro pharmacologic testing using human induced pluripotent stem cell-derived cardiomyocytes.Biochem Biophys Res Commun,2009,385:497-502.

