补肾活血方对激素性股骨头坏死大鼠BMSCs分化影响的研究*
帅 波 沈 霖 杨艳萍 谢 晶 周丕琪 徐晓娟 李成刚 伍满香
华中科技大学同济医学院附属协和医院中西医结合骨科,武汉 430022
股骨头缺血性坏死(ischemic necrosis of the femoral head,INFH)是严重影响人类健康的重要疾病之一。INFH为现代医学之名,属于中医的“骨蚀”、“骨痰”、“骨痹”、“血痹”、“骨痿”等范畴。INFH 的治疗关键为骨的修复和血管新生,传统中医药在治疗早期INFH方面体现出明显的优势。补肾活血方为青娥丸加味而成,具有“补肝肾、益气血、生髓骨”的功效,在治疗早期INFH方面取得良效。随着分子生物学的飞速发展,骨髓间充质细胞(bone marrow stromal cells,BMSC)的分化及其调控在股骨头缺血性坏死的预防和治疗中起着重要的作用,其相关研究近年来成为热点[1]。本实验拟采用含药血清干预的方法,探讨补肾活血方对激素性INFH股骨近端骨髓间充质细胞的成骨分化及转化生长因子-β1(transforming growth factor beta-1,TGF-β1)mRNA 的影响,从细胞及分子学角度探讨补肾活血方治疗激素性INFH的机制。
1 材料与方法
1.1 主要仪器及试剂
流式细胞仪(Becton-Dickinson,美国)、双面超净工作台(国产)、二氧化碳培养箱(Sheldon,美国)、倒置相差显微镜(Olympus,日本)、紫外分光光度计(天津天光光学仪器有限公司)、LG-DMEM干粉培养基(Gibco,美国)、胎牛血清(Gibco,美国)、胰蛋白酶干粉(Sigma,美国)、碱性磷酸酶试剂盒(上海虹桥医用试剂研究所)、β-甘油磷酸钠(Sigma,美国)、重组人骨形态发生蛋白-2(recombinant human bone morphogenetic protein-2,rhBMP-2)(R&D公司,美国)。
1.2 补肾活血方制剂的制备
补肾活血方为古方青娥丸加味制作:取杜仲(盐炒)960g,补骨脂(盐炒)480g,核桃仁(炒)300g,丹参480g,蒸大蒜240g,饮片洗净,置多功能提取器中,加5倍量水浸泡2h后,加热煎煮2h,药液过滤,药渣再水煎煮2次,每次1h,合并3次药液,浓缩至稠膏状(100%),趁热倒入3倍量95%乙醇中,边加边搅拌,静置24h后过滤。滤液回收乙醇,浓缩至每ml相当于生药2g,加1倍量蒸馏水,通过已转成氢型并洗至中性的732型阳离子交换树脂(用量为药材重量的25%,V/W)柱,有效成分被吸附于树脂上,然后用2%氢氧化钠洗脱,用10%盐酸调整pH至7,浓缩,4℃冰箱冷藏备用。
1.3 含药血清的制备
根据李仪奎[2]方法,取40只雄性SD大鼠(购自华中科技大学同济医学院实验动物中心),随机分为4组,每组10只。中药组灌胃给药,高浓度组给药2.0 ml,中浓度组给药1.0ml,低浓度组给药0.5ml。每天1次,连续3d,在末次给药2h后采血,分离血清,56℃灭活30min,过滤分装,置-20℃冰箱备用。对照组按以上方法用生理盐水1.0ml灌胃,制备普通血清。在实验时,各组均采用终浓度为10%的不同血清。
1.4 BMSC的分离培养与鉴定
按李雄等[3]方法建立实验用激素性INFH大鼠模型,8只雄性SD大鼠,用醋酸强的松龙49mg/kg臀肌注射,每天1次,连续注射6d后,于第7天处死,抽取4~5ml骨髓,置入装有DMEM培养液的20ml无菌离心管中,以Percoll(密度为1.073g/ml)为分离介质,用梯度离心法分离单个核细胞。多次洗涤后重新悬浮于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2培养箱中,3~5d后换液,去除未贴壁的细胞,每3d换液1次,每天观察细胞形态、贴壁及生长情况。待细胞融合达80%~90%,用0.25%胰蛋白酶消化、传代。收集第3代BMSC,流式细胞仪分别检测CD34、CD90、CD44和CD45等抗原的表达。
1.5 细胞分组培养
将空白对照血清(A组)、补肾活血方含药血清低(B组)、中(C组)、高(D组)浓度分别置于培养孔中,每孔均含rhBMP-2,取第3代BMSC,调整细胞密度为1×105/ml,每组加200μl细胞悬液,在37℃、5%CO2培养箱中培养。
1.6 细胞数量检测及细胞增殖测定
分别于培养第1、3、5、7、10、12和15天对四组细胞通过MTT法检测细胞增殖活性。每孔加MTT溶液200μl,37℃孵育4h后终止培养,小心吸弃孔内培养上清液,每孔内加入1 000μl DMSO,振荡10min裂解细胞,使结晶物充分融解,分光光度计于570nm波长处测定OD值,以培养时间为横坐标,OD570值为纵坐标绘制生长曲线。
1.7 ALP活性检测
分别于培养的第5、10、15和20天,将各组培养的细胞用PBS洗2次,用0.25%胰蛋白酶消化后加入培养基1ml终止消化,离心洗涤后,加细胞裂解液,然后按ALP检测试剂盒说明进行加样操作,用分光光度计于520nm波长处测定OD,然后计算出ALP含量。
1.8 TGF-β1mRNA的测定
TGF-β1引物:根据PCR引物设计原则,设计引物。TGF-β1引物为:fGTGCTCGCTTTGTACAACAGC,rTTACCAAGGTAACGCCAGG,扩增片段为336bp,β-actin 引物为:fTCACCCACACTGTGCCCATCTACGA,rTCACCCACACTGTGCCCATCTACGA,扩增片段为300bp。按试剂盒说明,用TRIzol提取细胞总RNA,进行RT-PCR扩增。PCR反应条件为:94℃预变性3min,94℃30s,60℃30s,72℃40s,30个循环,72℃延伸7min。PCR产物在1.5% 的琼脂糖凝胶上电泳。紫外透射仪上检测,凝胶成像仪摄像。求出每条目的条带与β-actin条带的比值,统计学处理。
1.9 统计学处理
采用SPSS 12.0统计软件包进行方差分析,结果以±s表示,同时应用LSD及Dunnett-t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 BMSC的鉴定
流式细胞检测结果显示:BMSC细胞表面主要阴性标志物CD34和CD45均为阴性,阴性率分别为1.29%和2.51%,而BMSC细胞表面主要阳性标志CD44和CD90为阳性,阳性率分别为90.18%和92.63%,BMSC的浓度在90%以上。见图1。
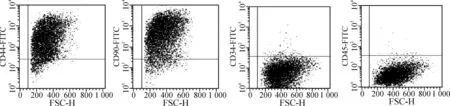
图1 BMSC的鉴定图
2.2 细胞生长观察
倒置相差显微镜下观察,随时间的延长,A、B两组细胞增加较C、D组缓慢,细胞数量相对较少,而C、D两组中细胞在复合培养4h后可贴壁,呈现圆形或椭圆形;到第1天时,细胞生长分布均匀,呈长梭形;到第3天时,细胞数量增殖增多,呈多角形或梭形;到第5天以后,细胞数量持续增多,长满瓶壁,呈单层生长,明显优于A、B两组。见图2。
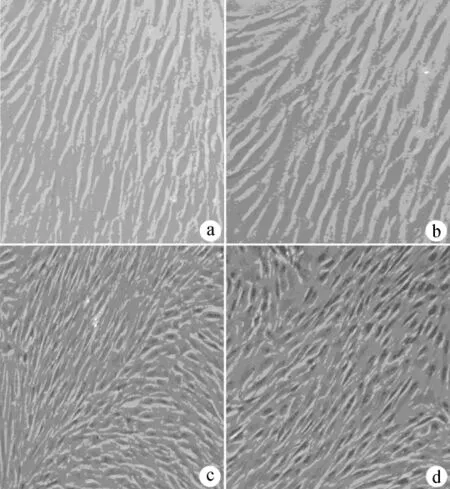
图2 BMSC培养10d时细胞黏附、增殖情况
2.3 细胞培养诱导的生长曲线
随着培养诱导时间的延长,四组细胞数量均提高,A、B、C三组细胞数量在第10天时达到高峰,后入平台期。而D组在第10天后细胞数量缓慢升高。A、B两组细胞数量无明显差异(P>0.05),而C组及D组从培养的第5天开始细胞数量明显高于A、B组(P均<0.05)。见图3。
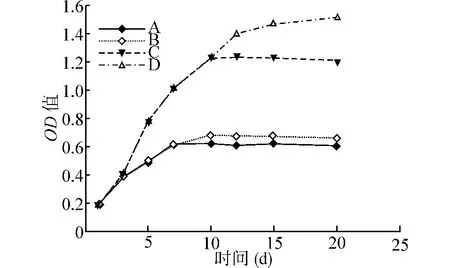
图3 细胞培养诱导生长曲线
2.4 细胞ALP活性检测结果
随培养诱导时间的延长,各组中细胞ALP活性均逐渐增高,第15天后,A、B组ALP活性逐渐趋缓,而C、D组仍逐渐增高,从第5天开始C、D组ALP活性明显高于A、B组,第15天及第20天时,D组细胞的ALP活性明显高于C组(P<0.05)。见图4。
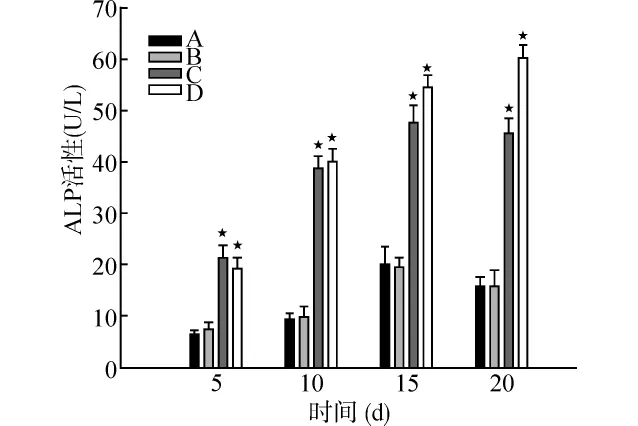
图4 细胞ALP活性检测
2.5 TGF-β1mRNA的表达情况
A组 TGF-β1mRNA相对表达量为(0.563±0.083),B 组为 (0.631±0.096),C 组 为 (3.197±0.636),D组为(2.463±0.501),A、B两组表达量明显减弱,但两组间差异无统计学意义(P>0.05),C、D两组TGF-β1mRNA相对表达量明显高于A、B两组(P<0.05)。见图5。

图5 各组TGF-β1mRNA表达
3 讨论
INFH为现代医学难治性疾病之一,古代医家认为气血对骨骼的滋养是骨骼维持正常形态和功能的关键。虽然历代医家对本病在病因病机的认识不尽相同,各有侧重,但归纳起来不外乎肾虚、血瘀、痰湿等。治以补肝肾、益气血、生髓骨、活瘀血、祛痰湿、止痹痛,使瘀凝祛而疼痛止,脉络通而骨得养。INFH患者因肾虚或血瘀,导致骨枯髓减,骨髓功能下降,继而分化为成骨细胞的能力及其活性也随之下降,导致股骨头局部骨坏死及再修复新生障碍。青娥丸加味是根据中医“肾主骨”原理,在传统补肾中药方青娥丸基础上,加用活血中药丹参,结合中医传统理论及经验,从整体上调理肝肾,调节骨代谢,促进骨形成及骨组织的修复,预防INFH进一步发展。
骨髓间充质细胞可以向成骨细胞、成纤维细胞、成软骨细胞和脂肪细胞等多个方向分化,故骨髓间充质细胞中只有一部分是能自发分化为成骨细胞系的骨祖细胞,其在体外的分化很大程度上依赖于培养条件。故摸索MSC最佳体外培养条件使MSC多量、稳定地向成骨细胞系分化,对骨组织的形成具有重要意义,一直以来是治疗早期INFH良好的种子细胞[4]。骨形态发生蛋白是一种存在于骨基质中的糖蛋白多肽,含有二硫键结构,相对分子质量18 000~30 000,除BMP1外构成了一个结构和功能相似的多肽因子家族[5]。BMPs能在生物体内诱导未分化的间充质细胞分化成为软骨和骨。BMPs各成员的诱导成骨能力不同,其中以BMP-2的成骨能力最强,是骨组织形成过程中最为关键的调节因子之一,可诱导人或动物间充质细胞分化为骨或软骨组织,因此目前被广泛研究,中医药干预运用也发挥着重要的作用[6]。
本文的结果显示,rhBMP-2能够诱导激素性INFH大鼠股骨近端分化中的 MSC表达TGF-β1mRNA,且一定浓度的补肾活血方含药血清能够促进这种作用,其中中、高浓度可达本组的最大效应。TGF-β1广泛存在于正常组织中,尤其以骨组织中含量最为丰富。大量研究表明,TGF-β对骨质再生起关键作用。TGF-β参与胚胎骨的形成和生长,在骨形成的早期,新生的软骨内和骨膜中分别有TGF-β1和TGF-β2的表达。TGF-β1能促进骨膜间充质细胞增殖分化及骨细胞增殖,在骨系细胞中主要表现为促进间质来源的细胞DNA合成及增殖,可明显促进细胞外基质的合成,刺激胶原、骨连接素和骨桥蛋白合成,增加骨基质沉积率。TGF-β1还能增加成骨细胞定向迁移的能力,这在骨修复过程中吸收成骨祖细胞向激活的骨吸收部位移动,有重要的趋化作用[7]。笔者的前期研究[8]发现,TGF-β1主要在成骨细胞的胞膜和胞质内表达,体内研究表明中药补肾方能明显提高成骨细胞TGF-β1的表达。笔者的研究还显示青娥丸能够提高骨质疏松症患者血清基质金属蛋白酶-2、骨碱性磷酸酶、骨钙素,Ⅰ型胶原交联C端肽和尿Ⅰ型胶原交联N端肽水平,从而间接反映青娥丸能够有效增强成骨细胞活性,促进骨形成抑制骨吸收,增强骨质骨量[9]。本研究结果显示一定浓度的补肾活血方含药血清能够促进分化中的MSC分泌ALP,通过对MSC形态学观察、ALP活性测定等,均可说明经传代培养的细胞已经具有与成骨细胞相似的形态及生长特点。但补肾活血方的作用机制是通过增强rhBMP-2活性还是直接作用于靶细胞需要进一步的观察。
[1]覃小华,尚希福,胡飞.骨髓间充质干细胞联合茶黄素治疗兔激素性股骨头坏死[J].中国组织工程研究与临床康复,2009,13(19):3730-3734.
[2]李仪奎.中药血清药理学实验方法的若干问题[J].中药新药与临床药理,1997,10(2):95-98.
[3]李雄,袁浩,贝美莲,等.大剂量激素冲击应用与长期应用对股骨头坏死影响的动物实验[J].骨与关节损伤杂志,1999,14(4):241-244.
[4]赵大成,汪良玉,党跃修,等.大鼠骨髓间充质干细胞的体外成骨诱导[J].中国组织工程研究,2012,16(14):2491-2495.
[5]CALORI GM,DONATI D,DI BELLA,et al.Bone mor-phogenetic proteins and tissue engineering:future directions[J].Injury,2009,40(Suppl 3):S67-76.
[6]黄有荣,高冠群,杨丽平,等.白脉软膏对家兔桡骨骨折愈合过程及骨痂骨形态发生蛋白2、碱性成纤维细胞生长因子水平的影响[J].中华临床医师杂志,2012,6(13):3599-3602.
[7]KURODA S,SUMNER DR,VIRDI AS.Effects of TGF-β1 and VEGF-A transgenes on the osteogenic potential of bone marrow stromal cells in vitro and in vivo[J].J Tissue Eng,2012,3(1):2041731412459745.
[8]刘诗荣,沈霖,杨艳萍,等.补肾法对去卵巢大鼠骨组织中TGF-β1及Fas的影响[J].中国中医骨伤科杂志,2003,11(2):23-27.
[9]赵光,沈霖,杨艳萍.青娥丸对绝经后骨质疏松症患者骨密度、血清MMP-2水平及骨代谢指标的影响[J].中西医结合研究,2012,4(3):113-117.

