大花蕙兰无菌播种与组培快繁技术研究
李茂娟, 谭柏韬, 邓少华, 王华龙
(郴州市林业科学研究所, 湖南 郴州 423000)
大花蕙兰无菌播种与组培快繁技术研究
李茂娟, 谭柏韬, 邓少华, 王华龙
(郴州市林业科学研究所, 湖南 郴州 423000)
对大花蕙兰的无菌播种及组培快繁技术进行了相关研究。结果表明:大花蕙兰无菌播种采用0.1%升汞溶液灭菌10min能取得较好的效果;改良MS+6-BA1.0mg/L+NAA0.5mg/L培养基对假鳞茎诱导原球茎效果较好,其原球茎诱导率可达86%;原球茎增殖的最佳培养基为改良MS+NAA0.5mg/L,此配方对大花蕙兰的壮苗生根同样合适;采用固、液培养基交替培养(振荡转数100~110r/min)能有效地促进原球茎增殖;移栽基质配比为腐殖土∶棉籽壳=1∶1时,移栽苗成活率可达95%。
大花蕙兰; 无菌播种; 组培快繁; 原球茎; 交替培养
大花蕙兰(Cymbidiumgrandiflorium)是兰科兰属中的一部分大花附生种类及其杂交种,是世界上栽培最普及的洋兰之一,具有雍容华贵的外貌和色彩鲜艳的花朵,享有“兰花皇后”的美誉,深受兰花爱好者的欢迎,具有较大的市场潜力[1]。大花蕙兰种子众多而小,且多数发育不完全,常规播种难以萌发。传统繁殖方式是分株繁殖,但繁殖系数低且容易引起退化。因此,研究大花蕙兰组培快繁技术,对于解决市场需求,实现大花蕙兰的规模化生产具有重大意义[2]。
1 材料与方法
1.1试验材料
大花蕙兰供试种子和供试植株均来源于郴州市林业科学研究所花卉中心苗圃。
1.2试验方法
1.2.1 无菌播种诱导原球茎 取大花蕙兰蒴果冲洗干净后,在超净工作台内用75%酒精浸泡30s,然后分别用2%次氯酸钠,10%过氧化氢,0.1%升汞溶液处理[3],处理时间分别为8、10、12min,接着用无菌水冲洗6~8次,再用无菌手术刀将蒴果剖开,将其中的种子均匀撒在相同配方的培养基上(MS+6-BA 0.5mg/L+NAA 0.1mg/L),每个处理重复3次,观察种子污染率、原球茎诱导率状况。


1.2.2 假鳞茎诱导原球茎 采用大花蕙兰健康植株的假鳞茎作为外植体,经自来水冲洗干净后,用75%酒精浸泡约30s后放入0.1%升汞溶液中杀菌10min,然后用无菌水冲洗6~8次。在无菌的条件下将假鳞茎切割成5×5mm大小的团块,将它们分别接种到3种不同的基本培养基MS、1/2MS及改良MS上培养(均添加6-BA 0.5mg/L,NAA 0.1mg/L),观察原球茎诱导情况。确定最佳基本培养基后,再使用不同的激素配方6-BA(0.5、1.0、1.5mg/L)、NAA(0.1、0.2、0.5 mg/L)进行培养,每个处理重复3次,统计诱导率。

1.2.3 原球茎的增殖培养 经3~4周培养,将外植体周围产生原球茎团块分切后进行继代培养,可形成更多的原球茎,分别添加椰乳(5%、10%)、香蕉汁(5%、10%)、6-BA(0.5、1.0mg/L),NAA(0.1、0.5mg/L)作为培养物进行试验比对[4]。此外,原球茎的增殖培养方式采用了液体振荡培养,固体培养及固、液体交替培养三种不同的培养方式进行。其中,固、液交替培养即采用固体培养基培养20d后转入液体培养基振荡培养20d,再转入固体培养基培养,依次循环。液体振荡培养采用不同转数(60~70、100~110、130~140r/min),其他条件同上,每个处理重复3次,统计增殖系数。

1.2.4 生根与移栽 采用改良MS培养基添加不同浓度NAA(0.1、0.5mg/L)和IBA(0.1、0.5mg/L),研究最佳生根配方。待根生长到2~3cm左右,将装有试管苗的罐头瓶打开移出恒温室进行炼苗,7d后,取出试管苗,洗净根际的培养基,分别移栽入不同的基质中(腐殖土∶沙土=1∶1,腐殖土∶棉籽壳=1∶1,腐殖土∶珍珠岩=1∶1,腐殖土∶松针=2∶1),并在相同的环境条件下培植,每个处理重复3次,筛选最佳的移栽基质。
以上室内试验的培养基分别加入7.5g/L的琼脂、20g/L蔗糖,pH值5.4~5.6,置于25±2℃的温室中进行培养,期间每天补充1500~2000lx光照(利用日光灯补光)12~14h。
2 结果与分析
2.1不同消毒液及消毒时间对无菌播种的影响
消毒处理是无菌播种的第一步,对大花蕙兰的组织培养研究有着至关重要的作用,消毒方法和时间得当,可以减少外植体的污染和材料的损失。从表1可以看出,在相同培养基配方下,使用3种不同的溶液消毒,随着处理时间的延长,污染率均有明显的减少,但是原球茎的诱导率也相对降低。其中,污染率最低的是使用2%次氯酸钠与0.1%升汞消毒12min,污染率均为16%;原球茎诱导率最高的是使用0.1%升汞处理10min,诱导率为76%。虽然0.1%升汞消毒10min污染率相对于最低污染率高出4%,但诱导率却高出20%左右,从外植体材料利用的方面考虑,大花蕙兰无菌播种在0.1%升汞溶液消毒10min处理下效果最为理想。

表1 不同消毒液及消毒时间对无菌播种的影响Tab.1 Effectofdifferentdisinfectantanddisinfectiontimeontheasepticsowing消毒液消毒时间(min)污染率(%)原球茎诱导率(%)836602%次氯酸钠1024581216408406410%过氧化氢103452122644836500.1%升汞102076121648
2.2不同基本培养基对假鳞茎诱导原球茎效果的影响
在激素及浓度配比相同的情况下,将假鳞茎接种于3种不同配方的基础培养基上,10d左右,假鳞茎开始膨大,20d左右可观察到假鳞茎周围有大小不一的黄白色颗粒状组织,30d左右转为绿色原球茎。从表2 可以看出,MS、1/2MS及改良MS三种培养基均能诱导大花蕙兰原球茎的产生,诱导期分别为32d、35d和28d,诱导率分别为60%、44%、70%。由此可知,采用改良MS培养基,诱导原球茎所需时间最短且诱导率最高,故大花蕙兰原球茎诱导的最适培养基为 改良MS。

表2 不同培养基对原球茎诱导效果的影响Tab.2 EffectofdifferentmediumontheinductionofPLB培养基种类原球茎诱导期(d)原球茎诱导率(%)MS32601/2MS3544改良MS2870
2.3不同激素浓度配比对假鳞茎诱导原球茎效果的影响
将假鳞茎接种到含有不同激素浓度配比的改良MS培养基上,不同浓度的6-BA、NAA对大花蕙兰原球茎的诱导效果有明显的区别(见表3)。当6-BA浓度≤1.0mg/L时,随着6-BA浓度的增大,诱导率有升高的趋势;当6-BA浓度为1.5mg/L时,诱导率反而下降,可能与细胞分裂素浓度过高会抑制原球茎生长有关。其中,原球茎诱导率最高可达86%,其配方为改良MS+6-BA 1.0mg/L+NAA 0.5mg/L。
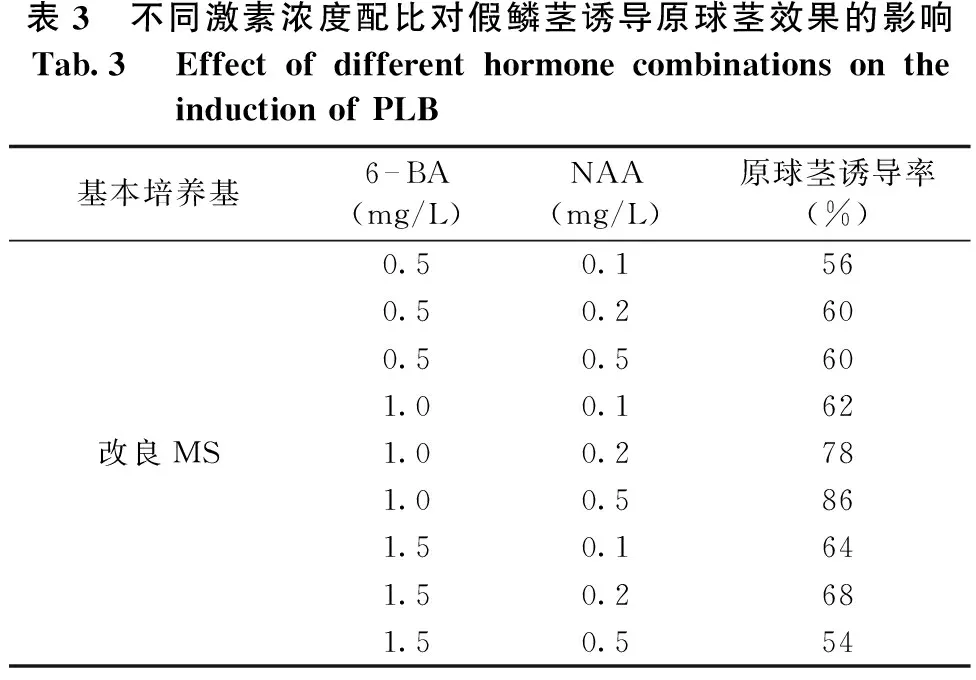
表3 不同激素浓度配比对假鳞茎诱导原球茎效果的影响Tab.3 EffectofdifferenthormonecombinationsontheinductionofPLB基本培养基6—BA(mg/L)NAA(mg/L)原球茎诱导率(%)0.50.1560.50.2600.50.5601.00.162改良MS1.00.2781.00.5861.50.1641.50.2681.50.554
2.4不同添加物对原球茎增殖的影响
将诱导出的大花蕙兰原球茎为培养原材料,在无菌条件下,选取呈嫩绿色、大小基本一致、生命力处于旺盛时期的原球茎,切割后接种到增殖培养基上,15d左右开始长出绿色的原球茎,一般25d左右,原 球茎增殖系数基本稳定。从表4可以看出,4种不同的添加物单一或者组合均能诱导大花蕙兰原球茎的增殖,但是增殖效果各有不同。其中,增殖效果最好的是椰子汁10%+NAA 0.5mg/L,增殖系数达到了4.7;其次为单一的NAA 0.5mg/L和香蕉汁10%+NAA 0.5mg/L,增殖系数均为4.5。总的来说,在NAA 浓度为0.5mg/L的情况下,大花蕙兰的增殖效果均比较好。6-BA对大花蕙兰的原球茎增殖效果不如NAA。考虑到采用椰子原汁具有较强的季节性,且花费较高,而且仅用NAA 0.5mg/L,也能达到4.5的增殖系数,因此,原球茎增殖采用改良MS+NAA 0.5mg/L的配方较好。
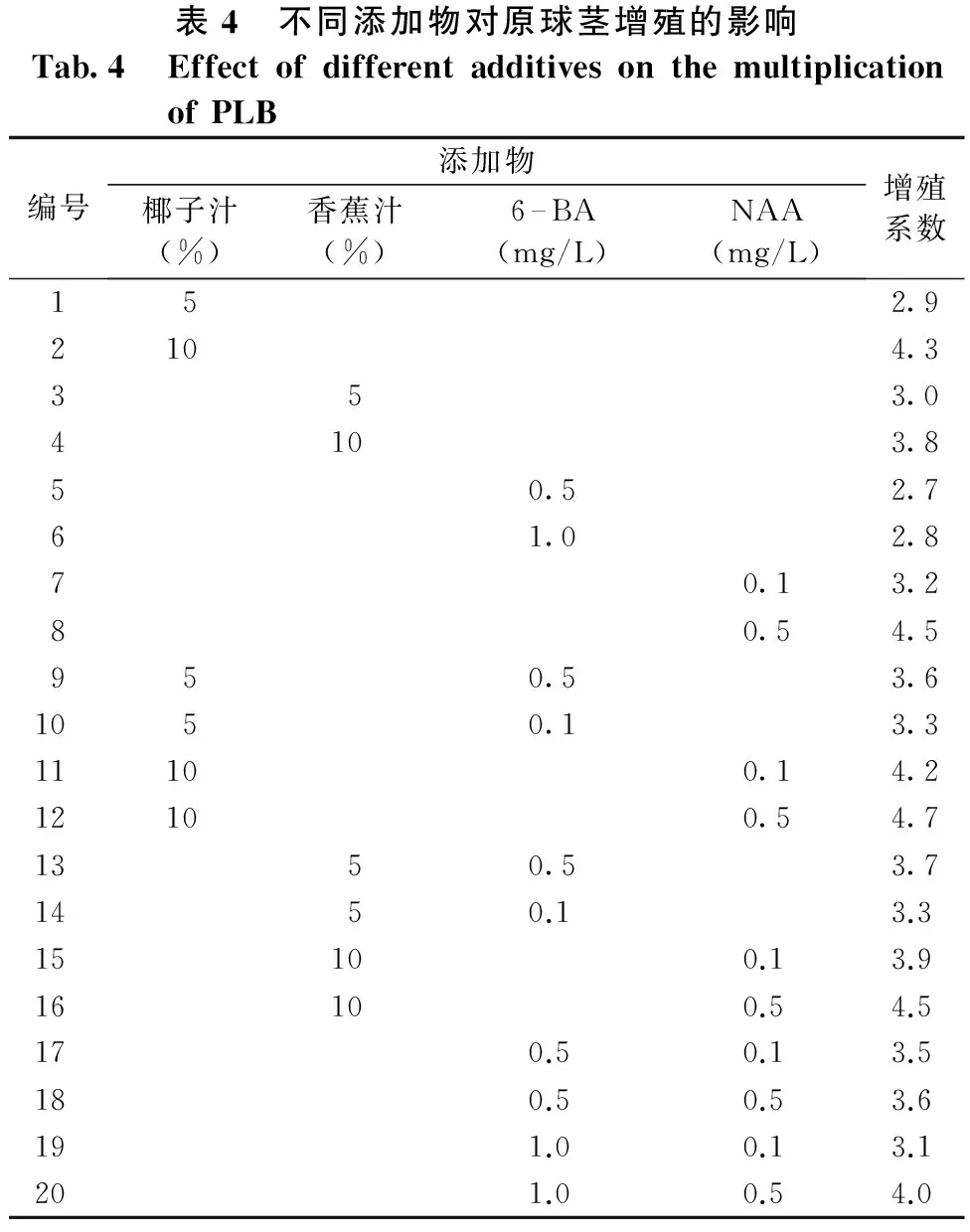
表4 不同添加物对原球茎增殖的影响Tab.4 EffectofdifferentadditivesonthemultiplicationofPLB编号添加物椰子汁(%)香蕉汁(%)6—BA(mg/L)NAA(mg/L)增殖系数152.92104.3353.04103.850.52.761.02.870.13.280.54.5950.53.61050.13.311100.14.212100.54.71350.53.71450.13.315100.13.916100.54.5170.50.13.5180.50.53.6191.00.13.1201.00.54.0
2.5不同培养方式对原球茎继代增殖的影响
原球茎在固体增殖培养基中培养25d左右将会长出丛生芽,而不利于继续增殖,为保证生产效率,在20d左右时需继代一次,即将诱导的原球茎切割后继续培养,防止丛生芽产生。从表5可以看出,采用单一的固体或者液体培养,原球茎的增殖系数均不高,分别为3.6和2.2;而采用固、液体交替培养,增殖系数可达5.2。试验表明采用交替培养能有效地防止丛生芽的生成和提高原球茎的增殖效果。此外,从表6可知,液体培养中不同的振荡转数对原球茎的增殖效果也不同,转数为60~70r/min,原球茎增殖系数仅为2.8,明显低于转数100~110r/min与130~140r/min时的5.2和5.0。这可能由于振荡转数过低,导致部分原球茎长期淹没于液体培养基中而造成缺氧,从而影响了原球茎的增殖。转数100~110r/min与130~140r/min时,增殖系数没有太大的差别,但是从节电角度及噪声角度考虑,转数100~110r/min的振荡培养更加适合。

表5 不同培养方式对原球茎增殖的影响Tab.5 Effectofdifferentculturemethodsonthemultipli-cationofPLB培养方式原球茎增殖系数固体培养3.6液体培养2.2固、液交替培养5.2

表6 不同振荡转数对原球茎增殖的影响Tab.6 Effectofdifferentrevolutionnumbersonthemul-tiplicationofPLB转数(r/min)原球茎增殖系数60~702.8100~1105.2130~1405.0
2.6不同激素浓度对生根的影响
继代培养基中的原球茎在固体培养基中培养20d左右,开始分化形成小苗,待小苗长至2~3cm高时,移至生根培养基上,约5~7d左右可见下部叶腋中稍膨大,出现绿色根原基,10d后可发现明显生根,30d后根长2~3cm可出瓶移栽。不同激素的培养基配方对大花蕙兰无菌生根的影响见表7。无论是生根率还是生根状况方面,添加了NAA的培养基效果都要好于IBA和不添加激素的改良MS。其中培养基配方为改良MS+NAA 0.5mg/L的诱导生根效果最佳,生根率达到99%,且生根数量多且粗壮。
2.7不同基质配比对移栽苗成活率的影响
在植物的组织培养中,试管苗的移栽也是至关重要的一步。从表8可以看出,不同移栽基质配比对大花蕙兰移栽苗成活率的影响各不相同。其中,最佳移栽基质配比为腐殖土∶棉籽壳=1∶1的混合物,移栽苗成活率可达95%;其次为腐殖土∶珍珠岩=1∶1的混合物。

表7 不同激素浓度对生根的影响Tab.7 Effectofdifferenthormoneconcentrationontherooting培养基配方生根率(%)生根效果改良MS75生根数量较少,且根较细弱改良MS+NAA0.1mg/L80生根数量较多,但根较细弱改良MS+NAA0.5mg/L99生根数量多且粗壮改良MS+IBA0.1mg/L82.5生根数量较少,且根较细弱改良MS+IBA0.5mg/L87.5生根数量较多,但根较细弱

表8 不同基质配比对移栽苗成活率的影响Tab.8 Effectofdifferentsubstratecompositionsonthesurvivalrateoftransplantseedlings编号基质配比移栽成活率(%)1腐殖土∶沙土=1∶1752腐殖土∶棉籽壳=1∶1953腐殖土∶珍珠岩=1∶1904腐殖土∶松针=2∶170
3 结论与讨论
(1) 大花蕙兰无菌播种的灭菌过程中,采用0.1%升汞溶液灭菌10min能取得较好的效果,这与其它相关报道基本一致[2,5]。但是,由于升汞残毒较难去除,因此,需用无菌水冲洗6~8次去残毒的效果较好。
(2) 采用改良MS+6-BA 1.0mg/L+NAA 0.5mg/L培养基对大花蕙兰假鳞茎诱导原球茎效果较好。一般认为细胞分裂素与生长素比值较高有利于原球茎的诱导,这与国内许多报道的结论基本一致[5-7]。但亦有相反,如钱张等[8]报道的大花蕙兰原球茎诱导的最佳培养基为MS+BA 0.5mg/L+NAA 1.5mg/L ,所用生长素浓度反而较高,这可能与物种个体差异有关。
(3) 大花蕙兰原球茎增殖最佳培养基为改良MS+NAA 0.5mg/L。采用固、液体交替培养(液体培养振荡转数100~110r/min),交替周期为20d,能有效地提高原球茎的增殖效率,这与杨玉珍等[9]的研究结论基本相符。
(4) 改良MS+NAA 0.5mg/L培养基对大花蕙兰的壮苗生根同样最为合适。大花蕙兰移栽苗的成活效果最佳的基质配比为腐殖土∶棉籽壳=1∶1,从结果来看,一般疏松透气,且保湿效果较好的基质均可作为大花蕙兰组培苗的移栽基质。
国内在大花蕙兰组织培养和快速繁殖方面进行了较多报道,许多研究[5-7,9-10]存在与我们试验类似或者不同的结论。当然,这与植株个体差异及试验误差也有一定的关系。我们仍需加强大花蕙兰组织培养繁殖技术的研究,同时在此基础上,加强遗传杂交育种方面的研究,早日培育出具有自主知识产权的大花蕙兰新品种。
[1] 松华.大花蕙兰史略[J].花卉,1995,53(1):14.
[2] 姚丽娟,陈义增,徐晓薇,等.大花蕙兰无菌播种技术试验[J].浙江林业科技,2006,26(2):30-33.
[3] 胡凯,张立军,白雪梅,等.植物组织培养污染原因分析及外植体的消毒[J].安徽农业科学,2007,35(3):680-681.
[4] 谭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1997:262-264.
[5] 王慧瑜,张晓申,杨录军,等.大花蕙兰组织培养的研究[J].河北林果研究,2006,21(3):278-280.
[6] 杨进,彭春雷.大花蕙兰组培快繁技术的研究[J].荆门职业技术学院学报,2005,20(3):17-20.
[7] 吴晓霞,姜敦云,崔月花,等.大花蕙兰的组织培养和快速繁殖[J].植物生理学通讯,2002,28(2):141
[8] 钱张.大花蕙兰组培快繁技术研究[J].现代农业科技,2007(17):15-19.
[9] 杨玉珍,孙天洲,孙廷,等. 大花蕙兰组织培养和快速繁殖技术研究[J].北京林业大学学报,2002,24(2):86-88.
[10] 刘丹梅,张彦文.大花蕙兰的组织培养和快速繁殖研究[J].丹东纺专学报,2002,9(3):36.
(文字编校:张 珉,杨 骏)
AsepticsowingandtissuecultureofCymbidiumhybridum
LI Maojuan, TAN Baitao, DENG Shaohua, WANG Hualong
(Forestry Institute of Chenzhou City, Chenzhou 423000, China)
The aseptic sowing and tissue culture ofCymbidiumhybridumwere studied for rapid propagation ofC.hybridum. The results showed that the disinfection treatment with 0.1%HgCl2solution for 10 min was most suitable for aseptic sowing.The suitable medium for protocorm-like body (PLB) induction was modified MS +6-BA 1.0mg/L+NAA 0.5mg/L, the inductive rate reached 86%.The optimum medium for PLB propagation was modified MS +NAA 0.5mg/L, which was also suitable for root growing.Liquid and solid medium alternation culture with shaking of 100~110r/min could effectively promote the PLB propagation.The suitable transplanting medium was humus soil∶cotton seed hull=1∶1, the survival rate of transplanting seedlings reached 95%.
Cymbidiumhybridum; aseptic sowing; tissue culture; protocorm-like body (PLB); alternation culture
2012-03-05
2012-05-30
李茂娟(1985-),女,湖南省郴州市人,硕士研究生,主要从事植物组培快繁技术研究。
S 682.31
A
1003-5710(2012)03-0026-04
10. 3969/j. issn. 1003-5710. 2012. 03. 007

