血管紧张素原基因M235T多态性与胃癌的相关性
侯 波 赵敬秋 (吉林省人民医院急诊外科,吉林 长春 3002)
血管紧张素原(angiotensinogen,AGT)是一种球状糖蛋白,主要在肝脏合成,作为肾素底物在调节血压方面发挥重要作用。此外,体内体外实验均证实AGT能够抑制肿瘤细胞增殖、迁移和血管形成,基因导入 AGT能够阻断肿瘤生长和转移〔1,2〕。以往多项研究调查了AGT基因M235T多态性与多种肿瘤的相关性〔3~7〕,然而,其与中国人群胃癌相关性未见报道。本研究采用聚合酶链反应-限制性片段长度多态性(PCRRFLP)技术检测中国人群胃癌患者AGT基因M235T多态性,旨在探索AGT基因M235T多态性与胃癌的关系,为探讨胃癌发病机制提供理论依据。
1 材料与方法
1.1 研究对象 我院2008年1月至2010年12月收治胃癌患者168例,男101例,女67例,平均(58.9±13.5)岁,均经组织病理学确诊。其中临床Ⅰ~Ⅱ期97例,Ⅲ~Ⅳ期71例;高中分化104例,低分化64例;有远处转移71例,无转移97例。对照组为健康体检者211例,男137例,女74例,平均(56.5±11.6)岁,无肿瘤家族史,各项体检指标均正常,所有个体均为无血缘关系汉族人群。
1.2 主要试剂 全血基因组DNA提取试剂盒购自北京百泰克生物科技公司。TaqDNA聚合酶,dNTP和MgCl2等购自北京天根生物科技有限公司。参照文献〔8〕设计引物。上游引物:5'-CAGGGTGCTGTCCACACTGGACCCC -3',下 游 引 物:5'-CCGTTTGTGCAGGGCCT GGCTCTCT-3'。引物由上海英骏生物技术有限公司合成。
1.3 PCR-RFLP分型 采集入选对象者外周静脉血2 ml,采用全血基因组DNA提取试剂盒提取DNA。运用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)对AGT M235T进行分型。PCR 反应体系为 25 μl,含10 × 反应缓冲液3.0 μl,dNTP 2.5 μl,MgCl21.5 μl,上、下游引物各 0.25 μl,TaqDNA 聚合酶 1.0 U,基因组DNA 1.5 μl,用无菌去离子水补足至25 μl。PCR反应条件如下:94℃预变性4 min;94℃变性 30 s,67℃退火45 s,72℃延伸90 s,35个循环。扩增产物用限制性内切酶TthIII I酶切,酶切产物用6%聚丙烯酰胺凝胶电泳,硝酸银染色,分析判读结果。MM型有1条带:165 bp;MT型3条带:165、141和24 bp;TT型2条带:141和24 bp,其中24 bp跑至胶外。
1.4 统计学方法 运用SPSS19.0统计软件,计数法计算基因型和等位基因频率,Hardy-Weinberg遗传平衡定律用于检测基因型的遗传平衡状态,两组比较采用χ2检验。
2 结果
2.1 两组AGT M235T基因型和等位基因分布 两组基因型频率均符合Hardy-Weinberg平衡,表明入选对象具有较好的群体代表性,见表1。
2.2 两组基因型和等位基因频率比较 两组基因型和等位基因频率差异不显著(P>0.05)。根据临床病理特征进行分层分析,发现低分化胃癌患者TT基因型频率明显高于高中分化(P=0.021);AGT M235T多态性与胃癌临床分期及转移状态之间差异不显著(P>0.05)(见表2)。
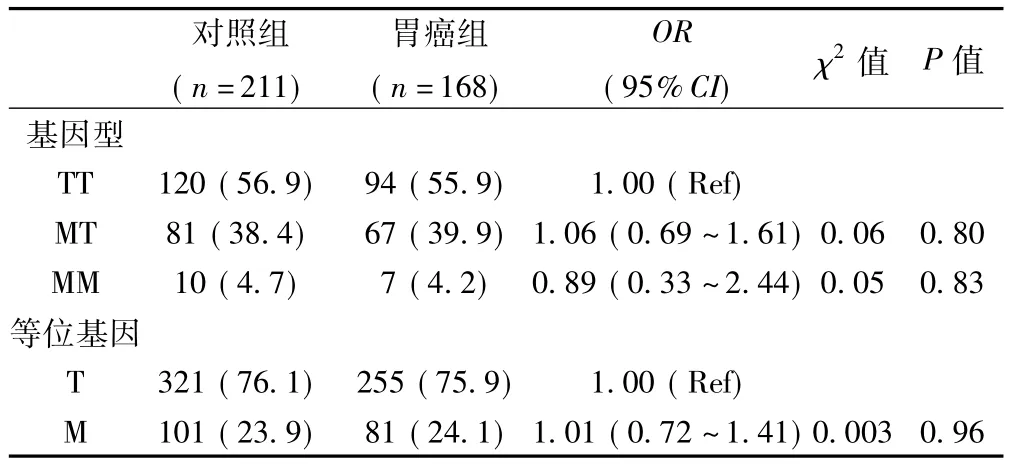
表1 胃癌组与对照组AGT M235T多态性比较〔n(%)〕
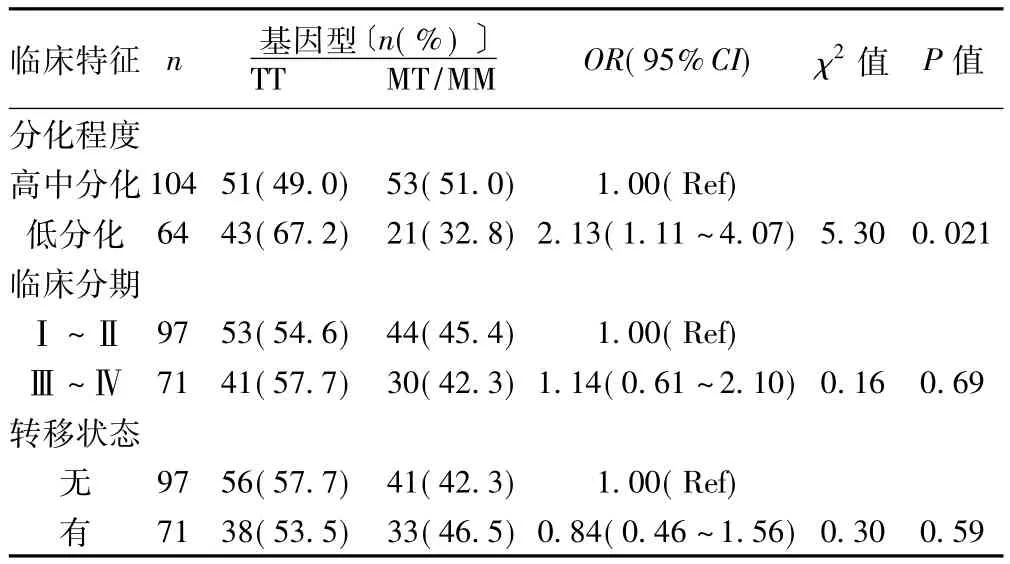
表2 胃癌组临床病理特征与AGT M235T多态性比较
3 讨论
肾素-血管紧张素系统(RAS)是一个复杂的多层次内分泌系统,在调节血压和稳定体液平衡方面发挥极为重要的作用。AGT作为RAS系统中第一步限速反应底物,不仅参与人体血压调节,而且能够抑制肿瘤细胞增殖、迁移和肿瘤血管形成〔1,2〕,导入AGT有望成为新的肿瘤基因治疗方法。
鉴于AGT在抑制肿瘤生长方面的重要作用,多项研究分析了AGT基因M235T多态性与肿瘤相关性〔3~7〕。Gonzalez-Zuloeta等〔7〕报道在荷兰人群中,AGT M235T多态性M等位基因增加了绝经后妇女乳腺癌发病风险。Mendizabal-Ruiz等〔5〕报道在墨西哥人群中,AGT M235T多态性与乳腺癌发病无关。Vairaktaris等〔3〕报道在德国和希腊人群中,导致AGT基因表达增加的235T等位基因与口腔癌发病无关。Shibata等〔4〕报道在日本人群中,AGT M235T多态性在胃癌组和对照组中分布无明显差异。本研究未发现该多态性位点与胃癌存在明显相关性,与Shibata等〔4〕结果一致,提示存在其他胃癌易感基因。本研究结果表明携带TT基因型胃癌患者恶性程度更高,预后更差。综上,尽管AGT M235T多态性与中国人群胃癌发病风险无关,但其与胃癌分化程度密切相关。本研究尚存在一些局限,比如样本量相对较少,尤其在分层分析中,而且局限于单一种族,有待于多中心、多种族、大样本的病例-对照研究加以证实。
1 Bouquet C,Lamande N,Brand M,et al.Suppression of angiogenesis,tumor growth,and metastasis by adenovirus-mediated gene transfer of human angiotensinogen〔J〕.Mol Ther,2006;14(2):175-82.
2 Bouquet C,Frau E,Opolon P,et al.Systemic administration of a recombinant adenovirus encoding a HSA-angiostatin kringle 1-3 conjugate inhibits MDA-MB-231 tumor growth and metastasis in a transgenic model of spontaneous eye cancer〔J〕.Mol Ther,2003;7(2):174-84.
3 Vairaktaris E,Yapijakis C,Vylliotis A,et al.Angiotensinogen polymorphism is associated with risk for malignancy but not for oral cancer〔J〕.Anticancer Res,2008;28(3A):1675-9.
4 Shibata T,Tahara T,Arisawa T,et al.Polymorphism of the salt sensitivity gene angiotensinogen and gastric cancer risk〔J〕.Mol Med Report,2011;4(4):723-6.
5 Mendizabal-Ruiz AP,Morales J,Castro Martinez X,et al.RAS polymorphisms in cancerous and benign breast tissue〔J〕.J Renin Angiotensin Aldosterone Syst,2011;12(2):85-92.
6 Xi B,Zeng T,Liu L,et al.Association between polymorphisms of the renin-angiotensin system genes and breast cancer risk:a meta-analysis〔J〕.Breast Cancer Res Treat,2011;130(2):561-8.
7 Gonzalez-Zuloeta Ladd AM,Arias Vasquez A,Siemes C,et al.Differential roles of angiotensinogen and angiotensin receptor type 1 polymorphisms in breast cancer risk〔J〕.Breast Cancer Res Treat,2007;101(3):299-304.
8 Aggarwal PK,Jain V,Jha V.Endothelial nitric oxide synthase,angiotensin-converting enzyme and angiotensinogen gene polymorphisms in hypertensive disorders of pregnancy〔J〕.Hypertens Res,2010;33(5):473-7.

