亲环素A保护PC12细胞对抗β-淀粉样蛋白诱导的氧化应激损伤和凋亡
葛宇松 尹 琳 (大连医科大学附属第二医院神经内科,辽宁 大连 116023)
阿尔茨海默病(AD)是一种中枢神经系统退行性疾病,β-淀粉样蛋白(Aβ)在脑组织及血管周围异常沉积形成老年斑,是AD的一个重要的病理学特征。Aβ可以引起神经细胞的凋亡和死亡,Aβ诱导神经毒性的机制是复杂的,但是其通过氧化应激反应进一步加重神经毒性作用并且增加细胞的易损性,从而增加了细胞凋亡的发生。因此通过减少Aβ诱导的氧化应激反应为疾病的治疗提供一个有效的途径。亲环素A(CyPA)是亲环素家族成员之一,在脑组织中广泛表达。已有研究证实CyPA在氧化应激后表达升高,并且可以保护细胞免遭氧化应激损伤〔1〕,因此本试验利用 Aβ25~35诱导 PC12 细胞凋亡,观察CyPA对PC12细胞的保护作用及相关的机制。
1 材料与方法
1.1 材料 PC12细胞购自中国协和医科大学细胞培养中心,Aβ25~35、MTT、PI和 Rd 123 购自 Sigma公司,CyPA 购自 Biomol公司,PRMI1640购自Gibco公司,胎牛血清,马血清,胰蛋白酶购自Hyclone公司,DCF-DA购自碧云天生物技术研究所,其余试剂为国产分析纯。
1.2 细胞培养及分组 PC12细胞在PRMI1640培养质中培养,其中含10%灭活马血清、5%胎牛血清,100 U/ml青霉素及100 mg/ml链霉素,于37℃、5%CO2培养箱中培养,取对数生长期的细胞用于实验。使用的Aβ25~35溶于去离子水中,临用前于37℃下孵育2 d使其凝聚。所有实验至少重复3次。
1.3 MTT检测细胞存活率 将PC12细胞以1×105/ml接种于 96 孔板,每孔 100 μl,各组用不同终浓度的 CyPA(0,0.1,1,10,100 nmol/L)处理30 min,再加入 0 或 10 μmol/L 的 Aβ25-35,48 h后每孔加入 MTT(5 mg/ml)10 μl,继续培养4 h,然后吸出培养液,加入DMSO 100 μl,摇床震摇,待结晶紫完全溶解后,酶标仪检测各组细胞的570 nm吸光值,以对照组细胞生存率为100%,其余各组按细胞生存率=(各组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%。
1.4 HE染色 将PC12细胞进行爬片,各组分别用0或10 nmol/L CyPA处理 30 min,再加入 0或 10 μmol/L的Aβ25~35,48 h后弃掉培养液,PBS洗3 次,甲醇固定,进行 HE 染色,光镜下观察并拍照。
1.5 流式细胞仪检测凋亡 将PC12细胞以5×105/ml接种于6孔板,每孔2 ml,各组分别用0或10 nmol/L CyPA处理30 min,再加入 0 或 10 μmol/L Aβ25~35,48 h 后收集细胞,PBS洗2次,1 000 r/min离心 10 min,70%乙醇固定过夜,1 000 r/min离心10 min,用 PBS洗 2 次,加入50 μl RNAase至终浓度为1 g/L,37℃水浴 30 min,每管加 PI至终浓度为50 mg/L,4℃避光孵育30 min,过滤后上机检测,每个样品计数10 000个细胞。按流式细胞仪配置的软件计算凋亡率。
1.6 线粒体膜电位的测定 将PC12细胞以5×105/ml接种于6孔板,每孔2 ml,各组分别用0或10 nmol/L CyPA处理30 min,再加入 0 或 10 μmol/L 的 Aβ25~35,24 h 后收集细胞,PBS洗2次,1 000 r/min离心10 min,每管加Rh123至终浓度10 mg/L,37℃避光孵育30 min,过滤后上机检测,每个样品计数10 000个细胞。测定的数据按流式细胞仪所配置的软件进行数据处理,测定荧光强度降低的细胞百分率。
1.7 细胞内活性氧的测定 将PC12细胞以5×104/ml接种于6孔板,每孔2 ml,各组分别用0或10 nmol/L CyPA处理30 min,再加入0 或10 μmol/L 的 Aβ25~35,24 h 后吸出培养液,每孔加入 DCFH-DA(10 μmol/L)1.5 ml,37℃ 培养箱内孵育20 min后,用无血清培养液洗3次,在倒置荧光显微镜下观察并拍照。将PC12细胞以5×105/ml接种于6孔板,每孔2 ml,药物处理同前,24 h后收集细胞,PBS洗2次,1 000 r/min离心10 min弃上清,加入 DCFH-DA(10 μmol/L)1 ml,37℃培养箱内孵育20 min后,用PBS洗3次,流式细胞仪检测平均荧光强度。
1.8 统计方法 用SPSS11.0统计软件进行数据分析。所有数据以s表示。组间多样本均数间比较用单因素方差分析,两均数比较用SNK-q检验,两组比较用t检验。
2 结果
2.1 MTT观察PC12细胞的存活率 用不同终浓度(0、1、1、10、100 nmol/L)的CyPA预处理PC12细胞30 min,其存活率分别为:(100.72±7.91)%、(101.97±6.77)%、(105.21±6.88)%、(109.79±10.86)%,再加入 0或 10 μmol/L的Aβ25~35继续培养48 h,可见CyPA处理后能提高细胞的存活率,呈浓度依赖性,但是与正常对照组比较没有统计学意义。Aβ25~35诱导组的细胞存活率较正常对照组明显下降〔(47.73±8.93)%vs(100.00±0.00)%〕,而药物保护组的细胞存活率随CyPA剂量的增大而升高,0.1 nmol/L的CyPA可以轻度提高细胞的存活率,但是没有统计学意义〔(52.02±6.85)%,P>0.05〕,1、10和100 nmol/L的 CyPA对细胞具有明显的保护作用〔(67.21±12.98)%、(75.78±11.59)% 和(90.08±9.12)%,P <0.05〕。
2.2 HE染色观察PC12细胞的形态学改变 正常PC12细胞和CyPA处理组的细胞胞体饱满,细胞间联系紧密,胞核蓝紫色,Aβ25~35处理组的细胞数量减少,胞质皱缩或饱涨,胞质浓缩,核固缩或碎裂,呈蓝黑色,10 nmol/L CyPA+Aβ25~35组的大多数细胞形态接近正常。见图1。
2.3 流式细胞仪检测PC12细胞的凋亡率变化 PI单染后流式细胞仪检测可见,正常对照组细胞凋亡率为(4.56±0.61)%,10 nmol/LCypA处理组(4.77±0.73)%,两者相近,Aβ25~35处理组细胞凋亡率可达(23.57±3.82)%,较正常对照组明显提高(P <0.05),而 10 nmol/LCypA+Aβ25~35组细胞凋亡率为(12.83±1.97)%,较 Aβ25~35处理组明显降低(P<0.05)。
2.4 Rh123检测线粒体跨膜电位的改变 正常对照组和10 nmol/L CyPA处理组去极化细胞的百分率分别为(7.54±0.91)%和(6.35±1.05)%,而用 Aβ25~35处理 PC12细胞24 h后,去极化细胞所占的百分率明显增高,达到(18.92±2.11)%,与对照组相比有统计学意义,10 nmol/L CyPA+Aβ25~35组去极化细胞所占的百分率为(11.82±1.78)%,较Aβ25~35处理明显降低(P <0.05)。
2.5 细胞内活性氧(ROS)的变化 倒置荧光显微镜观察正常对照组和10 nmol/L CyPA处理组的PC12细胞几乎未见绿色荧光,PC12细胞经Aβ25~35处理24 h后可见细胞发出较亮的绿色荧光,应用10 nmol/L CyPA处理后,细胞的荧光强度明显减弱。见图2。应用流式细胞仪进行DCFH-DA的定量检测显示,正常对照组和10 nmol/L CyPA处理组PC12细胞的平均荧光强度分别为358.18±27.54和366.43±32.20,二者之间比较无显著性差别,而用10 μmol/L的Aβ25~35处理 PC12细胞24 h后,平均荧光强度明显增高,达到691.68±43.97,与对照组相比有统计学意义,10 nmol/L CyPA+Aβ25~35组平均荧光强度为518.58±41.60,较 Aβ25~35处理明显降低(P <0.05)。
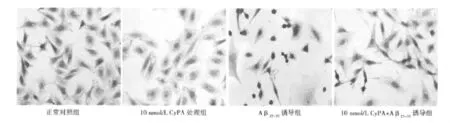
图1 HE染色观察PC12细胞的形态学改变(×400)
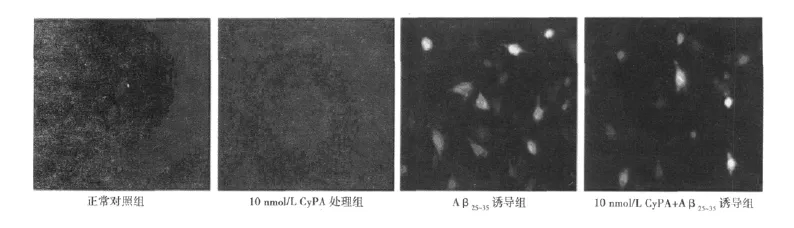
图2 DCFH-DA染色观察PC12细胞ROS水平的改变(×400)
3 讨论
β-淀粉样蛋白在脑组织及血管周围异常沉积可以引起氧化应激损伤,目前认为氧化应激损伤对于AD的发生发展具有较为重要的意义〔2〕。实验显示通过抗氧化剂干预后可保护培养的神经元以及PC12细胞免受Aβ的损伤〔3〕。可见,氧化应激反应与Aβ诱导的细胞凋亡等毒性作用之间关系密切。
CyPA是一种高度保守的蛋白质,从低等原核生物到哺乳动物都有这种蛋白。在人体中不同器官中CyPA的含量也不相同,其中脑组织中的含量最高,显示了它可能对神经元有重要作用。近年来发现,rhCyPA在体外培养神经元遭受缺血和异丙基苯损伤的过程中起到保护作用〔1〕。Redell等〔4〕研究显示,大鼠海马组织受戳刺伤后,于海马部位注射rhCyPA,明显减少海马神经元的损伤,降低血脑屏障的通透性。我们的研究也显示rhCyPA通过上调 Bcl-2表达和下调 Bax表达对抗 Aβ25~35对PC12细胞的毒性作用,减少细胞凋亡〔5〕,但CypA的细胞保护机制还很复杂,本试验在氧化应激方面进一步研究CypA在抑制Aβ诱导细胞毒性方面的作用。
本试验显示用Aβ25~35处理PC12细胞后,细胞的存活率明显下降,细胞的凋亡率明显增加,该结果与以往的试验研究结果一致〔3〕,应用 rhCyPA 干预后,明显对抗了 Aβ25~35的毒性作用,使得细胞的存活率增加,细胞的凋亡率降低,说明rhCyPA对PC12细胞具有保护作用。
线粒体在细胞凋亡的过程中起着枢纽作用,线粒体内膜两侧质子及其他离子的不对称分布形成线粒体跨膜电位,线粒体跨膜电位的下降,被认为是细胞凋亡级联反应过程中一个早期普遍事件〔6〕。造成线粒体跨膜电位下降的主要原因是线粒体膜通透性转运孔(MPT)的开放,进而导致线粒体内膜通透性增加,通过释放凋亡启动因子细胞色素C(Cyt-c)和凋亡诱导因子(AIF)触发细胞凋亡。本研究结果显示,Aβ25~35处理组PC12细胞线粒体跨膜电位较正常对照组明显降低,而应用rhCyPA干预后,可以提高线粒体的跨膜电位,细胞凋亡减少。
ROS是细胞有氧呼吸过程中产生的一些小分子物质,主要包括、OH·及其活性衍生物如H2O2、HOCl、O2等。这些物质具有较高的反应活性,易与细胞内的大分子物质反应,导致细胞结构的广泛损伤,如膜脂质过氧化、蛋白质及核酸等的氧化损伤等。近年的研究认为,活性氧是细胞凋亡的信号之一,ROS的产生可直接或间接改变线粒体跨膜电位,启动线粒体的信号通路,诱导细胞凋亡〔7〕。另外线粒体又是细胞内活性氧的主要来源之一,当线粒体跨膜电位下降,又造成ROS的增加,并且释放到胞浆中,通过激活凋亡信号通路从而进一步导致凋亡的发生〔8〕。因此在凋亡过程中,ROS既是促发和加速线粒体跨膜电位改变的重要效应分子,又是线粒体跨膜电位改变的产物。这种正反馈机制使线粒体跨膜电位的下降进入不可逆过程,细胞凋亡发生。本试验发现,Aβ25~35处理组PC12细胞的平均荧光强度较对照组明显增加与既往实验结果相同〔9〕,而CyPA预处理后平均荧光强度值较Aβ25~35组明显下降,可见CyPA能够有效抑制Aβ25-35引起的细胞内ROS的产生,从而保护PC12细胞抵抗Aβ25~35诱导的氧化应激损伤。
综上所述,本研究结果显示Aβ25~35不仅引起线粒体跨膜电位的降低,而且使ROS生成增加,从而导致细胞的凋亡以及死亡。CypA可以保护PC12细胞抵抗Aβ25~35所引起的细胞存活率的降低和凋亡率的增加,主要是通过抑制Aβ25~35所引起的氧化应激损伤,提高线粒体的跨膜电位而起作用。然而CypA起保护作用的机制还很复杂,还有待进一步的研究和发现,为CypA应用于老年痴呆提供有效的理论依据。
1 Boulos S,Meloni BP,Arthur PG,et al.Evidence that intracellular cyclophilin A and cyclophilin A/CD147 receptor-mediated ERK1/2 signalling can protect neurons against in vitro oxidative and ischemic injury〔J〕.Neurobiol Dis,2007;25(1):54-64.
2 Moreira PI,Duarte AI,Santos MS,et al.An integrative view of the role of oxidative stress,mitochondria and insulin in Alzheimer's disease〔J〕.J Alzheimers Dis,2009;16(4):741-61.
3 Ye J,Meng X,Yan C,et al.Effect of purple sweet potato anthocyanins on beta-amyloid-mediated PC-12 cells death by inhibition of oxidative stress〔J〕.Neurochem Res,2010;35(3):357-65.
4 Redell JB,Zhao J,Dash PK.Acutely increased cyclophilin a expression after brain injury:a role in blood-brain barrier function and tissue preservation〔J〕.J Neurosci Res,2007;85(9):1980-8.
5 葛宇松,尹 琳,滕伟禹,等.亲环素A对Aβ25~35诱导PC12细胞凋亡的影响及机制研究〔J〕.中华神经医学杂志,2011;10(6):582-6.
6 Kroemer G,Zamzami N,Susin SA.Mitochondrial control of apoptosis〔J〕.Immunol Today,1997;18(1):44-51.
7 Wang QF,Chiang CW,Wu CC,et al.Gypenosides induce apoptosis in human hepatoma Huh-7 cells through a calcium/reactive oxygen species-dependent mitochondrial pathway〔J〕.Planta Med,2007;73(6):535-44.
8 Gobe G,Crane D.Mitochondria,reactive oxygen species and cadmium toxicity in the kidney〔J〕.Toxicol Lett,2010;198(1):49-55.
9 Li G,Ma R,Huang C,et al.Protective effect of erythropoietin on beta-amyloid-induced PC12 cell death through antioxidant mechanisms〔J〕.Neurosci Lett,2008;442(2):143-7.

