ApoE基因多态性与脂质代谢的相关性
刘金凤 马洪胜 李 峰 (潍坊市人民医院,山东 潍坊 261599)
冠心病 (CHD)的发生是遗传与环境共同作用的结果。高脂血症是CHD的主要危险因素之一。近年研究表明,ApoE基因多态性与血脂水平存在相关性,与动脉粥样硬化程度及CHD的发生密切相关〔1〕。本研究选择潍坊地区汉族人88例CHD患者与75例健康对照者为研究对象,用限制性片段长度多态性 (PCR-RFLP)方法检测ApoE常见基因型及在人群中的分布频率,从分子水平探讨ApoE基因遗传多态性与脂质代谢的关系,为脂质代谢紊乱的防治以及CHD的预防和治疗提供理论基础。
1 材料与方法
1.1 研究对象 CHD组88例,按WHO1979年制定的诊断标准确诊为CHD,均来自我院老年病科与心血管内科门诊和病房的潍坊地区汉族人,其中男性56例,女性32例,平均年龄 (56.7±8.1)岁,均排除家族性高胆固醇血症、脂肪肝、糖尿病、甲状腺疾病、肾脏疾病、严重高血压和肝脏疾病;对照组75例,为我院体检健康成人,其中男48例,女27例,其平均年龄 (56.2±9.7)岁。
1.2 标本采集及检测
1.2.1 标本采集 抽取空腹12~14 h肘静脉血4 ml分装,其中3 ml于普通抗凝试管中分离血清,3 h内送检血脂,余1 ml置0.5%EDTA抗凝管中-20℃冷藏保存同批待测基因型。
1.2.2 PCR及主要试剂 所使用的ApoE的基因位点引物按Tasi等〔2〕报道设计并使用由上海生物工程技术服务有限公司提供的合成引物一对。引物序列为:上游引物5'-ACAGAATTCGC CCCGGCCTGGTACAC-3',下游引物:5'-TAAGCTTGGCACGGCTGTCCAAGGGA-3'。
1.2.3 目的DNA片段的PCR扩增及PCR产物检测 参照改良HixsonJE法进行PCR扩增〔3〕;硝酸银 (0.1%)染色检测ApoE基因PCR产物 (244 bp);限制性内切酶 (HhaI)酶切:反应在25 μl体系中进行,其中包括PCR产物19 μl,限制性内切 酶 HhaI 11 μl(10 U/μl,Sangon 公 司),10 × buffer 2.5 μl,混匀后置37℃水浴,消化4 h后,置于-20℃终止酶切;聚丙烯酰胺凝胶电泳分型;利用AU600 Olympus全自动生化分析仪上进行六项血脂测定。
2 结果
2.1 CHD组和对照组ApoE基因型及等位基因比较 见表1。CHD组患者中 ApoE基因型依次为 E3/3>E2/3>E2/4>E3/4>E4/4;对照组ApoE基因型分布依次为E3/3>E3/4>E2/3,未检测出E2/4和E4/4型。两组中均以E3/3基因型组最常见,两组均未检测出E2/2基因型。CHD组中ApoE等位基因频率依次为ε3>ε4>ε2,对照组ApoE等位基因频率为ε3 > ε2 > ε4。
2.2 不同基因型的CHD患者血脂脂蛋白水平比较 见表2。不同基因型的CHD患者TC、LDL-C、HDL-C、ApoB水平均存在差异,E4/3、E4/4型个体TC、LDL-C最高,与E3/3、E2/3、E2/4型比较差异显著 (P<0.01,P<0.05),E2/3型个体TC、LDL-C水平最低,与 E3/3、E2/4型比较差异显著(P<0.01,P<0.05)。E3/4、E4/4型个体HDL-C水平显著低于E2/3组 (P<0.05)。E3/4、E4/4型个体 ApoB水平显著高于E3/3、E2/3组 (P<0.01)。TG、ApoA1水平各基因型组无差异 (P>0.05)。
2.3 不同基因型的对照组血脂脂蛋白水平比较 见表2。不同基因型的对照组TC、ApoB水平存在差异,TC水平E3/4型显著高于E3/3、E2/3型 (P<0.01);ApoB水平E3/4显著高于E3/3(P<0.05),其余各项指标各基因型组无差异 (P>0.05)。

表1 CHD组和对照组ApoE基因型及等位基因比较〔n(%)〕
表2 不同基因型的CHD、对照组患者血脂脂蛋白水平比较( s,mmol/L)
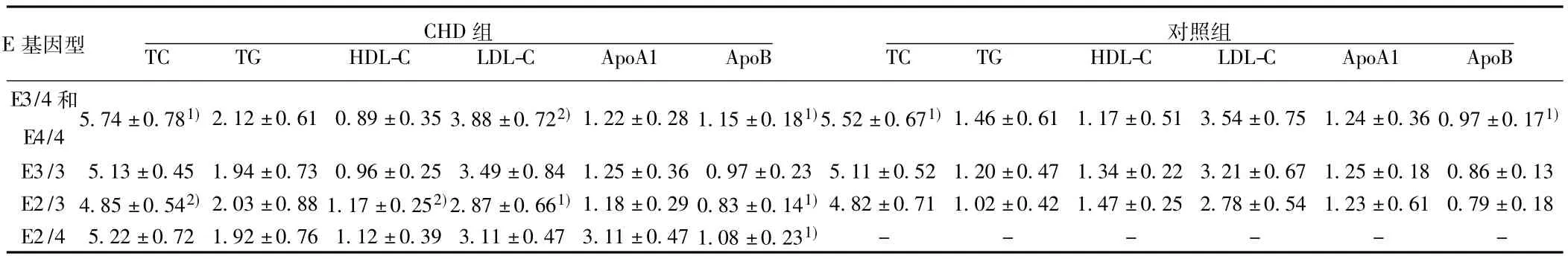
表2 不同基因型的CHD、对照组患者血脂脂蛋白水平比较( s,mmol/L)
与 E3/3比较:1)P <0.01,2)P <0.05
E基因型 CHD组TC TG HDL-C LDL-C ApoA1 ApoB E3/4和E4/45.74±0.781)2.12±0.61 0.89±0.35 3.88±0.722)1.22±0.28 1.15±0.181)5.52±0.671)1.46±0.61 1.17±0.51 3.54±0.75 1.24±0.36 0.97±0.171)TC TG HDL-C LDL-C ApoA1 ApoB 对照组E3/3 5.13±0.45 1.94±0.73 0.96±0.25 3.49±0.84 1.25±0.36 0.97±0.23 5.11±0.52 1.20±0.47 1.34±0.22 3.21±0.67 1.25±0.18 0.86±0.13 E2/3 4.85±0.542)2.03±0.88 1.17±0.252)2.87±0.661)1.18±0.29 0.83±0.141)4.82±0.71 1.02±0.42 1.47±0.25 2.78±0.54 1.23±0.61 0.79±0.18 E2/4 5.22±0.72 1.92±0.76 1.12±0.39 3.11±0.47 3.11±0.47 1.08±0.231)- - - - - -
3 讨论
高脂血症是CHD和动脉粥样硬化(AS)的主要危险因素。研究表明,载脂蛋白与机体脂质和脂蛋白代谢存在相关性,迄今发现的载脂蛋白有近20种,而以ApoE基因多态性与高脂血症及CHD的关系最为密切。
研究表明:正常人群中6种ApoE表型或基因型分布不均匀,但有其共同特点:在一般人群中ApoE3/3分布频率最高,发生频率大多超过60%,含ApoE3的杂合子(E3/4,E2/3)居中,约占30%,ApoE2/2,ApoE4/4和ApoE2/4发生频率最低,三者之和一般不超过10%〔5〕。ApoE基因频率不存在性别差异,但存在种族差异〔6〕。亚洲人群中ε4等位基因频率较低(日本0.06,新加坡0.096)〔1〕,本研究显示,E2/4 型个体所占比例较高,与以往国内外研究报告不同。对照组ApoE等位基因频率与上述研究结果基本一致,支持亚洲人群中ε4等位基因的频率较欧美人种低的论点。而在冠心病人群中ε4等位基因的频率明显高于健康组,ε2频率则相反,提示 ApoE ε2、ε4等位基因可能是CHD的遗传易感基因。
ApoE基因是决定血胆固醇水平的最重要的遗传因素之一〔6〕。胆固醇变异的14% ~16%归因于ApoE基因多态性〔7〕,ε4等位基因与高水平的TC、LDL-C、ApoB和低ApoE水平显著相关,而ε2等位基因的作用恰恰相反,ε2人群往往血清 TC、LDL-C水平最低,ε4人群血清TC、LDL-C水平最高,ε3人群位于二者之间〔8〕。此结论表明ApoE基因型影响个体间血浆TC的作用不受环境和其他遗传背景的干扰。本研究认为,ApoE4则为高胆固醇血症的易感因子。ApoE基因多态性与血浆HDLC的关系各家研究结论不一。Eggertsen等〔9〕研究认为,ApoE基因多态性与HDL-C无相关性,我们发现ApoE基因与HDL-C水平关系呈现 E3/4、E4/4、E3/3、E2/4、E2/3 型依次递增的趋势。
ApoE基因多态性对血浆TG水平的影响各方研究结论不一〔7〕。一般认为,在整个人群中E2/2、E4/4、E2/4者的血浆TG明显高于E 3/3者,提示ε2、ε4等位基因均与血浆高TG浓度有关。但朱铁兵等〔10〕研究结论与之相左,认为ε4对TG并无明显影响。我们研究发现无论CHD患者还是健康人,TG水平各基因型组无差异。
ApoE基因对载脂蛋白也有重要影响。普遍研究认为,ApoB变异的12%可以由ApoE基因多态性解释,ApoA1的变化与ApoE基因型的关系依下列顺序递降:E2/2>E2/3>E2/4>E3/3>E3/4>E4/4。本研究发现,无论CHD患者还是健康人,不同基因型组个体ApoA1水平并无显著差异,而携带ε4等位基因个体ApoB水平显著高于ε2、ε3等位基因个体。
ApoE基因引起血脂差异的机制尚不十分清楚,研究认为可能与各种ApoE受体结合能力强弱、影响含ApoE的脂蛋白代谢速度有关。ApoE主要在乳糜微粒(CM)中起重要作用。这有助于将外周的胆固醇运送到肝脏经过代谢排出。研究发现,ApoE的异构体与LDL受体的结合能力不同,与野生型ε3相比(即以野生ApoE为100%),ε2为<2%,即几乎没有与LDL受体结合的能力,从而导致富含TG的脂蛋白分解较慢,CM残体清除减慢,使血中的TG升高;而由ApoE介导的LDL转化为LDL的速度减慢,细胞LDL受体上调造成的LDL外周分解代谢加快以及由LDL受体介导的肝细胞内吞LDL速度加快,使得ApoE2等位基因携带者的TC及LDL水平下降〔11〕。而ApoE4与LDL受体的结合能力则为23%。由于ApoE2与受体的结合能力低以及肝脏摄取处理CM微粒、VLDL残粒发生障碍,血中的VLDL富含TG,表现为高甘油三酯血症:另一方面,肝脏中的胆固醇相对较少,LDL受体上调,肝脏摄取血循环中的LDL较低,由于总胆固醇主要取决于LDL水平,所以ApoE2等位基因携带者往往表现为低总胆固醇和低LDL。而关于不同的ApoE异构体影响血脂调节功能的机制,主要是由于ApoE在发生氨基酸取代后,改变了受体结合区域的电荷,从而影响受体的结合能力所致〔12〕。
1 Siest G,Pillot T,Bailly A,et al.Apolipoprotein E:an important gene and protein to follow in labratory medicine〔J〕.Clin Chem,1995;41:1068-86.
2 Rall SC,Weisghaber KH,Mahley RW.Human apolipoprotein E:the complete amino acid sequence〔J〕.J Biol Chem,1982;257:4171-9.
3 冯 颖,许贤豪,冀成君.阿尔茨海默病相关基因载脂蛋白E的多态性分析〔J〕. 中华神经科杂志,1998;31:139-42.
4 Boerwinkle E.The use of measured genotype information in the analysis of quantitative phenotypes in man:simultaneous estination of the frequence and effects of apolipoprotein E polymorphisn and residual polygenetic effects on cholesterol,beta-lipoprotein and triglyceride levels〔J〕.Ann Hum Genet,1987;51:211-26.
5 Hallman DW,Boerwinkle E,Saha N,et al.The apolipoprotein E polymorphism:a comparison of allele frequenceies and effects in nine populations〔J〕.Am J Hum Genet,1991;49:338-46.
6 Dallongeville J,Cacan SL,Davignon J.Modulation of plasma triglyceride level by apoE phenotype analysis〔J〕.J Lipid Res,1992;33:447-54.
7 Davignon J,Gregg RE,Sing CF.Apolipoprotein E polymorphism and atherosclerosis〔J〕.Curr Sci,1993;5(1):1-21.
8 James M,Hagberg B,Kenneth RW,et al.ApoE gene and gene-environment effects on plasma lipoprotein lipid levels〔J〕.Physlol Genomics,2000;4:101-8.
9 Eggertsen G,TegelmanR,Ericsson S,et al.Apolipoprotein E polymorphism in a healthy population:variation of allele frequency with age and relation to serum lipid concentrations〔J〕.Clin Chem,1993;39:2125-9.
10 朱铁兵,王中林,赵水平,等.载脂蛋白E基因对血脂代谢的调节及其与冠心病的关系〔J〕.湖南医科大学报,1998;23(2):149-51.
11 Kataoka S,Robbins DC,Cowa LD,et al.Apoliloprotein E poly morphismin American Indians and its relation to plasma lipoproteins and diabetes:the strong heart study〔J〕.Arteriosler Thromb Vasc Biol,1996;16:918-21.
12 Srinivasan SR,Lhnholm C,Wattigney W,et al.Apolipoprotein E polymorphism and its association with serum lipoprotein concentration in black versus white children:The Bogalusa Heart Study〔J〕.Metabolism,12:381-6.

