转谷氨酰胺酶改性花生分离蛋白工艺的研究
熊 柳 孙庆杰 刘 砚 张 磊
(青岛农业大学食品科学与工程学院,青岛 266109)
转谷氨酰胺酶改性花生分离蛋白工艺的研究
熊 柳 孙庆杰 刘 砚 张 磊
(青岛农业大学食品科学与工程学院,青岛 266109)
为了改善花生分离蛋白的凝胶特性,研究了利用转谷氨酰胺酶交联改性花生分离蛋白的工艺。在进行了酶添加量、花生分离蛋白浓度和酶作用时间单因素试验基础上,利用响应面试验设计优化了酶交联改性的最佳条件。并分别测定了酶改性前后花生分离蛋白的功能性,包括:溶解性、吸油性、持水性、乳化性和乳化稳定性、起泡性和起泡稳定性。通过响应面分析得到酶改性的最佳条件:酶添加量、花生分离蛋白质量浓度和酶作用时间分别为17.75 U/g、29.60 g/mL和376 min,在此条件下,凝胶的硬度可达到333.49 g。经转谷氨酰胺酶改性后,花生分离蛋白的吸油性和持水性均有不同程度的提高,分别提高了27.41% 和 61.24%。
转谷氨酰胺酶 花生分离蛋白 凝胶性 功能特性
花生是我国重要的油料作物、经济作物和出口创汇作物,单产、总产、出口量及产值均居世界首位。我国每年能够生产约220万吨花生油,同时产生约300多万吨花生蛋白粉[1]。花生蛋白是一种优质的植物蛋白资源,花生中蛋白质是一种很好的植物蛋白,它含有人体所需的8种必须氨基酸,且易为人体消化吸收,并含有比大豆蛋白更少的抗营养因子[2]。花生中含有的优质蛋白质,生物价(BV)为58,蛋白质功效比值(PER)1.7,可消化性高,其有效利用率可达98.4%,比大豆高20%,并且含有人体必需的8种氨基酸[3]。花生中含有比大豆更少的抗营养因子,被认为是一种极具开发潜力的乳糖不耐症消费者的蛋白基料和牛乳等动物奶类的替代品。花生蛋白作为病人食品,对帮助糖尿病、高血压病、动脉硬化症和肠胃病患者恢复健康均有一定的效果[4]。
花生分离蛋白(peanut protein isolate,PPI)是一种全价蛋白类的食品添加剂。可作为优良的植物蛋白资源,但天然的花生蛋白本身没有凝胶特性,因此,在食品加工中的应用受到很大限制,如何提高花生蛋白的功能特性,拓宽花生蛋白在食品中的应用,发挥其良好的优势,成为摆在科研工作者面前迫切需要解决的问题。
国外的食品研究者20世纪50年代就采用各种物理方法、化学方法、酶法以及基因改造方法处理花生蛋白,使其结构发生调整,从而获得具有理想的功能特性和营养价值的蛋白质[5]。Fontaine等[6]采用不同的酸(强酸如盐酸、硫酸、三氯乙酸;弱酸如乙酸、磷酸、一氯乙酸)水解花生蛋白,发现其理化性质变化规律不同;Beuchat等[7]分别采用胃蛋白酶、菠萝蛋白酶和胰蛋白酶水解脱脂花生蛋白,研究其氮溶解性、吸水性、乳化性、持水性、持油性和电泳性质的变化。
转谷氨酰胺酶(transglutaminase,TG)是从微生物中提取的一种能够催化转酰基反应,从而导致蛋白质(或多肽)之间发生共价交联的酶。转谷氨酰胺酶是一种优良的蛋白交联剂,可以催化蛋白质之间发生交联[8]。在大豆蛋白的制品中,TG酶常被用来提高最终产品的凝胶强度和乳化活力[9-10]。
通过单因素试验研究不同因素对转谷氨酰胺酶交联改善花生分离蛋白凝胶性的影响,并利用响应面试验设计优化酶交联改性的最佳条件,并通过测定溶解性、吸油性、持水性、乳化性和乳化稳定性、起泡性和起泡稳定性,比较酶改性前后花生分离蛋白功能特性的变化,使其达到工业化生产的要求,对充分利用花生蛋白资源、提高花生蛋白产品附加值具有较重要的理论和现实意义。
1 材料与方法
1.1 材料
低温脱脂花生蛋白粉:青岛长寿食品有限公司;微生物转谷氨酰胺酶(100 U/g):德国AB酶制剂公司。
1.2 主要仪器
TA.XT plus型物性仪:英国Stable Micro Systems公司;SPM-10型pH计:梅特勒-托利多仪器有限公司;723型分光光度计:上海精密科学仪器有限公司。
1.3 试验方法
1.3.1 花生分离蛋白的制备
称取一定量的脱脂花生蛋白粉,按料水比1∶10加入pH 8.5的NaOH 溶液,35℃浸提1.5 h,经离心分离除去不溶物,上清液用2.0 mol/L的盐酸调至等电点pI=4.8,离心分离后,水洗两次,干燥、粉碎,过100目筛,即得到花生分离蛋白。
1.3.2 花生分离蛋白的酶解改性工艺
用pH 8.0的磷酸氢二钠-磷酸二氢钠缓冲液配制质量浓度为25 g/mL分离蛋白溶液,置于60℃水浴锅中加热40 min,按15 U/g花生分离蛋白的量添加转谷氨酰胺酶,磁力搅拌10 min,保鲜膜封口,40℃水浴反应6 h,90℃灭酶30 min,用冰水迅速冷却,放入4℃冰箱12 h,取出待恢复室温。
1.3.3 转谷氨酰胺酶交联改善花生分离蛋白凝胶性的响应面优化
通过单因素预试验初步确定酶交联改性的条件为:花生分离蛋白质量浓度30 g/mL,酶添加量15 U/g,酶作用时间6 h。使用 Design-Expert 7.0.0分析软件以花生分离蛋白质量浓度(X1)、酶的添加量(X2)和酶作用时间(X3)为试验因素设计响应面试验,见表1。

表1
1.3.4 花生分离蛋白凝胶质构特性TPA的测定[12]
测定前,将待测样在室温下放置2 h,制成厚度为30 mm的样品,用于凝胶测定。采用TA.XT plus物性仪进行凝胶质构特性的测定,主要参数如下:运行模式:Texture Profile Analysis(TPA);测前速度:1.00 mm/s;测试速度:1.00 mm/s;测后速度:1.00 mm/s;形变量为:30.00%;探头:10 mm圆柱型(P/0.5R)。
以硬度(Hardeness)作为主要指标。
1.3.5 花生蛋白功能性质的测定
1.3.5.1 溶解性
氮溶解指数(NSI)的测定:参照 GB/T 5511—1985,粮食、油料检验 粗蛋白质测定法[13]。
1.3.5.2 吸油性[14]
准确称取0.5 g蛋白(m)产品于10 mL心管中,加入5 mL(V1)花生油,用玻璃棒搅拌均匀,放置30 min,用5 000 r/min的速度离心30 min,记下游离油的体积(V2)。
吸油性=(V1-V2)/m
1.3.5.3 持水性[15]
向10 g样品(M)中加入90 mL蒸馏水,用玻璃棒搅拌均匀,80℃恒温水浴30 min,冷却到室温,5 000 r/min离心10 min,去除分离水,测定残留物的质量(m)。
持水性=m/M×100%
1.3.5.4 乳化性与乳化稳定性[16]
乳化性:称取5 g样品溶于100 mL蒸馏水中,调节pH 7.0,加入50 mL花生油,用高速搅拌器搅拌2 min(10 000 r/min),再离心5 min(5 000 r/min),记录离心管中乳化层高度(h)和离心管中液体总高度(H)。按下式计算乳化性:
乳化性=h/H×100%
乳化稳定性:称取5 g样品溶于100 mL蒸馏水中,调节至pH 7.0,加入50 mL花生油,在高速搅拌器中10 000 r/min均质2 min,置于50℃水浴中30 min后,测出此时的乳化层高度(H0),并且记录30 min后的乳化层高度(H1)。则乳化稳定性为:
乳化稳定性=H0/H1×100%
测定3次取平均值。
1.3.5.5 起泡性与泡沫稳定性[17]
按1 mg/100 mL的质量浓度将样品溶解于pH 7.0的10 mmol/L磷酸缓冲液中,取10.0 mL(V0)置于25 mL量筒中,以10 000 r/min的速度均质2 min;快速记录均值停止时泡沫时的体积(V1)和放置30 min后各再次记录泡沫体积(V2),测定3次取平均值。
起泡性=V0/V1×100%
泡沫稳定性=V1/V2×100%
2 结果与分析
2.1 响应面优化转谷氨酰胺酶交联改善花生蛋白凝胶性的最佳条件
2.1.1 回归模型的建立及其显著性检验
对花生分离蛋白浓度X1、酶添加量X2和酶作用时间X3作如下变换:x1=(X1-30)/5,x2=(X2-15)/5,x3=(X3-6)/1。以 X1,X2,X3为自变量,以凝胶硬度为响应值(Y),试验方案及结果见表1、表2。

表2 响应面试验设计与结果
根据表 2的试验数据,利用 Design-Expert 6.0.5软件分析,可得出3个因素和凝胶硬度之间的回归关系式:Y=330.87+3.44X1+4.68X2+5.04 X3+0.27X1X2-0.35X1X3-0.16X2X3-12.86X21-5.07X22-9.13X23。
从表3可知,模型 Pr>F<0.000 1,表明回归模型极显著;失拟项(反映的是实验数据与模型不相符的情况)的F值为10.40,与整个模型的194.09相比是很小的,这说明不符合的数据相对纯误差是不显著的,因此未知因素对试验结果干扰很小;R2=1 743.65/1 750.64=99.60%(因变量和全体自变量之间的线性关系),表明响应值(硬度)的变化有99.60%来源于所选变量,即酶添加量、花生分离蛋白浓度和酶作用时间。因此,该回归方程对试验拟合情况较好,可以较好地描述各因素与响应值之间的真实关系。X1,X2,X3,X21,X22,X23为显著性影响因素,表明各试验因子对响应值的影响不是简单的线性关系。所以,可以利用该回归方程确定最佳酶改性的条件。
2.1.2 相应面因素相互作用分析及酶改性最佳条件图1~图3直观地反映了各因素交互作用对响应值的影响。从响应面的最高点和等高线可以看出,在所选的范围内存在极大值,即是响应面的最高点,同时也是等值线最小椭圆的中心点。由此可以得出,酶改性的最佳条件为酶的添加量为17.74 U/g,花生分离蛋白质量浓度为29.59 g/mL,酶作用时间为6.27 h。
在此条件下,预测凝胶硬度的理论值为332.22 g。
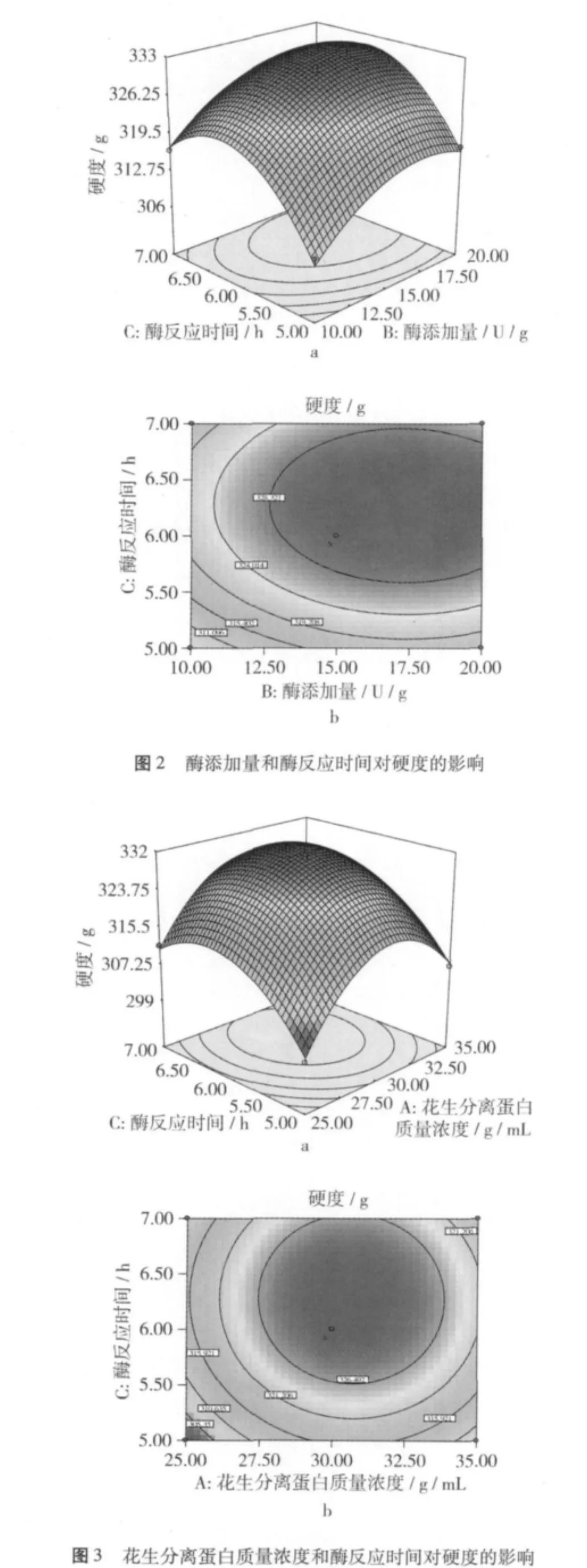
为验证响应面分析法所得结果的可靠性,采用上述最佳条件进行酶改性,考虑到实际操作的条件,酶添加量、花生分离蛋白浓度和酶作用时间分别设定为17.75 U/g、29.60 g/mL 和 376 min,结果表明:在最佳酶改性条件下,凝胶的硬度可达到333.49 g,比预测的理论值332.22 g高0.38%。可见该模型较好地反映出转谷氨酰胺酶交联改善花生分离蛋白凝胶性的改性条件,从而也证明了响应面分析法在确定转谷氨酰胺酶交联改善花生分离蛋白凝胶性改性条件的可行性。
2.2 酶改性前后花生分离蛋白功能特性
经转谷氨酰胺酶改性后,花生分离蛋白的吸油性和持水性均有不同程度的提高,分别提高了27.41%和61.24%(表4);说明转谷氨酰胺酶催化导致球状蛋白的空间结构展开,其二级结构和三级结构逐渐打开,多肽链变得舒展,使原先埋藏于分子内部的诸多疏水区域暴露于溶液,从而增加其吸油性[18]。同时,一方面形成的交联键使蛋白质形成复杂的、严密的空间网络结构,对水分的包容束缚能力增强;另一方面谷氨酰胺脱酰胺,进一步使氨基酸侧链的亲水性增强。这两种变化都有可能导致蛋白持水能力增加。

表4 酶改性前后花生分离蛋白的功能特性
但其溶解性、乳化性、乳化稳定性、起泡性和泡沫稳定性均有所下降,分别降低了 17.78%、26.51%、10.93%、56.18%和 9.38%(表 4)。
说明转谷氨酰胺酶能够催化蛋白导致其分子内及分子间其发生交联,随着酶反应时间的延长,蛋白交联程度增加,形成分子质量较大的聚合物,进而从溶液中析出而沉降,导致溶解度降低。同时蛋白表面疏水性和溶解性下降综合作用的结果,导致花生分离蛋白乳化性和乳化稳定性下降[19],结果与张春红等[20]相似。
花生分离蛋白溶液受到急速机械搅拌时,会有大量气体混入,形成水-空气界面,同时蛋白分子间的相互作用促进界面膜(保护膜)的形成,适当的交联能使界面膜得以加强,增加蛋白的起泡性和泡沫稳定性,但较高的交联度(反应程度)反而会破坏这种界面膜的形成,从而降低起泡性和泡沫稳定性[21]。
3 结论
3.1 通过单因素试验初步确定酶交联改性的条件并在此基础上,以凝胶硬度为主要指标,采用响应曲面分析法中的Box-Behnken模式,通过二次回归设计优化酶交联改性的最佳条件:酶添加量、花生分离蛋白质量浓度和酶作用时间分别为17.75 U/g、29.60 g/mL和376 min;结果表明:在最佳酶改性条件下,凝胶的硬度可达到333.492 g,相对误差仅为0.38%。说明所得回归模型拟合情况良好,结果可靠。试验所得TG改性后花生分离蛋白能够形成凝胶,且具有较高的凝胶性能,可以添加到肉制品中用来改进产品的质地结构,也可在酸奶加工中添加提高酸奶黏度。
3.2 花生分离蛋白经转谷氨酰胺酶交联改性后,其吸油性和持水性均有不同程度的提高,分别提高了27.41%和 61.24%。
[1]吴海文,王强,马铁铮.不同制备方法对花生蛋白功能性质的影响[J].农业工程学报,2009,25(4):304-305
[2]谈佳玉,王承明.响应面法优化酶法制备花生蛋白的工艺研究[J].中国粮油学报,2011,26(8):100-104
[3]李晓东,李晓梅.花生营养功效及花生蛋白乳饮料工艺研究[J].科技信息:科学教研版,2007(29):47
[4]周雪松,赵谋明.我国花生食品产业现状与发展趋势[J].食品与发酵工业,2004,30(6):84-89
[5]郑红艳,钟耕.花生蛋白改性研究及开发前景[J].粮食与油脂,2009(1):14-16
[6]Fontaine N,Takazawa T,Tanaka T.Site- specificcross-linking of functional proteins by transglutamination[J].Enzyme and Microbial Technology,2003,33:492 -496
[7]Beauchat L G,Whitehead J,Kinsella J.Structure function properties of food proteins[M].New York:Academic Press 1991:104-136
[8]Christensen B M,Sorensen E S.Localization of potential transglutaminase cross - linking sites in bovine caseins[J].Journal of Agricultural and Food Chemistry,1996,44(7):1943-1947
[9]吴琼,陈丽娜,代永刚,等.响应面优化转谷氨酰胺酶改性大豆分离蛋白工艺[J].食品科学,2011,32(4):7-9
[10]祖海珍,徐幸莲,鲁奕俊,等.不同热处理温度下转谷氨酰胺酶对混合蛋白凝胶性的影响[J].江苏农业学报,2005,21(3):185 -190
[11]熊柳,孙高飞,孙庆杰,等.花生蛋白粉凝胶性改善研究[J].食品科学,2009,30(13):113 -115
[12]GB/T 5511—1985 量和单位[S]
[13]孙冰玉,石彦国.微波对醇提大豆浓缩蛋白吸油性的影响[J].中国食品学报,2006,6(5):97-99
[14]Beuchat L R.Functional and electrophoretic characteristics of succinylated Peanut flour proteins[J].Journal of Agricultural and Food Chemistry,1977,25:258
[15]Pearce K N,Kinsella J E.Emulsifying properties of proteins:Evaluation of turbidiment ric technique[J].Journal of Agricultural and Food Chemistry,1978,26:716 - 723
[16]Madhusudhan K T,Narendra S.Effect of heat treatment on the functional properties of linseed meal[J].Agriculture Food Chemistry,1985,33:1223 -1226
[17]管骁,姚惠源,张鸣镝.燕麦麸分离蛋白的酶解对其功能性质的影响[J].农业工程学报,2006,22(11):217-222
[18]王述辉,张东杰,王昊,等.超声酶法对大豆分离蛋白乳化性的影响[J].农产品加工,2011(1):54-56
[19]张春红,宣焱.谷氨酰胺转胺酶改性对花生分离蛋白某些功能性质的影响[J].食品工业科技,2009(4):190-193
[20]赵国华,施树.胡麻籽分离蛋白的溶解性与起泡性研究[J].食品科学,2009,30(9):95 -97.
Study on Modification of Peanut Protein Isolate with Transglutaminase
Xiong Liu Sun Qingjie Liu Yan Zhang Lei
(College of Food Science & Engineering,Qingdao Agricultural University,Qingdao 266109)
This article focused on investigating the technology of improving the properties of peanut protein iso-late(PPI)gels by cross linking modification with transglutaminase.Effects of enzyme addition amount,PPI concentration and enzyme reaction time on gel strength of peanut protein isolate modified with transglutaminase(PPIMT)were studied by single factor experiment,optimizing the optimum conditions of transglutaminase modification by response surface methodology(RSM).The functionality of PPI were measured before and after modification,including solubility,oil absorption capacity,water capacity,emulsifying capacity and emulsion stability,foamability and foam stability.According to the principle of central-composite design,the hardness was taken as an index to study the effects of PPI concentration,enzyme addition and enzyme reaction time on the gel properties of PPIMT.The RSM analysis showed when PPI concentration,enzyme addition and enzyme reaction time were 17.75 U/g,29.60 g/mL and 376 min respectively,the hardness of PPIMT gel achieved the maximum 333.492 g.Comparing with PPI,the functional properties of PPIMT had been improved.The oil absorption capacity and the water capacity were increased by 27.41%and 61.24%respectively.
transglutaminase,peanut protein isolate,gel properties,functional property
TS202.3
A
1003-0174(2012)04-0044-06
青岛市公共领域科技支撑计划(11-2-3-25-nsh)
2011-07-14
熊柳,女,1975年出生,硕士,讲师,粮食、油脂与蛋白质工程
孙庆杰,男,1970年出生,博士,教授,粮食、油脂与蛋白质工程

