早期运动对大鼠出生后神经肌肉连接发育的影响
安楠 张漓 徐建方 路瑛丽 赵鹏 赵杰修 何子红 冯连世
国家体育总局体育科学研究所(北京100061)
体育运动在早期教育中的作用受到广泛关注。研究发现,经过体操训练的婴儿粗大运动及精细动作的发育均早于对照组[1],对较大儿童进行运动训练可以提高其手部动作的稳定性和运动速度[2],这些结果提示运动训练可以促进运动能力的发育过程。而在运动科学领域其机理研究还缺乏证据支持。早期运动能力发展是一个循序渐进、自然发生的过程,出生后主要是粗大动作发育 (gross motor develop-ment)的重要阶段[3],在此阶段,伴随脊柱和神经肌肉功能的发育,婴儿逐渐能够抬头、翻身、坐、爬行、站立和行走。身体功能发育以结构发育为基础,在运动能力发育过程中,神经肌肉连接(neuromuscular junction,NMJ)作为实现运动控制的第一个基本结构,其正常发育是获得基本运动能力的关键。NMJ在出生后要完成重要的发育过程。研究表明,与神经肌肉信号传递有关的重要NMJ结构成分——N乙酰胆碱受体(nAChR)亚基表达水平在大鼠出生后1~4周减少,并逐渐向成熟型转换,且这个过程受运动因素影响[4],这说明运动能力发育具有时间性的特征。我们前期研究发现,运动干预在成长期(断乳—性成熟)影响大鼠NMJ形态和结构成分发育的进程和程度[5],证实运动对神经肌肉基本结构和功能具有一定的塑造作用。由于出生后早期是获得运动能力更重要的时期,大鼠在出生后0~3周从不能抬头到能够爬行、行走和奔跑,与人类粗大动作发育进程相似,故本研究从运动科学和神经发育科学结合的角度,通过动物实验研究出生后早期运动对神经肌肉基本结构NMJ发育的促进作用及有关机制,从而丰富早期运动的基础理论。
1 材料和方法
1.1 动物分组
新生Sprague-Dawley(SD)大鼠18只,购自中国军事医学科学院实验动物中心,生产许可证号:SCXK-(军)2009-018。受试新生大鼠与母鼠一同饲养,每窝9只,随机选定一窝为运动组,另一窝为对照组。运动组新生大鼠每天进行1次游泳运动,游泳时间和间隔时间依新生大鼠能够耐受的程度逐日增加,每周游泳6天,休息1天,游泳记录见表1。对照组常规饲养,直至取材。大鼠饲养和取材均在国家体育总局体育科学研究所SPF级动物实验中心 [使用许可证号:SYXK-(京)2011-030]进行。

表1 运动组新生大鼠0~3周龄的运动发育和游泳训练情况
1.2 实验方法
1.2.1 取材
两组分别在3周龄时取材,按0.3 ml/100g体重剂量腹腔注射10%水合三氯乙醛溶液麻醉,迅速分离出双侧腓肠肌,一侧置于预冷的生理盐水中漂洗,滤纸吸干,置液氮速冻待测;另一侧置于4%多聚甲醛+30%蔗糖溶液于4℃固定,用于制作冰冻切片。以下实验操作在国家体育总局体育科学研究所实验室进行。
1.2.2 主要仪器和试剂
Leica CM 3050S冰冻切片机 (德国)、Leica DM4000 B荧光显微镜(德国)、Leica Qwin图像采集分析系统 (德国)、罗丹明标记的α-BTX (α-Bungarotoxin -tetramethylrhodamine) (Sigma,T0195)。SLAN双通道荧光定量PCR仪(上海)、Mylab通用型RNA快速提取试剂盒 (美莱博医学科技有限公司,中国)、M-MuLV 反转录酶 200 U/μl Fermentas(MBI,美国);RNase Inhibitor 40 U/μl Fermentas (MBI,美国)。
1.2.3 荧光组化染色图像分析
将固定48 h的腓肠肌用DD水清洗,快速冰冻后沿腓肠肌长轴作连续冰冻切片,室温下风干,每样品选取靠近腓肠肌肌腹中外三分之一处 (此处NMJ含量丰富)切片10张,置于PBS中振荡漂洗15 min×3次;滤纸吸干,免疫组化笔标记轮廓,滴加罗丹明标记的 α-BTX(1:100,PBS 稀释),置湿盒内室温避光染色1 h;PBS振荡漂洗15 min×3次;无荧光甘油封片,在荧光显微镜下采集运动终板图像,40×物镜下,每张切片取5个视野,在每个视野中选取清晰的运动终板图像,用图像测量软件测量终板周长和终板面积。
1.2.4 荧光定量PCR
所有引物由GNEBANK查询mRNA序列,用Primer软件进行引物设计,由上海生工生物工程有限公司合成(见表2)。

表2 ε-AChR、δ-AChR和 γ-AChR,Agrin 及其受体 MuSK,NT-3 mRNA 引物序列
取腓肠肌组织约0.1 g,迅速加入液氮充分研磨至粉末状,按Mylab通用型RNA快速提取试剂盒说明书提取RNA,用DNase I消化样品RNA中的DNA。加入模板(RNA)10 μg、RNase Inhibitor 4 μl、DNase I buffer 10 μl、DNase I 10 μl、DEPC 水至 100 μl,混匀于37℃环境中放置90 min。
反转录(25 μl反应体系)。 取 RNA 样品 3 μg,加 Oligo Dt T18(50 M)2.5 μl,加 DEPC 水至 25 μl,混匀。70℃5 min,立即冰浴,然后依次加入5×buffer 8 μl,dNTP(10 mM)4 μl,RNase Inhibitor 1 μl,混匀,37℃ 5 min;再加入 M-MuLV 2 μl,于 42℃ 60 min,70℃ 10 min。
PCR检测。向PCR管中分别加入不含染料2×qPCR TaqMix 12.5 μl,10 μM 各基因正反向引物混合物 0.5 μl,对应的 cDNA 各 1 μl,其中一管不加模板用作阴性对照,各管补加水至25 μl。混匀,于SLAN荧光定量 PCR 仪中 95℃ 5 min,55℃ 15 s,65℃35 s(荧光检测),40循环,获得扩增曲线。
1.3 统计学分析
2 结果
2.1 运动终板形态
400倍荧光显微镜下可见(图1),运动组大鼠3周龄时腓肠肌运动终板明显大于对照组,形态上也更成熟,皱褶较深、迂回较多。
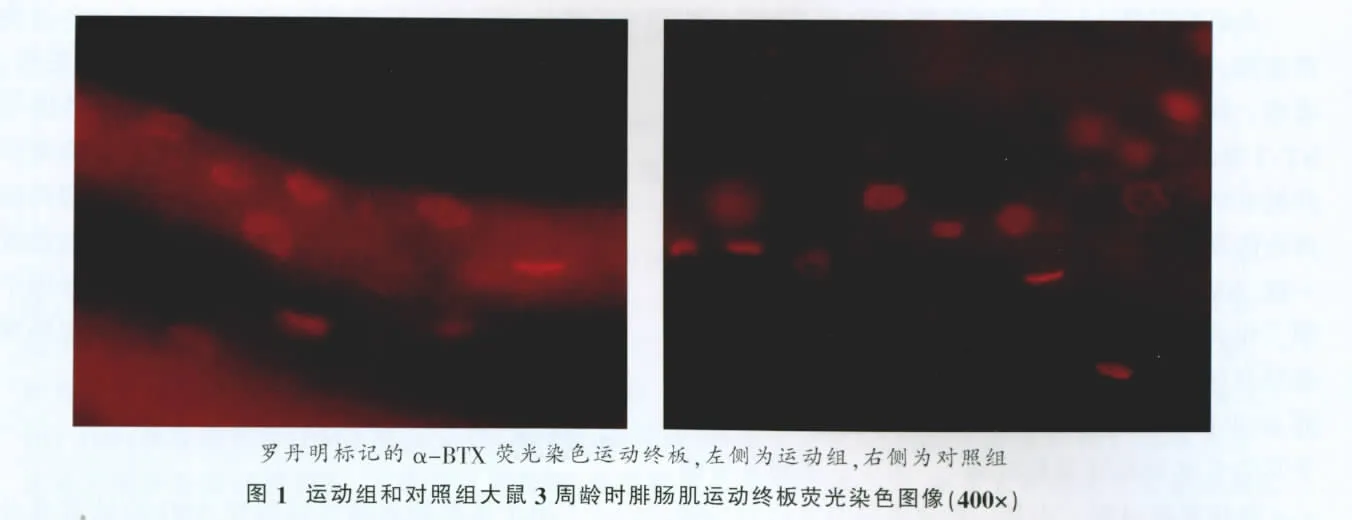
终板图像测量结果(表3)显示,运动组大鼠3周龄时终板面积显著大于对照组(P<0.05),终板周长极显著大于对照组(P<0.01)。

表3 两组大鼠3周龄时腓肠肌终板面积和终板周长比较
2.2 nAChR各亚基表达水平
图2显示,运动组大鼠3周龄时腓肠肌ε-AChR亚基表达水平显著高于对照组(P<0.05),其余亚基组间无显著性差异。
2.3 神经源性和肌源性诱导因子表达水平
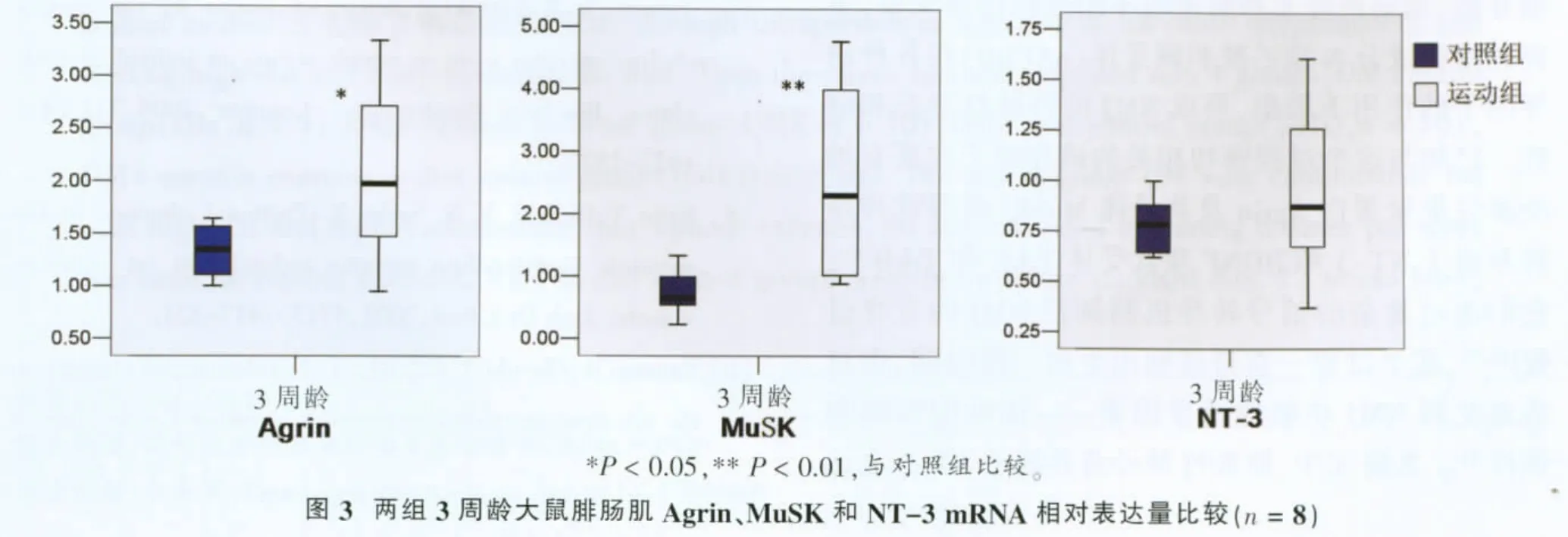
图3显示,运动组大鼠3周龄时腓肠肌Agrin表达水平显著高于对照组(P<0.05),其受体MuSK表达水平亦显著高于对照组 (P<0.01);NT-3表达水平组间无显著性差异。

3 讨论
本研究发现,运动可以促使NMJ形态增大、皱褶变深,其成熟型结构成分——ε-nAChR亚基表达增多;同时,诱导因子Agrin及其受体MuSK以及NT-3表达也相应增加,证实运动可以促进神经肌肉间基本结构的发育,从机理角度对运动促进神经肌肉功能发育进行了解释。上述结果与现有观点基本一致。NMJ基本成分nAChR各亚基的表达始于胚胎期,作为胚胎型NMJ的特征性成分,γ-亚基的表达最早开始,以保证胚胎期nAChR大量广泛聚集[6],而ε-亚基表达则开始于神经支配形成之后,远远晚于其它亚基开始转录的时间[7]。出生后早期发生的γ-ε亚基置换过程,不是一种亚基消失之后另一种亚基才开始出现的替代形式,而是出生时各种亚基包括ε-和γ-都已经在NMJ上大量表达,然后在NMJ各种调控因子和神经肌肉活动的诱导下,胚胎型γ-nAChR逐渐消失,或者含有γ-nAChR的NMJ发生突触消融,最后保留的是信号传递效率更高的、含有成熟型ε-亚基的NMJ,这些变化与NMJ功能成熟的过程相适应。Saito等[8]曾检测大鼠咬肌nAChR表达,发现该结构的成熟性转化发生在出生后3周内,与咬肌运动功能的开始时间(大鼠断乳进食的时间为出生后3周左右)基本一致。另一项关于小鼠舌肌和骨骼肌的研究结果也显示,出生时舌肌已完成γ-ε亚基转换,但后肢骨骼肌的γ-ε亚基转换尚未完成[9]。这可能是不同部位肌肉的功能需要决定的。出生后即需要吸吮,而啮齿类动物下肢运动功能在出生后10天左右才开始发育,骨骼肌的运动功能发育显然比负责吸吮的舌肌和负责咀嚼的咬肌复杂得多,NMJ功能成熟的时间也应与运动功能发育的时间相一致。本研究结果支持运动功能的发育具有时间性特征。
哺乳动物运动的基本结构NMJ的发育从胚胎期开始,运动神经元和肌肉间不断进行信号交换,重要的结构成分N型乙酰胆碱受体(nAChR)在各种诱导因子的作用下聚集,形成NMJ的特征性形态和结构。已知与这个过程密切相关的诱导因子主要有神经源性集聚蛋白Agrin及其受体MuSK、肌源性神经营养因子NT-3和BDNF及其受体TrkC和 TrkB[10],它们通过复杂的信号转导机制调控NMJ的发育过程[11,12],这个过程一直持续到出生后一段时间,也自然地受到NMJ功能性诱导因素——运动的影响和调控[13]。本研究中,肌源性神经营养因子NT-3表达不受运动影响,这可能由于机体具有自身的发育规律,神经肌肉功能的早期发育是由多种诱导因子通过神经和肌肉间双向诱导而完成的,在众多诱导因子中,有一些是与基因编码的自身调控有关的,如NT-3、脑源性神经营养因子(BDNF)等,这些因子不受外界因素的影响,从而能够保证神经肌肉基本结构顺利发育成熟;另外一些则主要与神经肌肉活动的诱导发生应答,从而能加快或减慢运动功能发育的进程,如NT4、Agrin及其受体等,这些诱导因子协同作用,既保证了机体结构发育的稳定性,也体现了功能发育的可塑性。
4 总结
出生后早期运动可以促使NMJ的结构成分和有关诱导因子表达增加,使NMJ形态结构更加成熟,这可能是早期运动能够促进粗大运动功能发育的有关机制之一。
[1]童梅玲,邓静云.早期教育对婴儿运动发育影响的研究.中国儿童保健杂志,2001,(5):298-299.
[2]任园春,赵琳琳,程嘉.瑜伽与儿童青少年身心健康研究进展.中国运动医学杂志,2011,30(12):1145-1150.
[3]鲍秀兰.新生儿行为和0-3岁教育.北京:中国协和医科大学出版社,1998:319.
[4]Herscovich S,Gershon D.Effects of aging and physical training on the neuromuscular junction of the mouse.Gerontology,1987,33(1):7-13.
[5]安楠.运动对成长期神经肌肉接头N型乙酰胆碱受体表达的影响.体育科学,2011,31(8):56-60.
[6]Brenner HR,Rotzler S,Kues WA,et al.Nerve-dependent induction of AChR epsilon-subunit gene expression in muscle is independent of state of differentiation.Dev Biol,1994,165:527-536.
[7]Yumoto N,Wakatsuki S,Sehara-Fujisawa A.The acetylcholine receptor c-to-e switch occurs in individual endplates.Biochem Biophys Res Commun,2005,331 (4):1522-1527.
[8]Saito T,Ohnuki Y&Saeki Y.Postnatal changes in the nicotinic acetylcholine receptor subunits in rat masseter muscle.Arch Oral Biol,2002,47(5):417-421.
[9]Yamane A,Ohnuki Y&Saeki Y.Developmental changes in the nicotinic acetylcholine receptor in mouse tongue striatedmuscle.J Dent Res,2001,80(9):1840-1844.
[10]蔡文琴.发育神经生物学.北京:科学出版社,2007:240-241.
[11]马军利,刘洪臣,王冠超.软食喂养对发育中大鼠咬肌乙酰胆碱受体亚基mRNA表达的影响.临床口腔医学杂志,2008,24(8):473-475.
[12]Alshuaib WB,Fahim MA.Effect of exercise on physiological age-related change at mouse neuromuscular junctions.Neurobiol Ageing,1990,11(5):555-561.
[13]Personius KE,Balice-Gordon RJ.Activity-dependent synaptic plasticity:insights from neuromuscular junctions.Neuroscientist,2002,8(5):414-422.

