胰岛素对人乳腺癌细胞株MDA-MB-543生长的增殖作用
赵肖霞,付全航,郑爱文
(1.浙江省东阳市人民医院,浙江 东阳 322100;2.浙江省肿瘤医院,浙江 杭州 315300)
近年胰岛素及其类似物与癌症的关联性备受关注,德国、瑞典、英国和苏格兰的临床回顾性研究提示某些胰岛素类似物的促有丝分裂效应增加可能具有潜在的致癌作用[1-2]。而这种效应主要由胰岛素样生长因子(IGF-1)受体介导,胰岛素及其类似物可激活胰岛素受体和IGF-1[3],从而促进肿瘤细胞的增殖。本研究探讨胰岛素在不同浓度和作用时间对体外培养的人乳腺癌细胞株MDA-MB-543生长的增殖作用,为临床使用提供依据。
1 材料
RPMI 1640培养液、10%胎牛血清(美国Hyclone公司);普通胰岛素(丹麦Novo Nordisk公司);四甲基偶氮唑盐(MTT,美国Sigma公司),二甲亚砜(DMSO,美国Amresco公司)。
EPICSXL型流式细胞仪(美国Coulter公司);MK3型酶标仪(美国Thermo-Lab systems公司)。
人乳腺癌细胞株(MDA-MB-543)由浙江省肿瘤医院病理科提供。
2 方法
2.1 细胞培养
MDA-MB-543接种在含10%热灭活胎牛血清的RPMI 1640培养液内,置37℃、5%CO2、饱和湿度孵育箱常规培养,用D-Hanks配制的0.3%胰蛋白酶消化细胞传代。取对数生长期细胞用于实验。
2.2 MTT法检测细胞增殖
将对数生长期的细胞用0.3%胰腺蛋白酶消化并制成1×105个/mL的单细胞悬液,接种于96孔板,置37℃、5%CO2培养箱培养24 h。更换无血清的培养液,加入胰岛素使终浓度为1,5,10,20,40 mU/mL,平行设置空白对照组,每组设6个孔,继续培养2,4,8,16,24,32 h。培养结束后,每孔加入5mg/mL MTT溶液20μL,振荡后继续37℃、5%CO2孵育4 h,吸去上清液,每孔加入DMSO 200μL,振荡5 min,用酶标仪测定在490 nm波长处的吸光度(A)值。A值代表细胞增殖能力。
2.3 流式细胞仪检测细胞周期
MDA-MB-543细胞接种于培养皿,每皿3mL(含细胞5×105~1×106个),置37 ℃、5%CO2培养箱贴壁培养24 h,更换至无血清的培养基,加入胰岛素使终浓度为1,5,10,20,40 mU/mL,继续培养16 h后收集细胞,磷酸盐缓冲液洗涤2次,离心5 min,弃上清后,细胞沉淀约0.5mL用70%乙醇2mL混匀重悬,4℃放置8 h以上,碘化丙啶(PI)染色,以流式细胞仪检测细胞周期分布。以同样方法检测10mU/mL 浓度组在胰岛素作用2,4,8,16,24,32 h时的细胞周期分布。
2.4 统计学方法
所有数据采用SPSS13.0统计软件进行处理,计量资料以(±s)形式表示,组间比较采用t检验,P<0.05为差异有统计学意义。
3 结果
3.1 胰岛素对MDA-MB-543增殖的影响
在胰岛素作用时间相同条件下,各时间点胰岛素浓度在1~10mU/mL范围内,均随胰岛素浓度升高对MDA-MB-543增殖作用逐步增强,而之后逐渐减弱;而且,各时间点在10mU/mL时的A值与对照组比较均有显著性差异(P<0.05或0.01)。在胰岛素浓度相同条件下,各浓度在2~16 h范围内,均随胰岛素作用时间延长对MDA-MB-543增殖作用逐步增强,而之后逐渐减弱;而且,各浓度在作用8~16 h时的A值与对照组比较均有显著性差异(P<0.05或0.01)。这提示胰岛素能明显促进MDAMB-543的增殖,且具有明显的剂量和时间依赖关系,在10mU/mL作用16 h时最强。结果见表1。
表1 胰岛素对MDA-MB-543增殖的影响(n=6,±s)Tab.1 Effect of Insulin on the proliferation of MDA-MB-543(n=6,±s)
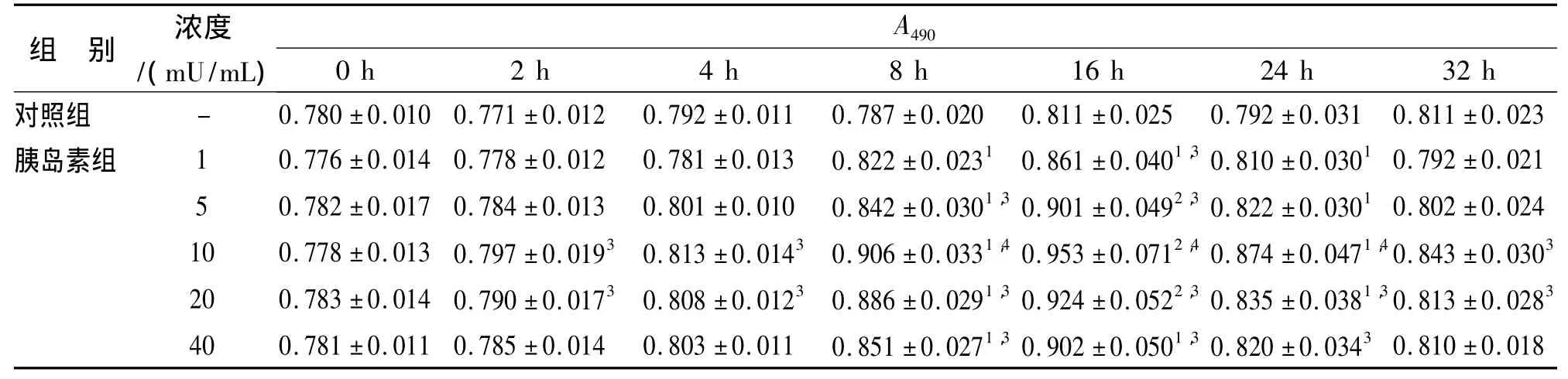
表1 胰岛素对MDA-MB-543增殖的影响(n=6,±s)Tab.1 Effect of Insulin on the proliferation of MDA-MB-543(n=6,±s)
与0 h比较:1 P<0.05,2 P<0.01;与对照组比较:3 P<0.05,4 P<0.01Compared with 0 h:1 P<0.05,2 P<0.01;Compared with control group:3 P<0.05,4 P<0.01
?
3.2 胰岛素对MDA-MB-543细胞周期的影响
在1~10mU/mL范围内,随胰岛素浓度增加,反映增殖活性的S期和G2/M期细胞比例均逐渐增多,而之后逐渐减少;而且,其中S期细胞比例在1~20 mU/mL范围内与对照组比较有显著性差异(均P<0.05或0.01)。在2~16 h范围内,随胰岛素时间延长,反映增殖活性的S期和G2/M期细胞比例均逐渐增多,而之后逐渐减少;而且,其中S期细胞比例在2~24 h范围内与对照组比较有显著性差异(均P<0.05或0.01)。上述表明,胰岛素的增殖作用主要作用于细胞周期S期,在1~10mU/mL、2~16 h范围内具有明显的剂量和时间依赖关系,与MTT结果相符合。结果见表2~3。
4 讨论
胰岛素是一种蛋白质激素,除重要的机体代谢调节作用外,促生长作用也被大量体外实验证实[4-6]。1967年Heuson等报道胰岛素可加快小鼠乳腺癌细胞的生长、增殖[7]。近年大量的流行病学调查资料发现[8],高胰岛素水平的人群更易发生乳腺癌,乳腺癌妇女的血胰岛素、IGF-1水平明显高于正常人群,并与乳腺癌的复发、转移及生存率有密切相关。因此,胰岛素促生长作用与肿瘤发生危险性之间的关系成为人们关注的热点。本实验以在体外无血清培养的人乳腺癌细胞株MDA-MB-543为靶细胞,排除外源因素干扰,采用MTT法评估胰岛素对人乳腺癌细胞株MDA-MB-543的增殖状况,并结合细胞周期分布检测,以提高结果准确性。
本实验MTT检测结果发现,胰岛素能明显促进人乳腺癌细胞株MDA-MB-543的增殖,这种增殖作用在10mU/mL、作用16 h时作用最明显,之后逐渐减弱,具有明显的剂量和时间依赖关系。关于胰岛素促进增殖的机制,许多学者已进行了深入研究。目前已经确认胰岛素的生物效应是通过一系列的蛋白激酶、磷酸酶的级联反应实现的,与细胞增殖有关的胰岛素信号通路主要为Ras和磷脂酰肌醇3激酶途径,而这两条通路都必须由胰岛素和胰岛素紧密受体结合后才能激活酪氨酸激酶活性而发挥生物效应[9]。研究证实[10],多种肿瘤细胞(人肝细胞癌、乳腺癌和多发性骨髓瘤等)上胰岛素受体存在异常过度表达及其亲和力明显增高。笔者认为正因为如此,胰岛素在一定浓度范围内可与细胞膜上受体达到最大限度结合,从而发挥最大的促进细胞分裂等生物学效应,而超出此浓度范围时,胰岛素并不能直接发挥作用。同时,随胰岛素作用时间延长,胰岛素与其受体的复合物被内吞入细胞,被特异性的降解酶所降解,从而停止其生物效应[11]。
细胞周期分布检测结果进一步证实了上述几点,并显示胰岛素主要作用于细胞周期S期。Mawson等[12]研究表明,胰岛素可使CyclinD的表达异常增高,使细胞迅速通过G0/G1期限制点进入S期,细胞周期加快,使细胞以更快的速度异常增殖。而有研究表明CyclinD的异常表达与肿瘤的发生密切相关[13],上述这些因素都可能导致癌症的发生。但本实验MTT和细胞周期结果显示,这种增殖作用具有的剂量和时间的依赖关系是在一定浓度和时间内产生的,并且是短暂和可逆的。因此,我们认为胰岛素虽然能诱导MDA-MB-543细胞加快进入细胞周期S期增殖,并呈明显的剂量和时间依赖关系,但这种作用是短暂和可逆的,临床应用是安全的。这与田春桃等[14]的结论一致。但是否存在其他激活机制,胰岛素类似物是否具有相同的增殖作用及在靶向治疗中的应用等问题值得进一步探讨。
表2 胰岛素(作用16 h)浓度对MDA-MB-543细胞周期的影响(n=6,±s)Tab.2 Effect of Insulin(action time 16 h)concentration on the MDA-MB-543 cell cycle(n=6,±s)

表2 胰岛素(作用16 h)浓度对MDA-MB-543细胞周期的影响(n=6,±s)Tab.2 Effect of Insulin(action time 16 h)concentration on the MDA-MB-543 cell cycle(n=6,±s)
与对照组比较:1 P<0.05,2 P<0.01Compared with control group:1 P<0.05,2P<0.01
组 别 浓度/(mU/mL)细胞周期分布/%G0/G1 S G2/M对照组 - 56.4±1.2 30.8±1.0 12.8±1.2胰岛素组 1 51.4±1.31 35.6±1.41 13.0±1.3 5 47.5±1.52 48.7±1.72 13.8±1.5 10 22.9±2.22 62.5±2.32 14.6±1.9 20 35.8±1.82 50.2±2.02 14.0±1.6 40 51.5±1.6 34.8±1.7 13.7±1.4
表3 胰岛素(10mU/mL)作用时间对MDA-MB-543细胞周期的影响(n=6,±s)Tab.3 Effect of Insulin(10mU/mL)time on the MDA-MB-543 cell cycle(n=6,±s)

表3 胰岛素(10mU/mL)作用时间对MDA-MB-543细胞周期的影响(n=6,±s)Tab.3 Effect of Insulin(10mU/mL)time on the MDA-MB-543 cell cycle(n=6,±s)
与对照组比较:1 P<0.05,2 P<0.01Compared with control group:1 P<0.05,2P<0.01
组 别 作用时间/h细胞周期分布/%G0/G1 S G2/M对照组 - 56.3±1.2 30.6±1.2 12.7±1.1胰岛素组 2 52.4±1.31 34.6±1.41 13.0±1.3 4 47.2±1.51 39.6±1.61 13.2±1.5 8 39.5±1.72 46.5±1.82 14.0±1.7 16 23.9±2.22 61.3±2.52 14.8±1.9 24 52.6±1.61 43.8±1.71 13.6±1.4 32 55.5±1.1 31.5±1.1 13.0±1.2
[1]Yang Y X,Hennessy S,Lewis J D.Insulin therapy and colorectal cancer risk among type 2 diabetes mellitus patients[J].Gastroenterology,2004,127:1044-1050.
[2]Hemkens L G,Grouven U,Bender R,etal.Risk of malignancies in patients with diabetes treated with human insulin or insulin analogues:a cohort study[J].Diabetologia,2009,52(9):1732-1744.
[3]王桂林.胰岛素类似物的临床研究进展[J].华夏医药,2009,4(6):469-471.
[4]龚 衍,李尚为,樊 伟.胰岛素促进体外培养的小鼠卵巢颗粒细胞增殖[J].四川生理科学杂志,2008,30(2):64-65.
[5]周 平,徐启革,冯海燕.高糖和不同浓度胰岛素对血管平滑肌细胞增殖的影响[J].国际病理科学与临床杂志,2010,7(3):191-195.
[6]黄春荣.胰岛素控制妊娠期糖尿病血糖对妊娠结局的影响[J].中国生化药物杂志,2010,31(5):348-350.
[7]黄 颖,邹天宁.体质量指数、胰岛素与胰岛素样生长因子1在乳腺癌中相关性的研究[J].医学综述,2010,16(12):1802-1804.
[8]赵 敬,朱元喜,薛凤霞.胰岛素与乳腺癌关系的进展研究[J].国外医学:妇产科学分册,2006,33(2):138-141.
[9]吴智春,王 浩,于华芸.与细胞增殖有关的胰岛素信号通路[J].中国老年学杂志,2009,29(15):1988-1990.
[10]范雪晖,王红霞,徐振平.不同浓度胰岛素对体外培养新生鼠心肌细胞生长和增殖的影响[J].中国组织工程研究与临床恢复,2008,12(28):5466-5468.
[11]欧晓红.靶向治疗中胰岛素的载体作用[J].生物医学工程学杂志,2000,17(1):87-90.
[12]Mawson A,Lai A,Carroll JS,etal.Estrogen and insulin/IGF-1 cooperatively stimulate cell oprogression in MCF-7 breast cancer cells through differential regulation ofc-Myc and cyclinD1[J].Mol Cell Endocrinol,2005,229(1/2):161-173.
[13]刘珊英,李 焱,潘秋辉,等.甘精胰岛素和人胰岛素对人乳腺癌MDA-MB-231细胞的增殖作用[J].中国药理学通报,2010,26(6):719-722.
[14]田春桃,焦顺昌,魏秀芳.胰岛素对人乳腺癌细胞株化疗增效作用的体外研究[J].中华肿瘤防治杂志,2006,13(21):1617-1619.

