三维适形放疗同步应用铂金属和紫杉醇对食管癌的临床疗效
周江云 尤圣勇 彭康明
食管癌的发病率在我国居恶性肿瘤发病率和病死率的第二位,仅次于胃癌,确诊时80%已为中晚期,失去了根治切除的机会[1],单纯放疗或化疗疗效不佳,目前临床常以放化疗同期治疗,但不良反应发生率较高。三维适形放疗(3D-CRT)近年被广泛应用于食管癌的治疗中,提高有效率同时减轻了不良反应[2],应用三维适形放疗和化疗联合治疗方式为食管癌的综合治疗开辟了新的途径[3,4],另外,一些新药如紫杉醇(paclitaxel,PTX)、奈达铂(nedaplatin,NDP)等在临床的推广,为食管癌的治疗提供了更多药物及方案的选择。我科应用3D-CRT和化疗联合方式治疗中晚期食管癌92例,现报告如下。
1 资料与方法
1.1 临床资料
本组患者均为本院肿瘤科2006年9月~2009年2月不能手术的食管癌患者,共92例,其中男性54例,女性38例;年龄48~79岁(平均年龄62岁),卡氏评分(KPS)≥70分,预计生存期>3个月,血常规、肝功能、肾功能、心电图检查等均无放、化疗禁忌症。CT、腹部B超、ECT等检查无远处转移,CT及X线检查具有可测量的客观病灶。将患者随机分为奈达铂和紫杉醇同步放疗组(TN/3D-CRT,A组)、奈达铂同步放疗组(NDP/3D-CRT,B组)和顺铂同步放疗组(DDP/3D-CRT,C组)。3组患者一般资料比较,差异无统计学意义(P >0.05),见表1。
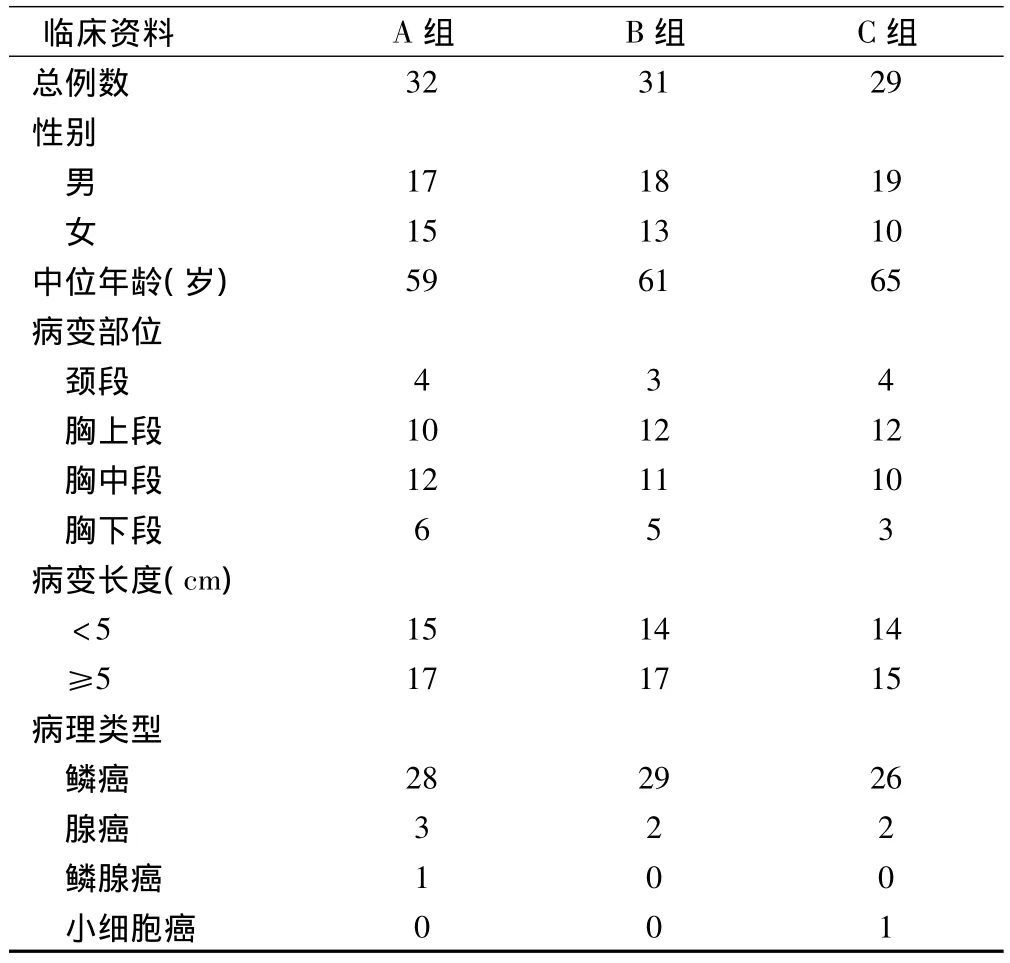
表1 各组临床资料比较(例)
1.2 治疗方法
1.2.1 放疗 3组均采用加速器6MV的X线三维适形放疗,参照食管吞钡造影、胸部CT、食管镜检查勾画食管肿瘤靶区(GTV)及危及器官(OAR),包括脊髓、两侧肺等。临床靶区(CTV)纵轴:GTV的近端和远端各外放4.0 cm;横轴:GTV外放 1.8 cm,淋巴结包括临近1~2个淋巴结引流区,计划靶区(PTV)在CTV外放6 mm,并根据剂量体积直方图(DVH)设计出优化的治疗方案。90%的等剂量线包括PTV并以该等剂量线作为处方剂量,PTV内部剂量差异在±5%以内,脊髓受照量在50%的等剂量线以下,肺受照V20<30%。常规分割(2 Gy/次,5次/周),照射总剂量为60 ~70 Gy。
1.2.2 化疗 放疗开始即给予化疗,化疗前常规给予地塞米松、西米替丁、格拉司琼等。每周复查血常规和肝肾功能,对白细胞数低于正常者,每周查2~3次,对白细胞、血小板水平下降者,给予升白细胞及升血小板药物治疗。A组:每3周 PTX 135 mg/m2,静滴3 h,d1;NDP 25 mg/m2,静滴 3 h,d1~3;至放疗结束。B组:每3 周应用 NDP 30 mg/m2,静滴 3 h,d1 ~3,至放疗结束。C组:每3周应用DDP 30 mg/m2,静滴3 h,d1~3;至放疗结束。治疗前均行食管吞钡造影、食管镜及胸部增强CT检查,治疗结束即放疗完成,复查食管吞钡检查并记录原发肿瘤消退情况。治疗前后均检查肝肾功能及血象,并记录胃肠道反应、骨髓抑制等不良反应及放射反应。
1.3 评价标准
食管病灶近期疗效按照RECIST实体瘤疗效评价标准[5],分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),有效为CR+PR。不良反应评价:参照RTOG放射毒性标准[6]评估放射性食管炎反应;血液学等不良反应按照美国国立肿瘤研究所(NCI-CTC)抗癌药急性和亚急性毒性表现和分级标准进行评价;分为0 ~ Ⅳ级[7]。
1.4 随访情况
随访时间12~36个月,B组2例失访,C组1例失访,随访率97%。
1.5 统计学方法
采用SPSS13.0统计软件,计数资料采用χ2检验,计量资料采用t检验,采用Kaplan-Meier法计算生存率。
2 结果
2.1 近期疗效
本组病例均按计划完成治疗,无因不良反应停止化疗或中断放疗者。治疗后总有效率为79.3%,三组间差异有显著性意义(P<0.05),见表2。
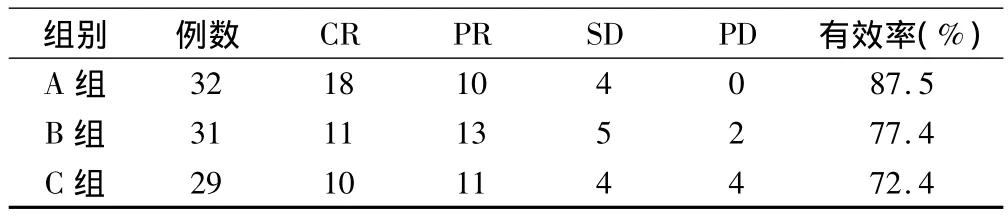
表2 3组近期疗效比较(例)
2.2 远期疗效
3组1、2、3年生存率:A组(随访32例)分别为90.6%、68.8%、43.8%;B 组(随访 29 例)分别为89.7%、62.1%、27.6%;C 组(随访 28 例)分别为89.3%、53.6%、17.8%。3 组1 年生存率比较差异无统计学意义(P>0.05),2年生存率比较差异均有显著性意义(P<0.05),3年生存率C组与A、B组比较有显著性差异,A组与B组间无显著性差异。
2.3 不良反应
本组患者均完成治疗,未出现Ⅳ级白细胞减少、Ⅲ级以上血小板和血红蛋白减少及Ⅲ级以上放射性食管炎和恶心呕吐。由表3可见,A组Ⅱ~Ⅲ级白细胞下降18例(56.3%),B 组 10例(32.3%),C 组 8例(27.6%),A 组发生率明显高于 B、C 组(P <0.05),B、C组间比较差异无统计学意义(P>0.05)。Ⅱ级血小板和血红蛋白水平下降发生率、Ⅱ~Ⅲ级放射性食管炎发生率3组间比较均无统计学意义。恶心呕吐发生率 A组(53.1%)略高于 B组(35.5%)和 C组(44.8%)(P <0.05)。
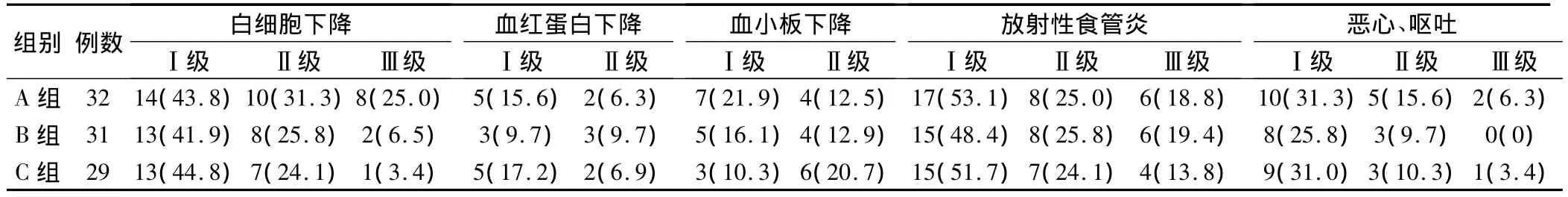
表33 组治疗后不良反应情况(例,%)
3 讨论
放疗有较好地直接抗肿瘤效应,但是放疗是局部治疗,不能减少新的转移瘤的出现,化疗可杀死射野以外的肿瘤细胞,弥补放射治疗的不足,并且可以缩小肿瘤体积,减少肿瘤组织营养和氧的供应,对放疗有增敏作用等,目前研究认为同期放化疗的近期疗效较好,但不良反应发生率较高,尤其是放射性食管炎的发生率显著增高[8]。另外,研究显示,提高放射剂量对提高生存率并无明显优势,主要原因是急性不良反应发生率明显提高[9]。因此探索合适的放疗方式以及选择毒性更低更有效的化疗药物成为临床研究的热点。
3D-CRT技术是应用CT模拟定位,与常规模拟机食管造影定位比较,能更清楚、准确地显示肿瘤局部浸润和淋巴结转移情况、食管的自然走形以及所需要保护的器官范围,提高了靶区勾画准确性,最大限度地使正常组织避免不必要的照射,进而提高食管癌放射治疗的疗效,减轻正常组织不良反应[10]。
PTX是目前在食管癌中应用最广泛的新药[11],抗癌机理主要是通过促进微管蛋白组装成微管及阻止其解聚,从而使细胞的微管失去正常的功能,抑制肿瘤细胞有丝分裂,抑制纺锤体和纺锤丝的形成,最终导致肿瘤细胞凋亡。由于可使癌细胞阻滞于放射敏感性最高的G2/M期,故还有局部增敏作用[12]。NDP是第二代铂类化合物,溶出度大约是DDP的10倍,无需水化,其抗癌机制与DDP相同,主要与核苷生成核苷-铂结合物,与DNA结合破坏DNA结构和功能,抑制DNA复制。Inaba等[13]认为,NDP治疗食管癌比DDP更有效,而且胃肠道毒性更低。PTX与NDP或DDP无交叉耐药性,联合应用可以明显提高疗效[14]。
我们比较TN/3D-CRT方案、NDP/3D-CRT方案和DDP/3D-CRT方案的疗效,结果显示TN/3D-CRT方案能有效提高近期疗效和远期疗效,但是不良反应也较重。NDP/3D-CRT相对DDP/3D-CRT方案,近期疗效和2年生存率有所提高,胃肠道反应也轻,但骨髓抑制反应稍重。综上所述,TN/3D-CRT方案对中晚期食管癌疗效较好,不良反应可耐受,是治疗中晚期食管癌患者较好的方案,考虑患者的生存质量,是否可采用PTX脂质体来减轻不良反应还有待进一步临床验证。
[1]肖正红,张 敏,王春燕,等.放疗同步应用吉西他滨治疗中晚期食管癌的临床观察〔J〕.实用癌症杂志,2011,26(5):511.
[2]Leichman L,Thomas CR.Squamous cell cancer of the esophagus:the forgotten one〔J〕.Gastrointest Cancer Res,2011,4(1):22.
[3]Frechette E,Buck D,Kaplan BJ,et al.Esophageal cancer:outcomes of surgery,neoadjuvant chemotherapy,and threedimension conformal radiotherapy〔J〕.J Surg Oncol,2004,87(1):68.
[4]陈 剑,张鼎儒,郭宇飞,等.食管癌放疗后复发三维适形放疗的临床观察〔J〕.实用癌症杂志,2010,25(5):500.
[5]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors〔J〕.Journal of the National Cnacer Institute,2000,92(3):205.
[6]James D,Johnn-Stetz BZ,Pajak TF.Toxicity criteria of the Radiation Therapy Oncology Group(RTOG)and Eoropean Organization for Research and TreatmentofCancer(EORTC)〔J〕.Int Radiat Oncol Biol Phys,1995,31:1341.
[7]孙 燕,周际昌.临床肿瘤内科手册〔M〕.第4版.北京:人民卫生出版社,2003:2.
[8]Chen J,Zhu J,Pan J.Postoperative radiotherapy improved sur-vival of poor prognostic squamous cell carcinoma esophagus〔J〕.The Annals of Thoracic Surgery,2010,90(2):435.
[9]Minsky BD,Pajak TF,Ginsberg RJ,et al.INT 0123(Radiation Therapy Oncology Group 94-05)phaseⅢtrail of combined-modality therapy for esophageal cancer:high-dose versus standard-dose radiation therapy〔J〕.J Clin Oncol,2002,20:1167.
[10]Werner-Wasik M,Yorke E,Deasy J,et al.Radiation dosevolume effects in the esophagus〔J〕.International Journal of Radiation Oncology Biology Physics,2010,76(3 Suppl):S86.
[11]Zhong HJ,Wang JF,Ying JE.Progress of chemotherapy application in comprehensive therapy for esophageal carcinoma〔J〕.Oncology Section Foreign Medical Sciences,2007,34(5):368.
[12]Hanauske AR,Degen D,Hilsenbeck SG,et al.Effects of tanotere and tanolon in vitro colony formation of freshly enplanted human tumour cells〔J〕.Anticancer Drugs,1992,3(2):121.
[13]Inaba H,Tsuda T,Miyazaki A,et al.Clinical study of the combina-tion of small amount ofnedaplatin(CDGP)/5-Fu with radiation for the treatment of esophageal cancer〔J〕.Nippon Shokakibyo Gakkai Zasshi,2002,99(10):1191.
[14]Gong Y,Ren L,Zhou L,et al.PhaseⅡevaluation of nedaplatin and paclitaxel in patients with metastatic esophageal carcinoma〔J〕.Cancer Chemother Pharmacol,2009,64(2):327.

