皮质酮促进大鼠脊髓背角星形胶质细胞糖皮质激素受体表达
肖菊平,田 虹,曾俊伟,肖 智,刘晓红
(遵义医学院 生理学教研室, 贵州 遵义 563099)
皮质酮促进大鼠脊髓背角星形胶质细胞糖皮质激素受体表达
肖菊平,田 虹,曾俊伟,肖 智,刘晓红
(遵义医学院 生理学教研室, 贵州 遵义 563099)
目的观察皮质酮(CORT)对培养的大鼠脊髓背角星形胶质细胞糖皮质激素受体(GR)表达的影响。方法培养纯化新生SD大鼠脊髓背角星形胶质细胞,免疫荧光标记、免疫印迹技术检测星形胶质细胞GR表达的变化。结果培养的脊髓背角星形胶质细胞均表达GR,CORT可升高星形胶质细胞GR表达。结论药理剂量的CORT可促进脊髓背角星形胶质细胞GR表达。
皮质酮;糖皮质激素受体;脊髓;星形胶质细胞
糖皮质激素(Glucocorticoid,GC)具有抗炎、抑制免疫反应和膜稳定等作用。近年的研究显示,GC在伤害性信息的传递及病理性疼痛时中枢痛敏的形成发展中也起着重要的作用【1-4】。外周神经损伤时,脊髓背角糖皮质激素受体(glucocorticoid reccptor,GR)表达增加,且GR表达与热痛敏和机械痛敏的发展在时间上呈现一致性,鞘内给予GR拮抗剂可明显减轻神经痛症状,表明中枢GR表达促进了病理性神经痛的发生和发展【2,5】。
脊髓背角是机体对伤害性信息进行调制和整合的重要位点。新近研究结果表明,脊髓背角星形胶质细胞在病理性疼痛的发生与维持中起着关键作用。在外周神经损伤模型、外周炎性疼痛以及癌痛模型中,均有不同程度的脊髓背角星形胶质细胞活化, 同时伴有胞外K+和Glu浓度升高、脊髓背角感觉神经元兴奋性升高【6,7】。神经系统几乎所有星形胶质细胞均有GR表达,脊髓星形胶质细胞也存在GR表达【8】。近年诸多实验证实GR参与了星形胶质细胞活性调节,通过抑制或增强星形胶质细胞活性而参与不同的生理和病理过程【9-11】。然而,影响星形胶质细胞GR表达的因素并不十分清楚。在伤害性刺激等应急状态下,机体GC分泌显著增加,高浓度的GC是否会影响脊髓背角星形胶质细胞GR表达及活性,尚未见报道。本研究采用免疫荧光多重显色及免疫印迹技术,观察到培养的脊髓背角星形胶质细胞均有GR表达,皮质酮(corticosterone,CORT)可导致星形胶质GR表达升高。
1 材料与方法
1.1 主要试剂和器材 1~3 d SD乳鼠,由重庆第三军医大学实验动物中心提供的成年大鼠 【许可证号SCXK(渝) 2007-0005】 所生;DMEM/F12培养基、胎牛血清和胰蛋白酶为Hyclone 产品;兔源GR抗体、小鼠源胶质纤维酸性蛋白(GFAP) 抗体为美国Santa 公司产品;CORT为美国Sigma公司产品;激光扫描共聚焦显微镜 (德国 Leica TCS SP2);DU-600紫外分光光度计(Beckman,美国);电泳仪、电泳槽、TRANS-BLOT SD半干电转移系统(BioRad,美国)。
1.2 方法
1.2.1 脊髓背角星形胶质细胞的培养与鉴定 SD 乳鼠 (<3 d),乙醚麻醉,75%乙醇消毒,解剖显微镜下取出脊髓背角组织,1.25 mg/ mL 胰蛋白酶37 ℃培养箱内消化30 min,胎牛血清终止消化,吹打成细胞悬液,接种于75 mL培养瓶内,放置于含5%CO2、37 ℃ 培养箱内。培养10 d 后细胞铺满瓶底,传代两次后接种在盖玻片上培养24 h,40 g/ L多聚甲醛固定15 min,0.01 mol/ L PBS 漂洗,加入小鼠源GFAP 单克隆抗体1∶100,37 ℃ 1 h,4 ℃ 过夜后取出,加入山羊抗小鼠IgG (1:200),37 ℃ 1 h。显微镜下观察GFAP 阳性细胞为星形胶质细胞,GFAP 阳性细胞>98%。
1.2.2 脊髓背角星形胶质细胞GR及GFAP免疫荧光双重标记 将纯化的星形胶质细胞接种于小盖玻片上,接种密度104个,培养24 h;4%多聚甲醛固定10min,0.01mol PBS 漂洗;加入含兔GR抗体的抗体稀释液1∶100,37℃孵育2h,4℃过夜; 0.01mol/L PBS 漂洗5 min×3 次,入含有DyLightTM488 标记的山羊抗兔IgG的0.01mol/L PBS(1∶200)中37℃ 1 h;0.01mol/L PBS 漂洗5 min×3 次,入含小鼠GFAP抗体的抗体稀释液(1∶200)37℃1 h,4℃ 过夜;0.01mol/L PBS 漂洗5 min×3次,入含有DyLightTM594标记的山羊抗小鼠IgG的0.01mol/L PBS(1∶200)中37℃1h; 0.01mol/L PBS 漂洗5 min×3次, DAPI(1∶1000)孵育5min标记所有细胞核DNA,0.01mol/L PBS 漂洗5 min×3次;甘油:PBS = 1∶1 的封片液封片,在激光共聚焦显微镜下观察并采集图象。阴性对照以0.01mol/L PBS代替一抗,其余步骤完全相同,注意避光操作。星形胶质细胞核GR表达强度用 Image - Pro Plus 6.0 专业图像分析软件分析,采集选定细胞核的平均光密度值,进行统计学分析。
1.2.3 免疫印迹技术检测培养的星形胶质细胞GR蛋白 取生长良好、已融合成片的纯化脊髓背角星形胶质细胞,提取各组细胞总蛋白,考马斯亮蓝法测定蛋白浓度,每孔蛋白上样量30 μg 行 SDS- PAGE 电泳,半干转仪将凝胶中的蛋白转移至 PVDF 膜上,6 %脱脂奶粉封闭2 h,加入兔抗GR多抗(1∶250),同时加入小鼠抗β-actin单抗(1∶2000),4℃孵育过夜。PBS 洗膜,加入抗兔HRP-IgG和抗鼠HRP-IgG(1∶2500),室温反应1h。加化学发光显色试剂,X 射线曝光显影,β- actin 为内参照,扫描分析软件系统(LabworksTMAnalysis Software,美国) 分析数据,分析结果以每个条带的积分光密度(IOD) 值与其相对应的β-actin的IOD值之比表示蛋白的相对表达水平。
1.3 统计学处理 采用 SPSS 13.0统计软件进行分析,两组间差异比较采用两独立样本的t检验,多组均数间差异比较用单因素方差分析,以P<0.05为有统计学意义。
2 结果
2.1 培养星形胶质细胞的形态和纯度鉴定 倒置相差显微镜下见原代培养的脊髓背角星形胶质细胞生长在底层,上层有少突胶质细胞和小胶质细胞生长(见图1A)。经传代纯化的脊髓背角星形胶质细胞以原浆型为主,呈片状生长,细胞边界清楚,胞体扁平,形态不规则,核浆界限清楚,胞核呈圆或卵圆形,常位于胞体一侧(见图1B)。GFAP为星形胶质细胞的标志物,用免疫组化方法鉴定培养的细胞中GFAP免疫反应阳性率>98%,表明培养的星形胶质细胞纯度高(见图1C)。
2.2 脊髓背角星形胶质细胞表达GR 免疫荧光双重染色结合DAPI核标记显示,几乎所有培养的脊髓背角星形胶质细胞均表达GFAP (红色)和GR (绿色),而在阴性对照细胞只有4',6-diamidino -2-phenylindole(DAPI)核DNA标记蓝色荧光。激光共聚焦扫描显微镜下观察, GR主要表达于星形胶质细胞胞浆和胞核(见图2)。
2.3 皮质酮对培养脊髓背角星形胶质细胞GR表达的影响 免疫荧光染色结果显示,不同浓度CORT (0.1μmol/L,1μmol/L,10μmol/L)孵育3 h,脊髓背角星形胶质细胞GR表达增加,尤其是细胞核GR表达增强最为显著(见图3) 。对不同浓度CORT作用的星形胶质细胞核进行光密度统计分析,结果显示,CORT在0.1~10μmol/L,随着浓度的增加,星形胶质细胞GR表达逐渐增强(P<0.01,见图4)。 同样,免疫印迹技术亦检测到,在1μmol/L CORT作用下,培养的星形胶质细胞GR蛋白量明显增加(P<0.01,见图5)。该实验结果提示,药理浓度的CORT可促进培养的脊髓背角星形胶质细胞GR表达。

注: A:原代培养的星型胶质细胞; B:传代纯化的星型胶质细胞; C:纯化的脊髓背角星形胶质细胞GFAP表达。图1 培养星形胶质细胞的形态及纯度鉴定
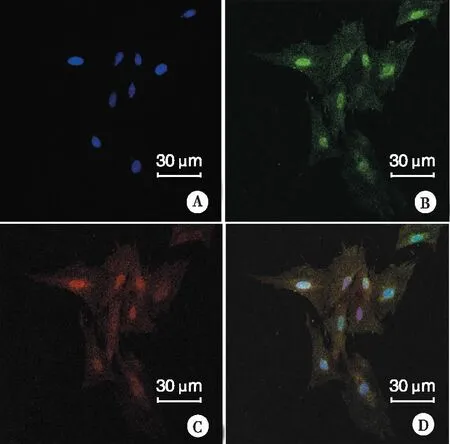
注: A:DAPI标记核DNA;B:GFAP表达;C:GR表达;D:同一视野下A,B,C合并。图2 免疫荧光双重染色观察脊髓背角星形胶质细胞GR表达

注:A:control;B:0.1μmol/L CORT;C:1μmol/L CORT;D:10μmol/L CORT。图3 CORT导致脊髓背角星形胶质细胞GR表达增高

注:**P<0.01,与对照组比较。图4 CORT(0.1-10μmol/L)随着浓度的增加,脊髓背角星形胶质细胞GR表达逐渐增强

注:A:GR蛋白免疫印迹检测结果; B:免疫印迹检测GR蛋白表达的统计分析;**P<0.01,与对照组比较。图5 CORT(1μmol/L)致脊髓背角星形胶质细胞GR蛋白表达增加
3 讨论
Yan等通过免疫组织化学技术观察到,在成年大鼠脊髓星形胶质细胞存在GR表达【8】。本实验免疫荧光双重标记检测表明,几乎所有体外培养的大鼠脊髓背角星形胶质细胞均表达GR,这为进一步探索GC通过GR调节脊髓背角星形胶质细胞活性的功能研究提供了形态学依据。
GC对机体内多种组织和细胞发挥着广泛的作用,对神经系统的发育与分化、神经元的损伤与再生以及突触可塑性等均有重要的调节作用。近年的研究显示, GR参与了痛觉信息的传导,外周神经损伤时,脊髓背角GR表达增加促进了病理性神经痛的发生和发展【2,5】。然而神经病理性疼痛时,究竟哪些因素促进了中枢GR表达变化,并不十分清楚。伤害性刺激导致疼痛时,机体分泌GC显著增加,高浓度的GC是否会影响脊髓背角星形胶质细胞GR表达尚不清楚。本实验采用免疫荧光及免疫印迹技术均观察到,在药理剂量的CORT作用下,培养的脊髓背角星形胶质细胞GR表达明显增加,呈现剂量依赖性。GR表达增加能否调节脊髓背角星形胶质细胞的活性,继而促进或者抑制星形胶质细胞释放某些神经递质如Glu,转而参与脊髓水平痛觉信息的调制有待进一步研究。
RU38486是糖皮质激素胞浆受体拮抗剂,可阻止糖皮质激素与其胞浆受体的结合。我们前期实验发现鞘内给予GR拮抗剂RU38486可明显减轻坐骨神经慢性压迫损伤所致的神经痛【12】,RU38486的镇痛作用是否部分通过脊髓背角星形胶质细胞而发挥作用尚待进一步研究确定。
【1】 Alexander J K,DeVries A C,Kigerl K A,et al.Stress exacerbates neuropathic pain via glucocorticoid and NMDA receptor activation【J】.Brain Behav Immun,2009,23(6):851-860.
【2】 Wang S,Lim G,Zeng Q,et al.Central glucocorticoid receptors modulate the expression and function of spinal NMDA receptors after peripheral nerve injury【J】.J Neurosci,2005,25(2):488-495.
【3】 Wang S,Lim G,Yang L,et al.Downregulation of spinal glutamate transporter EAAC1 following nerve injury is regulated by central glucocorticoid receptors in rats【J】.Pain,2006,120 (1-2):78-85.
【4】 Wang S,Lim G,Mao J,et al.Central glucocorticoid receptors regulate the upregulation of spinal cannabinoid-1 receptors after peripheral nerve injury in rats【J】.Pain,2007,131(1-2):96-105.
【5】 Takasaki I,Kurihara T,Saegusa H,et al.Effects of glucocorticoid receptor antagonists on allodynia and hyperalgesia in mouse model of neuropathic pain【J】.Eur J Pharmacol,2005,524(1-3):80-83.
【6】 Hald A,Nedergaard S,Hansen R R,et al.Differential activation of spinal cord glial cells in murine models of neuropathic and cancer pain【J】.Eur J Pain,2009,13(2):138-145.
【7】 Wang W,Wang Y,Huang J,et al.Temporal changes of astrocyte activation and glutamate transporter-1 expression in the spinal cord after spinal nerve ligation-induced neuropathic pain【J】.Anat Rec (Hoboken),2008,291(5):513-518.
【8】 Yan P,Xu J,Li Q,et al.Glucocorticoid Receptor Expression in the Spinal Cord after Traumatic Injury in Adult Rats【J】.The Journal of Neuroscience,1999,19(21):9355-9363.
【9】 Crossin K L,Tai M H,Krushel L A,et al.Glucocorticoid receptor pathways are involved in the inhibition of astrocyte proliferation【J】.Proc Natl Acad Sci U S A,1997,94(6):2687-2692.
【10】 Liu Y,Imai H,Sadamatsu M,et al.Cytokines participate in neuronal death induced by trimethyltin in the rat hippocampus via type II glucocorticoid receptors【J】.Neurosci Res,2005,51(3):319-327.
【11】 Revsin Y,Rekers N V,Louwe M C,et al.Glucocorticoid receptor blockade normalizes hippocampal alterations and cognitive impairment in streptozotocin-induced type 1 diabetes mice【J】.Neuropsychopharmacology,2009,34(3):747-758.
【12】 李敏,肖菊平,曾俊伟,等.脊髓糖皮质激素受体在神经病理性疼痛中的作用【J】.第三军医大学学报,2012,34 (17):1719-1721.
Elevationofglucocorticoidreceptorexpressioninratdorsalspinalcordastrocytesbycorticosterone
Xiaojuping,Tianhong,Zengjunwei,Xiaozhi,Liuxiaohong
(Department of Physiology,Zunyi Medical College,Guizhou Zunyi 563099,China)
ObjectiveTo investigate the effects of corticosterone -(CORT) on glucocorticoid receptor(GR) expression in cultured rat dorsal spinal cord astrocytes.MethodsAstrocytes from neonatal SD rat spinal cord were cultured and purified.Astrocyte GR expression was detected by immunofluorescence and western blot assay.ResultsImmunofluorescence labeling indicated that GR were shown in most of glial fibrillary acidic protein -(GFAP) positive cultured dorsal spinal cord astrocytes.CORT increased astrocyte GR protein expression.ConclusionCORT could promote GR expression in cultured dorsal spinal cord astrocytes.
corticosterone;glucocorticoid receptor;spinal cord;astrocyte
国家自然科学基金资助项目(NO:30960126);遵义医学院博士科研启动基金资助项目(NO: 2008)。
刘晓红,女,博士,教授,研究方向:疼痛生物学机制研究,E-mail:lxh680718@yahoo.com.cn。
R329.27;R338.1
A
1000-2715(2012)05-0367-04
【收稿2012-08-12;修回2012-09-02】
(编辑:谭秀荣)

