石见穿多糖抑制人胃癌细胞系MGC-803细胞迁移及其机制的初步研究
朱红岩 孙玉国 曲杰 卞永生 .承德医学院,河北承德 067000;.承德医学院附属医院,河北承德 067000;3.河北省保定市第一医院,河北保定 07000
石见穿多糖抑制人胃癌细胞系MGC-803细胞迁移及其机制的初步研究
朱红岩1孙玉国1曲杰2卞永生3▲1.承德医学院,河北承德 067000;2.承德医学院附属医院,河北承德 067000;3.河北省保定市第一医院,河北保定 071000
目的观察石见穿多糖对人胃癌细胞系MGC-803细胞迁移能力的影响,并探讨其作用机制。方法利用水萃取法制备石见穿多糖,通过划痕实验、Transwell实验观察不同浓度对石见穿多糖同样条件培养下胃癌MGC-803细胞迁移能力的影响,并采用Western blot方法检测不同浓度石见穿多糖对MGC-803细胞内白介素8(IL-8)蛋白表达水平的影响。结果同未加药物对照组相比,经高浓度石见穿多糖(50、100 g/L)处理后,MG-63细胞的划痕愈合能力明显减弱,穿膜细胞的数量显著减少;同时,细胞内IL-8蛋白的表达水平明显降低,并与石见穿多糖的浓度有关。结论石见穿多糖抑制了胃癌MGC-803细胞的迁移能力,其作用与抑制MGC-803细胞内的IL-8蛋白表达水平有关。
石见穿多糖;MGC-803细胞;白介素8;迁移
石见穿为唇形科植物华鼠尾Salvia chinensis Benth.的全草,味苦、辛,性平,具有清热解毒、活血镇痛的功能。临床上多用于治疗黄疸型肝炎、癌症、肾炎、痛经等[1]。动物实验证明,石见穿能抑制或杀灭癌细胞,使患病小白鼠生存期显著延长,能增强实验动物的免疫功能[2]。到目前为止,从石见穿全草中分离出的包括多糖类、三萜类、甾醇类、多酚类等化学成分已达33种之多[3],其中石见穿多糖(Salvia chinensis Benth.Polysaccharides,SBP)是石见穿的重要活性成分之一,具有调节免疫、抗氧化、抗肿瘤的功能[4]。近年来对石见穿多糖抗肿瘤作用的研究主要是其抑制肿瘤的增殖[5-6],关于其抑制肿瘤细胞迁移功能的研究报道较少。本研究旨在观察石见穿多糖对人胃癌细胞系MGC-803细胞体外迁移能力的影响,并探讨其可能的机制。
1 材料与方法
1.1 材料
1.1.1 细胞株人胃癌MGC-803细胞,由承德医学院附属医院中心实验室提供。
1.1.2 药物石见穿药材购自河北安国市药材市场,由承德医学院赵春颖副研究员鉴定为为唇形科鼠尾草植物紫参Salvia chinensis Benth.的全草,样品保留在承德医学院中药研究所。
1.1.3 试剂RPMIMedium1640培养基干粉和胎牛血清(FBs)购自GIBCO公司,胰蛋白酶购自Amersco公司产品,IL-8及β-actin抗体购自Sigma公司,辣根过氧化物酶标记的二抗购自北京中杉金桥公司。
1.1.4 仪器Primo R型低温高速离心机(德国Heraeus公司),CO2培养箱(美国Forma公司),倒置荧光显微镜(Zeiss公司),HFsafe-1500型生物安全柜(HEAL FORCE公司),Transwell小皿(Millipore公司),3633型高压消毒锅(美国Yamato scientificwc公司),HP-8453紫外-可见分光光度计(惠普公司),梅特勒-托利多AG245电子分析天平(瑞士梅特勒-托利多公司)。
1.2 方法
1.2.1 细胞培养将MG-XX细胞置于37℃、5%CO2的培养箱中,用含10%胎牛血清以及青、链霉素各100 U/mL的RPM1640培养液培养。倒置显微镜下观察细胞生长情况,0.25%胰蛋白酶消化传代,取对数生长期细胞用于实验。
1.2.2 石见穿多糖制备根据文献[7],称取适量石见穿。用石油醚于索氏提取器回流5 h,脱去叶绿素等脂类。按水浴温度90℃,料液比为1∶10,提取时间2.5 h,提取4次作为提取工艺,进行回流浸提,冷却后过滤,合并上清液,浓缩后加入无水乙醇,使浓度达到80%得沉淀。沉淀用Savage法去除蛋白5次,再依次用无水乙醇、丙酮反复洗涤,减压干燥得黑色粗多糖粉末。
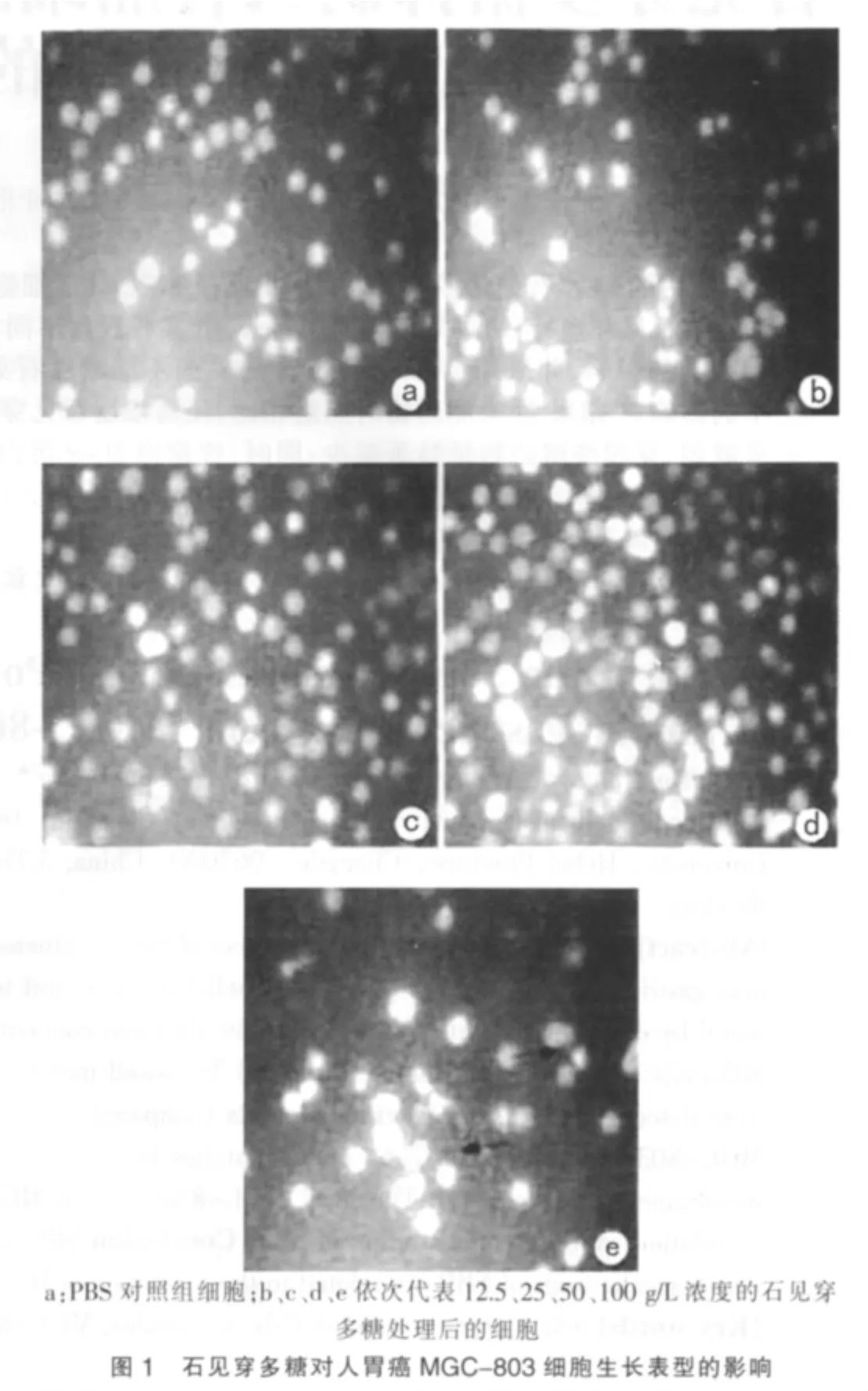
1.2.3 细胞形态学观察将MGC-803悬液接种于6孔培养板,每孔1mL,分别加入100μL不同浓度(100、50、25、12.5 g/L)的石见穿多糖溶液及等量PBS作为对照,常规培养。培养24 h后于倒置相差显微镜下直接观察培养板中肿瘤细胞形态特征。所有浓度下的培养均重复3次,以典型结果作为最终数据。
1.2.4 细胞划痕实验将MGC-803细胞铺满6孔培养板,待细胞贴壁长满后进行划痕,PBS洗一遍,更换为无血清培养基,分别在0 h和24 h后观察划痕距离并拍照。
1.2.5 Tr answe l l实验取指数生长期的MGC-803细胞,胰酶消化,RPM1640培养基制备细胞悬液,进行细胞计数。调整细胞数为每100μL悬液含5×104个细胞进行铺板。24孔培养板中每孔加入600μL含15%小牛血清的RPM1640完全培养基,在Transwell小室的上室分别加入100μLMGC-803细胞悬液,各含5×104个细胞,最后上室加入10μL 1% BSA,使BSA最终浓度为0.1%,以保持上室内的渗透压。加入不同浓度的石见穿多糖100μL,37℃、5%CO2培养箱常规培养15 h。取出小室用90%乙醇固定,0.1%结晶紫溶液染色,置于显微镜下观察并拍照,随机选取4个低倍视野(×400)进行细胞计数,并计算平均值。实验重复3次。
1.2.6 Wes t e r n b l o t实验分别取石见穿多糖处理前后的MGC-803细胞均约5×106个,加入300μL细胞裂解液,冰上裂解30min后转移至1.5mL EP管中,12 000 r/min 4℃离心4min,取上清液置于-20℃保存。BCA法测定蛋白浓度。每个泳道上样蛋白量为40μg,上样于12%聚丙烯酰胺凝胶电泳(SDS-PAGE电泳),80V电泳30 min,120 V电泳90 min,电泳完毕后,将蛋白转移至PVDF膜,用新鲜配制的含5%脱脂奶粉的PBST液摇床上封闭2 h,加入IL-8抗体(1∶500)及抗β-Actin抗体(1∶500),4℃反应过夜。然后将膜取出,用PBST液洗涤3次,每次15 min,辣根过氧化物酶标记的二抗(1∶3 000)室温封闭1 h,然后用PBST液洗涤3次,每次10 min,最后用化学发光法检测,X线片记录结果。实验重复3次。
1.3 统计学方法
采用SPSS 17.0软件进行数据处理,计量资料数据以均数±标准差(±s)表示,多组间的比较采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤细胞形态学变化
正常培养条件下生长的MGC-803细胞形态规则,轮廓清晰,胞体透亮,贴壁良好;而以50 g/L和100 g/L石见穿多糖处理后,肿瘤细胞生长缓慢,胞体皱缩,部分细胞破碎,总体呈分散悬浮生长,贴壁现象减弱甚至消失。当使用较低浓度石见穿多糖处理MGC-803细胞时,其生长表型同正常细胞没有明显变化。见图1。
2.2 划痕实验
划痕实验中通过划痕愈合程度的比较可以判断石见穿多糖对MGC-803细胞迁移能力的影响情况。相同条件培养24 h后,未经石见穿多糖处理的MGC-803细胞运动迁移基本完全覆盖了划痕区域。相反的,加入石见穿多糖以后,MGC-803细胞的迁移能力明显减弱,细胞间划痕的距离缩短趋势减缓,并且石见穿多糖浓度越高MGC-803细胞的迁移受阻越明显。方差分析结果显示,石见穿多糖处理组在作用24 h与未加药物的对照组(石见穿多糖浓度为0)比较,差异有统计学意义(P<0.05),见表1。
2.3 Transwell实验
相较于未进行药物处理的MGC-803细胞,不同浓度的石见穿多糖处理后穿膜细胞的数量均减少,且呈现浓度相关性。结果采用方差分析,差异有统计学意义(P<0.05)。见表2。
2.4 W estern blot实验
已有证据表明细胞因子IL-8参与肿瘤细胞的迁移过程,本研究通过Western blot对石见穿多糖处理的人胃癌MGC-803细胞中IL-8蛋白水平的变化进行了检测。结果显示,经石见穿多糖处理过的MGC-803细胞中IL-8蛋白表达水平较对照组明显降低,其蛋白总量随着石见穿多糖浓度的增加而减少。见图2。
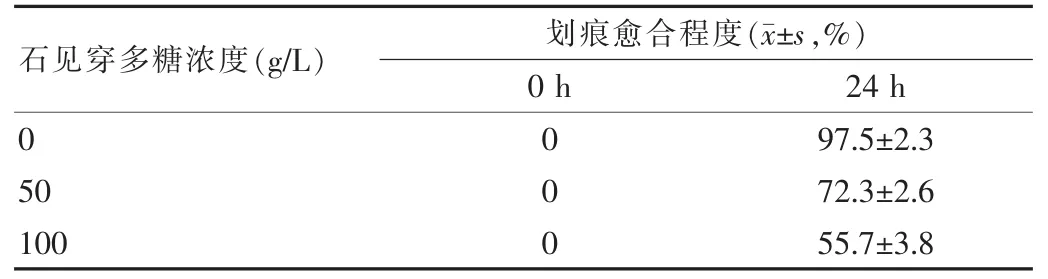
表1 不同浓度的石见穿多糖对人胃癌MGC-803细胞迁移能力的影响
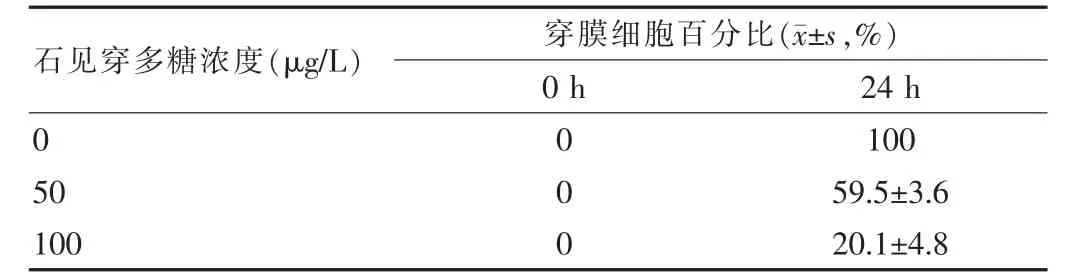
表2 不同浓度的石见穿多糖对人胃癌MGC-803细胞穿膜能力的影响
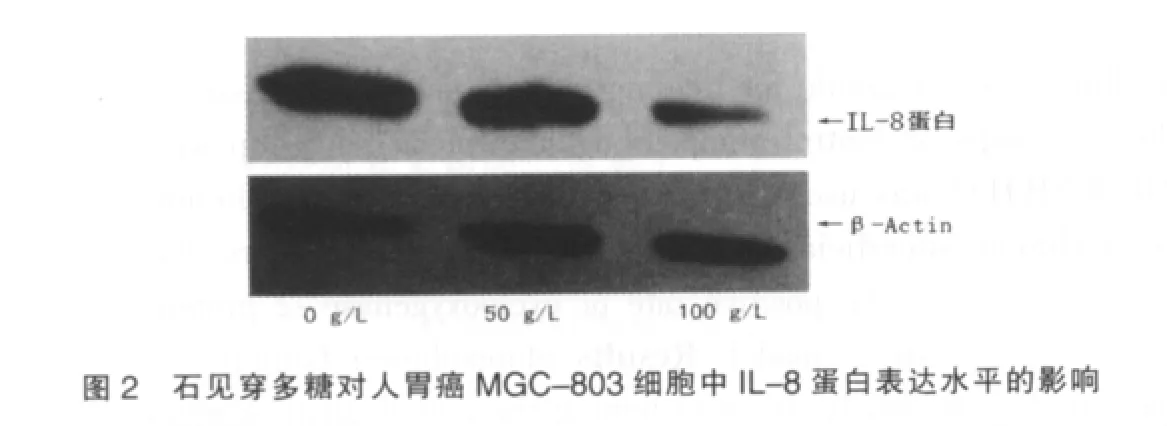
3 讨论
研究表明,胃癌细胞的转移过程伴随着多种细胞因子的异常表达[8]。细胞因子是由多种细胞产生,具有广泛调节功能的多肽分子,参与调控细胞的增殖分化及细胞间的相互作用[9]。根据产生细胞种类和功能的不同,细胞因子可分为多种,且肿瘤细胞亦可合成或分泌其中部分种类的细胞因子[10]。
IL-8是1987年Yoshimur发现的第一个趋化因子,它通过激活和趋化嗜中性粒细胞,在多种炎症反应中发挥作用[11]。近年研究发现,IL-8与肿瘤组织密切相关,在支气管原位癌、肺癌、肝癌等肿瘤组织中均检测到IL-8mRNA及蛋白表达。已有实验及临床数据显示,正常胃黏膜→癌前状态→胃癌的发生过程中IL-8蛋白阳性表达率逐渐升高[12]。有学者通过体外实验发现:IL-8促进肝癌细胞、结肠癌细胞、胰腺癌细胞等细胞的迁移、侵袭力[13-15]。
我国是天然药物大国,应用中草药治疗肿瘤历史悠久,许多中药材因具有抗肿瘤作用被深入研究[16-18]。现代药理研究表明,石见穿具有抗肿瘤效果,常与其他药物配合使用,应用于肝癌、直肠癌及妇科肿瘤的治疗。石见穿全草水提取物主要成分为石见穿多糖,有多种生理活性,如抗菌、抗炎及抗肿瘤等[4]。然而,对其抗肿瘤机制方面的研究较少,本研究中,笔者以人胃癌MGC-803细胞为评价体系,初步研究石见穿多糖对人胃癌细胞转移能力的影响,并对其中的相关机制作出了初步揭示。
本研究结果显示,石见穿多糖对人胃癌MGC-803细胞的迁移有明显的抑制作用,且其与用药浓度呈正向相关。同时,迁移能力减弱细胞中细胞因子IL-8的表达被强烈抑制。据此,笔者推测石见穿多糖抑制人胃癌MGC-803细胞的迁移与其抑制细胞内IL-8蛋白表达水平有关,这也符合已有的研究结果。关于石见穿多糖的化学结构与人胃癌MGC-803细胞核酸构成和蛋白质空间结构的改变正在进一步研究。
[1]谢宗万.石打穿与石见穿的品种考证[J].中国中药杂志,2000,25(1):49-50.
[2]金长娟.七叶灵对Lewis肺癌细胞荷瘤小鼠作用的初步观察[J].上海中医药大学学报2002,16(2):54-55.
[3]徐敬宣,薛姣,钱晓萍,等.石见穿的化学成分及抗肿瘤作用研究进展[J].现代肿瘤医学,2011,19(3):587-590.
[4]Kumazawa Y,Mizunoe K,Otsuka Y.Immunostimulating polysaccharide separated from hot water extrad of angelica acutiloba[J].Kitagawa(Yamato Tohki),1982,47(1):75-83.
[5]韦金育,李延,韦涛,等.50种广西常用中草药、壮药抗肿瘤作用的筛选研究[J].广西中医学院学报,2003,6(4):3-7.
[6]Shoemaker M,Hamilton B,Schanaz H,et al.In vitro anticancer activity of twelve Chinesemedicinal herbs[J].Phytotherapy Research,2005,19(7):649-651.
[7]徐伟,郑海音,郑晓燕,等.石见穿多糖的含量测定及组分分析[J].福建中医学院学报,2008,18(1):20-22.
[8]张筱茵,陈咏仪,刘泳,等.胃癌局部细胞因子表达谱分析[J].中华肿瘤杂志,2002,24(1):14-16.
[9]Kokkas A,Goulas A,Stavrianos C,et al.The role of cytokines in pulp inflammation[J].JBiol Regul Homeost Agents,2011,25(3):303.
[10]Martin FH,Suggs SV,Langley KE,et al.Primary structure and functional expression of rat and human stem cell factor DNAs[J].Cell,1990,63(1):203.
[11]Yoshimura T,Metsushima K,Penheim JJ.Neutrophil chemotactic factor produced by lipopolysacchmide(LPS)-stimulatedhuman blood mononuclear leukocytes:Partial characteri-zation and separation fiom interleu-kinl(IL-l)[J].JImmunol,1987,139(3):788-793.
[12]付浩,袁媛.IL-8基因在胃癌及癌前状态中的表达[J].中国肿瘤临床,2002,29(4):237-240.
[13]Kubo F,Ueno S,Hiwatashi K,et al.Interleukin 8 in human hepatocellular carcinoma orrelates with cancer cell invasion of vessels but not with tumor angiogenesis[J].Ann Surg Oncol,2005,12(10):800-807.
[14]Matsuo Y,Ochi N,Sawai H,et al.CXCL8/IL-8 and CXCL12/SDF-1alpha co-operatively promote invasiveness and angiogenesis in pancreatic cancer[J].Int JCancer,2009,124(4):853-861.
[15]Ning Y,Manegold PC,Hong YK,et al.Interleukin-8 is associated with proliferation,migration,angiogenesis and chemosensitivity in vitro and in vivo in colon cancer cell linemodels[J].Int JCancer,2011,128(9):2038-2049.
[16]赵冬耕,孙佳,王明艳,等.抗癌扶正方对人肝癌细胞SMMC-7721PI3K/ AKT信号通路的影响[J].中国实验方剂学杂志,2012,18(11):136-139.
[17]梁勇,廖颖,张宏,等.黑骨藤的抗肿瘤活性成分[J].中国实验方剂学杂志,2011,17(15):119-122.
[18]冯承恩,田素英.金樱根多糖的制备及其体内抗肿瘤作用初探[J].中国实验方剂学杂志,2011,17(6):209-212.
Effect of the Salvia chinensis Benth.Polysaccharides on themetastasis ability of human gastric cancer cells(MGC-803 cells)
ZHU Hongyan1 SUN Yuguo1 QU Jie2 BIAN Yongsheng3▲
1.Chengde Medical University,Hebei Province,Chengde 067000,China;2.The Affiliated Hospital of Chengde Medical University,Hebei Province,Chengde 067000,China;3.The First People′s Hospital of Baoding City,Hebei Province,Baoding 071000,China
ObjectiveTo investigate theeffectof Salvia chinensis Benth.Polysaccharides(SBP)on themetastasisability ofhuman gastric cancer cell line(MGC-803 cells)in vitro,and to explore the action mechanisms of SBP.MethodsSBP prepared by extraction ofwater,the effect of the different concentration of SBP on the experimentalmetastasis ability of MGC-803 cellswas observed by scratch test and Transwellmetastasis experiments.The level of IL-8 protein in MGC-803 cells were detected by Western Blotting.ResultsCompared with control group(no drug),SBP(50 and 100 g/L)inhibited the MGC-803 cells wound,MG-63 cells scratches healed was significantly weakened,number of cells passing through filter membrane would decrease.The level of IL-8 protein in MG-63 cells decreased significantly after treated with SBP and correlation with the concentration of SBP.ConclusionSBP ia able to inhibit themetastasis ability of MGC-803 cells.The actionmechanisms of SBP are related to the inhibition of IL-8 protein levels in MGC-803 cells.
Salvia chinensis Benth.Polysaccharides;MGC-803 cells;IL-8;Metastasis
R730.52
A
1673-7210(2012)11(b)-0005-03
朱红岩(1987-),男,承德医学院2010级在读硕士研究生,从事肿瘤细胞增殖和迁移方面的研究。
▲通讯作者
2012-06-12 本文编辑:谷俊英)

