处方点评中常见配伍禁忌的分类与处方分析
卢守四,李春艳,田德蔷(.中国康复研究中心北京博爱医院药剂科,北京 00068;2.首都医科大学附属北京天坛医院药剂科,北京 00050)
在处方点评中,处方分为不规范处方、不合理处方和超常处方3类[1]。随着医院HIS系统普及化,不规范处方将逐渐减少;而不合理处方中以配伍禁忌、用法与用量不合理和无适应证用药较多见。其中配伍禁忌主要分为3类:(1)物理性配伍禁忌,即某些药物配合在一起会发生物理变化,即改变了原先药物的溶解度、外观形状等物理性状,给药物的应用造成了困难,物理性配伍禁忌常见的外观变化有分离、沉淀、潮解、液化。(2)化学性配伍禁忌,即某些药物配合在一起会发生化学反应,不但改变了药物的性状,更重要的是使药物减效、失效或毒性增强等,化学性配伍禁忌常见的外观现象有变色、产气、沉淀、水解等。(3)药理性配伍禁忌,即2种或2种以上药物互相配伍后,由于药理作用相反,使药效降低甚至抵消。为进一步增强对配伍禁忌处方的理解、促进处方点评质量、提高合理用药水平,现对我院门诊处方进行回顾性分析。
1 资料与方法
根据我院2010年5月—2011年5月每月某1个工作日(周六、周日除外)处方情况,随机抽取门诊近1 000张处方,共计12次约12 000张处方,对其进行点评,并对其中配伍禁忌进行分类、举例和处方分析。
2 结果
2.1 处方分析结果
通过对12 000张处方分析,不合格处方(不规范处方、不合理处方、超常处方)占0.76%,90张;其中配伍禁忌处方40张,占总处方量的0.34%,占不合格处方总量的44%,而其中以化学性和药理性配伍禁忌处方为主,见表1。
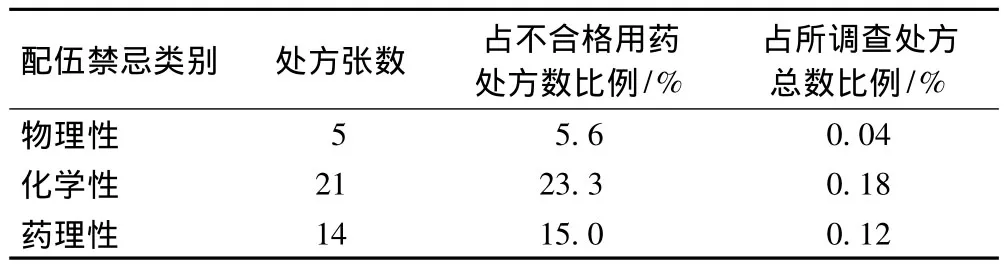
表1 配伍禁忌类处方比例Tab1 Proportion of prescriptions with drug incompatibility
2.2 配伍禁忌处方分析
2.2.1 物理性配伍禁忌:溶剂或载体溶液选择不恰当、无错时服用等。如1例61岁男性患者,诊断为急性胃肠炎,处方为双八面蒙脱石散 3 g×10袋,3 g,tid,po;消旋山莨菪碱片5 mg×10 盒,10 mg,tid,po;头孢克肟胶囊 0.1 g×6 片,0.1 g,bid,po。处方分析:双八面蒙脱石散具有层纹状结构及外均匀性电荷分布,对消化道内的病毒、病菌及其产生的毒素有较强的选择性固定及抑制作用;同时对消化道黏膜有很强的覆盖能力,并通过与黏膜蛋白相结合,从质和量两方面修复,提高黏膜屏障对攻击因子的防御功能,还可以恢复结肠运动功能,降低结肠敏感性,从而保护损伤的肠黏膜,减少黏膜溶解和破坏,发挥疗效。由于双八面蒙脱石散在肠道可以形成保护膜,影响抗菌药物的疗效,若与抗菌药物必须同时应用,按照先吸收再吸附原则,保证易吸收的抗菌药物吸收完全或难吸收的抗菌药物在肠道局部杀菌作用持久,抗菌药物(特别是β-内酰胺类)可以破坏细菌的细胞壁,使菌体表面曝露出更多的极性基团,杀灭细菌后产生的毒素等再被双八面体蒙脱石散吸附。2药联用宜间隔2 h以上,来保证抗菌药物的吸收不受双八面蒙脱石散的影响,否则双八面蒙脱石散会妨碍抗菌药物的杀菌效果,达不到应有的治疗目的。
2.2.2 化学性配伍禁忌:溶剂选择不当或2组液体间的药物发生化学反应。如1例50岁男性患者,诊断为肺部感染、肝硬化。处方为0.9%氯化钠注射液250 mL×1,250 mL,ivgtt,bid;头孢曲松钠0.5 g×2,1.0 g,ivgtt,qd;痰热清注射液10 mL ×3,30 mL,ivgtt,qd;乳酸钠林格液 500 mL × 1,500 mL,ivgtt,qd。处方分析:头孢曲松钠说明书中明确标注不能加入乳酸钠林格注射液(哈特曼氏)以及复方氯化钠注射液(林格)等含钙的溶液中使用,即使通过不同的输液线,也切忌把头孢曲松与含钙溶液或产品同时使用[2]。头孢曲松钠为阴离子,极易与阳离子钙形成不溶性头孢曲松钙沉淀,而含有“沉淀或微粒”的药液绝对不能静脉注射或静脉滴注,《中华人民共和国药典》对此有极为严格的要求,因微粒可阻塞毛细血管,还可在组织中沉积并形成肉芽肿,如发生在心、脑、肾、肺等重要器官,则可导致致死性结局的不良事件。另一方面,头孢曲松钠主要由肾脏排泄(约占给药剂量的33% ~67%),其余部分经胆道系统排泄,故头孢曲松钠在胆汁与肾脏中浓度很高,如与钙离子结合后,可形成不溶性头孢曲松钙沉淀,并很快在胆管或胆囊及肾收集系统形成结石(或泥沙样),易于形成胆结石、肾结石等。痰热清注射液为中药注射剂,主要成分是黄芩、熊胆粉、山羊角、金银花、连翘,具有清热、解毒、化痰的功效,临床与头孢曲松钠、氟喹诺酮类、克林霉素等存在化学性配伍禁忌[3],宜分开滴注,中间宜用0.9%氯化钠注射液冲管30 min左右。
2.2.3 药理性配伍禁忌:与肝酶CYP有关的药物间配伍禁忌。如1例78岁女性患者,诊断为脑血管病后遗症、高血压,处方为尼麦角林胶囊25 mg×20×3,30 mg,po,qd;酒石酸美托洛尔 25 mg×20,25 mg,po,bid;拜阿司匹林肠溶片 0.1 g ×30 ×1,0.1 g,po,qd;苯磺酸氨氯地平片5 mg×7 ×4,5 mg,po,qd。处方分析:α、β肾上腺受体阻断剂能增强尼麦角林对心脏的抑制作用,应禁止联合使用。原因在于尼麦角林和美托洛尔都是由肝酶CYP2D6代谢底物,且二者共同竞争同一底物,增加了二者的血药浓度,加强尼麦角林抑制心脏作用。主要表现为中枢神经系统症状和呼吸抑制;主要的中毒症状有心动过缓、Ⅰ~Ⅲ度房室传导阻滞、心搏停止、血压下降、外周循环灌注不良、心功能不全、心源性休克、呼吸抑制和窒息;也易导致美托洛尔在体内过量及中毒。
3 讨论
3.1 药品说明书是处方点评中重要的法律依据
药品说明书是具有法律性的文件,尽管现实中药品说明书具有一定的滞后性,但仍依据药品说明书、《中华人民共和国药典》、法律与法规等开展处方点评。对于违反药品说明书的用药,医务人员将承担一定的医疗风险。表1显示,尽管药物性配伍禁忌处方在临床处方中所占比例很小,仅为0.34%;其中物理性配伍禁忌为5.6%,但化学性和药理性配伍禁忌所占其比例分别占23.3%和15%,且后2类配伍禁忌较容易导致临床药害事件的发生,值得医生、药师和护师的关注。
3.2 全面掌握药物的理化性质,减少物理性配伍禁忌的发生
药物本身由于理化性质特点,配伍时易出现潮解、液化、沉淀等现象,常造成临床用药困难和不便。建议临床参考《新编308种注射液理化与治疗学配伍检索表》,减少物理性配伍禁忌的发生。
3.3 减少化学性配伍禁忌需高度关注药物配伍间的酸碱性
化学性配伍物禁忌特别是变色、沉淀等化学反应才引起临床医护人员注意,但往往已造成了经济损失,因此,防止化学性配伍禁忌首先关注药物溶剂的酸碱性。如了解0.9%氯化钠注射液和葡萄糖注射液的pH值对药物的影响,选择与药物本身pH值相近的溶剂来溶解或稀释,防止药物结晶、效价降低或药物中毒。5%葡萄糖注射液的pH值为3.5~5.5,而0.9%氯化钠注射液的pH值为4.5~7.0。青霉素G在溶液pH值6.0~6.5时最稳定,氨苄西林在pH值4.7~7.2时最稳定,宜选用0.9%氯化钠注射液做溶剂。同样,呈弱碱性的质子泵抑制剂,如奥美拉唑、泮托拉唑等,应避免选用5%葡萄糖溶液而宜用0.9%氯化钠注射液作溶剂。盐酸胺碘酮注射液(pH=4.08),宜选用等渗的葡萄糖注射液作溶剂,盐酸胺碘酮注射液在该溶剂下更稳定,可保存8 h,且不降低药物的药效[4]。其次,对化学性配伍禁忌的2组输液,中间应输注少量葡萄糖注射液或0.9%氯化钠注射液,防止出现配伍禁忌发生。如奥硝唑与头孢菌素类药先后滴注后,可出现由透明逐渐变为粉红色化学性变化过程,且浓度越大,颜色变化越深;pH值越小,颜色亦越深。特别是护士滴注头孢菌素类药后换用奥硝唑注射液时,未更换输液管线而直接滴注奥硝唑注射液,将导致管线中剩余液体回流至奥硝唑注射液中,致使瓶中pH值发生改变而导致颜色改变。因此,临床药师、医师、护师治疗团队应高度关注化学性配伍禁忌。
3.4 重视药物在体内代谢过程,减少药理性配伍禁忌的发生
药物在体内的消除,一种是不经任何代谢,直接以原型随尿或粪便排出体外;另一种代谢主要经肝、肾代谢后,以原型或代谢物形式排出体外。对于经过肝酶CYP代谢的药物,药物又分为药酶诱导剂(苯巴比妥、卡马西平、利福平等)和药酶抑制剂(氟康唑、红霉素类等),药酶诱导剂可以增强药物在体内的代谢,使血药浓度降低、疗效减弱;药酶抑制剂通过抑制肝药酶的作用,减少药物在体内代谢,使药物在体内血药浓度升高,增加不良反应[5]。如药酶抑制剂氟康唑+奥美拉唑联用,可使奥美拉唑的药-时曲线下面积(AUC)↑、t1/2↑、Cmax↑,氟康唑抑制了奥美拉唑代谢而显著升高其血药浓度,该相互作用具有明显的临床意义,提示临床应该避免联用[6]。因此,对于药理性配伍禁忌,应根据药物对肝药酶的调节作用,减少或增大临床给药量来达到治疗效果,实现合理用药。
3.5 中药注射液宜单独输注,减少中西药间的配伍禁忌
中药注射液由于受提取工艺的影响,含有未能去除的微量蛋白、鞣质等杂质,这些物质遇电解质会引起变性反应及与其他药物结合容易诱发输液反应[7]。为此2009年卫生部专门颁布了《中药注射液临床使用基本原则》,明确指出中药注射液应单独输注,严禁与其他药物配伍。
[1]卫生部.医院处方点评管理规范(试行)[S].卫医管发[2010]28号.
[2]张明生,王大平.我院2004年—2005年药品不良反应报告分析[J].中国医院用药评价与分析,2006,6(5):307.
[3]王元培.痰热清注射液的配伍禁忌[J].中国药物与临床,2010,10(10):1149.
[4]陈江飞,苗彩云,胡毅坚.盐酸胺碘酮注射液与三种临床常用输液配伍稳定性[J].中国临床药学杂志,2009,18(3):166.
[5]汪 欢,马 晨,周 佳.药物的肾代谢[J].中国执业药师,2006,3(7):23.
[6]Lu C,Berg C,Prakash SR,etal.Prediction of pharmacokinetic drug-drug interactions using human hepatocyte suspension in plasma and cytochrome P450 phenotypic data.Ⅲ.In vitro-in vivo correlation with fluconazole[J].Drug Metab Dispos,2008,36(7):1261.
[7]何 洁,郭 峰.住院病历用药合理性分析[J].中国医院用药评价与分析,2011,11(1):82.

