己酮可可碱对创伤失血性休克大鼠器官血流量及存活率的影响
邓志龙,张晓星,李邦春
(重庆市急救医疗中心骨科 400014)
创伤后早期死亡主要是由于出血引起的低容量性休克,后期死亡则与出血导致过度的全身炎症反应综合征、感染、器官功能不全和衰竭等因素相关[1-4]。现行创伤失血性休克的标准治疗之一是静脉输注大量的晶体液,如复方乳酸钠(ringer lactate solution,LR),以恢复有效的血流量及血流动力学。但研究表明,LR复苏可引起白细胞激活及器官功能损伤,故复苏损伤的概念正日益受到关注,替换晶体或添加药物减轻复苏损伤的对策也开始得到重视[5-7]。己酮可可碱(pentoxifylline,PTX)为磷酸二酯酶抑制剂,本身不具备液体扩张的功能,但PTX具有减轻休克复苏后中性粒细胞的激活、血管内皮细胞功能的紊乱、肝及肺损伤的作用,而被作为失血性休克复苏的佐剂得到广泛应用[8-10]。PTX对失血性休克LR复苏后器官血流量的影响少见报道,本文在LR复苏的基础上探讨PTX对创伤失血性休克大鼠肝、脾、肾器官血流量和存活率的影响。
1 材料与方法
1.1 材料
1.1.1 动物分组 选择健康雄性Wistar大鼠30只,体质量(232±17)g(第三军医大学实验动物中心提供);随机分为正常组、对照组和治疗组,每组10只。
1.1.2 药品和仪器 LR(重庆制药三厂);PTX(美国Sigma公司)。0.9 mm外径血管插管及3.5 mm外径气管插管、U型血压计、微量泵、末梢组织血流仪(PHG-300,日本)。
1.2 方法
1.2.1 模型制作 按5 mg/kg腹腔内注入20%乌拉坦麻醉大鼠,麻醉后动物仰卧固定于手术台上。3组动物均做上腹正中5 cm长的剖腹探查切口,切开壁腹膜后即缝合;咬骨钳致左股骨闭合骨折;右股动脉插管后接医用三通,用于测定平均动脉压(mean arterial pressure,MAP)和放血;右侧颈外静脉插管至近右心房且外接医用三通,用于测定中心静脉压(CVP)、补液和给药;气管切开并插入气管插管,维持呼吸通畅;缝合插管处组织。正常组动物至此即进入观察。对照组和治疗组大鼠经右股动脉10 min内放血至MAP为(40±2.0)mm Hg,此后间断放血或回输血以维持此血压水平1.5 h,以4倍失血量的LR复苏休克大鼠,复苏量于1 h内经右颈外静脉由微量泵均匀泵入;治疗组大鼠于复苏45 min后经右颈外静脉插管按30 mg/kg加用PTX治疗,并以此时作为时相起点,治疗剂量PTX由生理盐水配成4 mL,其半量于5 min内均匀泵入,余量即2 mL于90 min由微量泵均匀泵入;对照组相应时间给予等量生理盐水。
1.2.2 肝、脾及肾的血流量检测 4.5 h及6.5 h前30 min拆开3组大鼠的剖腹探查切口缝线,显露左侧肝脏、脾脏及肾脏,参考电极置于腹部切口右侧皮下,记录电极经肝左叶下缘上方0.5 cm、左肾下极上方1 cm及脾上极下方0.5 cm斜行45°插入,插入的方向、部位及深度各动物力求相同。电极固定10 min后,经气管插管进行人工呼吸,频率为40次/分,稳定后吸入20%氢气,PHG-300记录氢气清除曲线。将记录的氢气清除曲线经半对数转换,求出半衰期(T1/2),根据该仪器提供的血流量计算法,计算肝、脾及肾的血流量:器官血流量=0.693÷T1/2×100%(mL·100 g-1·min-1)。
1.3 统计学处理 应用SPSS15.0软件进行统计学数据分析,计量资料以±s表示,组间比较采用t检验和χ2检验,以P<0.05为差异有统计学意义。
2 结 果
3组大鼠4.5 h肝、脾及肾脏的器官血流量及8、16 h时的存活数见表1~2。
表1 3组大鼠4.5、6.5 h肝、脾及肾脏的器官血流量比较(±s)
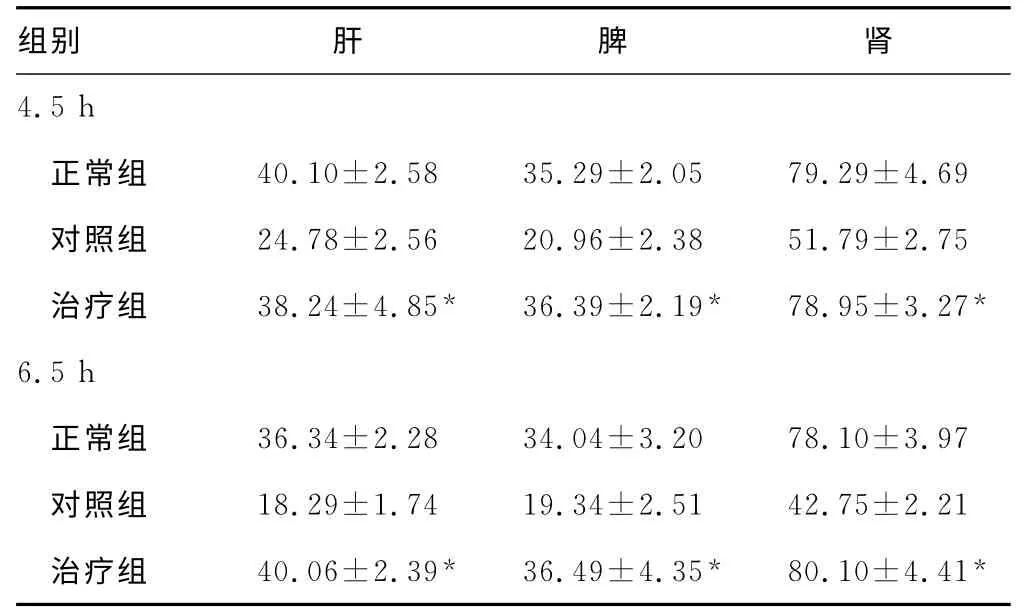
表1 3组大鼠4.5、6.5 h肝、脾及肾脏的器官血流量比较(±s)
*:P<0.05,与对照组比较。
?

表2 3组大鼠8、16 h的存活数比较[n(%)]
3 讨 论
创伤失血性休克的动物模型仍然是一个探索中的课题,没有一个公认的实验动物模型标准[11-12]。但一般认为,较理想的创伤失血性休克模型应包括以下几个方面:创伤和失血是主要的致伤因素;创伤和失血易于控制、定量和复制;能反应失血性休克的过程和特征;可导致器官功能不全并有一定的死亡率。本研究采用大鼠左股骨骨折及经右股动脉放血至MAP为(40±2.0)mm Hg并维持90 min的创伤失血性休克模型,该模型易于控制和复制。休克后大鼠表现为四肢温度明显降低,口唇发绀,呼吸增快及无尿;监测显示MAP下降、心率变慢、心排血量减少。实验动物呈现典型的失血性休克临床过程。符合上述建模标准。
使用LR复苏是失血性休克的标准治疗方法之一,文献报道应用LR复苏的量差别很大,经预实验后选择4倍失血量的LR进行复苏。LR复苏后机体表现为微循环障碍、缺血-再灌注损伤、免疫功能下降、炎症反应综合征等[7-10]。因而,寻求改善复苏效果的方案有一定的价值。PTX对多种慢性疾病尤其是外周动脉阻塞性疾病的治疗取得了较好的疗效[13],主要是因为PTX可增强红细胞的变形能力、减少白细胞的血管壁黏着、降低血小板的聚集和增加纤维蛋白溶解。Jessica等[14]在休克复苏中应用PTX治疗,取得了较好的效果。经预实验后选用30 mg/kg的PTX治疗,半量于5 min内给入,余半量于3个半衰期即90 min给入。
本研究结果表明,PTX治疗后4.5、6.5 h肝、脾及肾血流量已恢复到正常组值水平,并明显高于对照组。表明PTX可恢复创伤失血性休克大鼠LR复苏后器官的血流量。PTX增加器官血流量可能与其改善血流动力学和微循环等有关联。PTX对创伤失血性休克大鼠LR复苏后血流动力学的同期研究表明:(1)PTX明显提高心脏左室收缩压、左室内压最大上升速度、左室内压最大下降速度,提示心脏收缩功能得到改善,有助于增加心脏的每搏输出量;PTX可增快心率,加之每搏输出量的增加,共同致心排血量的增加,从而增加组织器官的血液灌注。(2)PTX可提高LR复苏大鼠的MAP,提高了组织器官的动脉灌注压,增加了组织器官的血流量。(3)PTX还可降低实验大鼠的CVP及血液的全血和血浆的黏度,即降低心脏的前负荷和增加血液的流动性,进而增加组织的灌注和回流。此外,还与PTX改善微循环、减轻肺损伤及降低全身炎症反应综合征级联 等有 关[15-18]。
本研究表明,使用PTX治疗创伤失血性休克大鼠,提高了大鼠8 h及16 h的存活数,这与PTX治疗后组织器官的血流量增加、器官功能改善等有关。尽管治疗组大鼠的存活数与对照组比较差异无统计学意义,但是治疗组的大鼠存活数较对照组提高将近1倍。本研究认为,这可能与样本量偏小及创伤失血性休克程度较重有关,对此有待进一步的探讨。
[1]Alam HB,Rhee P.New developments in fluid resuscitation[J].Surg Clin North Am,2007,87(1):55-72.
[2]Lee WL,Downey GP.Neutrophil activation and acute lung injury[J].Curr Opin Crit Care,2001,7(1):1-7.
[3]Fan J.TLR cross-talk mechanism of hemorrhagic shockprimed pulmonary neutrophil infiltration[J].Open Crit Care Med J,2010(2):1-8.
[4]Liu Y,Yuan Y,Li Y,et al.Interacting neuroendocrine and innate and acquired immune pathways regulate neutrophil mobilization from bone marrow following hemorrhagic shock[J].J Immunol,2009,182(1):572-580.
[5]Alam HB,Sun L,Ruff P,et al.E-and P-selectin expression depends on the resuscitation fluid used in hemorrhaged rats[J].J Surg Res,2000,94(2):145-152.
[6]Alam HB,Santon K,Koustova E,et al.Effects of different resuscitation strategies on neutrophil activation in a swine model of hemorrhagic shock[J].Resuscitation,2004,60(1):91-99.
[7]Savage SA,Fitzpatrick CM,Kashyap VS,et al.Endothelial dysfunction after lactated Ringer′s solution resuscitation for hemorrhagic shock[J].J Trauma,2005,59(2):284-290.
[8]杨木强,耿智隆,陆化梅,等.RL联合PTX对重度失血性休克大鼠早缺血再灌注损伤的影响[J].山东医药,2011,51(3):18-20.
[9]Deree J,de Campos T,Shenvi E,et al.Hypertonic saline and pentoxifylline attenuates gut injury after hemorrhagic shock:the kinder,gentler resuscitation[J].J Trauma,2007,62(4):818-828.
[10]Deree J,Martins J,de Campos T,et al.Pentoxifylline attenuates lung injury and modulates transcription factor activity in hemorrhagic shock[J].J Surg Res,2007,143(1):99-108.
[11]Lomas-Niera JL,Perl M,Chunq CS,et al.Sock and hemorrhagic:an overview of animal models[J].Shock,2005,24 Suppl 1:33-39.
[12]Moochhala S,Wu J,Lu J.Hemorrhagic shock:an overview of animal models[J].Front Bio Sci,2009,14(1):4631-4639.
[13]Schwartz RW,Logan NM,Johnson PJ,et al.Pentoxify lline increases extremity blood flow in diabetic atherosclerotic patients[J].Arch Surg,1989,124(4):434-437.
[14]Jessica D,William H,Loomis BS,et al.Hepatic transcription factor activation and proinflammatory mediator production is attenuated by hypertonic saline and pentoxifylline resuscitation after hemorrhagic shock[J].J Trauma,2008,64(5):1230-1239.
[15]吕镗烽,宋勇,施毅,等.己酮可可碱预处理对单纯失血休克致小鼠急性肺损伤的影响及其机制[J].中国呼吸与危重监护杂志,2010,6(9):619-623.
[16]Coimbra R,Razuk-Filho A,Yada-Lanqui MM,et al.Intraarterial pulmonary pentoxifylline improves cardiac performance and oxygen utilization after hemorrhagic shock:a novel resuscitation strategy[J].Anesth Analg,2004,98(5):1439-1446.
[17]Huang HL,Chiang MF,Lin CW,et al.Lipopolysaccharide directly stimulate aldosterone production via toll-like receptor 2 and toll-like receptor 4 related PI(3)K/Akt pathway in rat adrenal zona glomerulosa cells[J].J Cell Biochem,2010,111(4):872-880.
[18]Yada-Langui MM,Anjos-Valotta EA,Sannomiya P,et al.Resuscitation affects microcirculatory polymorphonuclear leukocyte behavior after hemorrhagic shock:role of hypertonic saline and pentoxifylline[J].Exp Biol Med(Maywood),2004,229(7):684-693.
——过敏性休克和肺水肿的抢救流程

