不同途径给予重组人肠三叶因子对烧伤后小鼠肠黏膜屏障功能的影响*
王 焕,吴修文,吴 炜,张 勇,万千雪,金 星,徐淑秀△,彭 曦▲
(1.蚌埠医学院护理系,安徽蚌埠233030;2.第三军医大学西南医院全军烧伤研究所/创伤、烧伤与复合伤国家重点实验室,重庆400038)
烧伤应激、缺血、缺氧和过度炎症反应可导致肠道组织结构受损,肠黏膜屏障破坏,肠腔中的细菌、毒素可穿越肠黏膜,是形成烧伤后“肠源性感染”和“肠源性高代谢”的病理生理基础[1]。因此,如何减轻严重创伤后肠黏膜损伤,加速肠黏膜修复是目前烧伤救治中的重要环节。尽管已有采用生长激素、胃肠肽及生长因子治疗烧伤后胃肠损害的报道,但这些药物特异性不强,稳定性不高,胃肠道给药疗效不佳[2],临床使用受限。肠三叶因子(intestinal trefoil factor,ITF)是由肠道杯状细胞特异分泌的小分子多肽,因其具有特殊的“三叶草”型空间结构,非常稳定,具有耐酸碱和蛋白酶消化的特性[3]。在肠易激综合征、溃疡性结肠炎、短肠综合征等消化系统疾病的治疗中ITF的疗效已得到肯定[4]。但ITF是否能减轻烧伤后肠道损伤还鲜见报道,对ITF最佳给药途径也还不甚清楚。本研究拟采用烧伤小鼠模型,观察给予重组人ITF(rhITF)对烧伤后肠道损伤的保护作用,并比较口服灌胃和皮下注射两种给药途径在疗效上的差异,为今后rhITF用于烧伤后肠黏膜的修复奠定基础。
1 材料与方法
1.1 动物模型
1.1.1 烧伤模型的制作及分组 健康成年BALB/c小鼠104只,体质量(23±3.1)g,雌雄不限(第三军医大学附属大坪医院实验动物中心提供)。随机分成4组,正常对照(control,C)组(n=8)、烧伤对照(burned,B)组(n=32)、口服灌胃rhITF(intragastric administration,IG)组(n=32)和皮下注射rhITF(subcutaneous injection,SC)组(n=32)。实验分烧伤前及烧伤后1、3、5、7 d 4个时相点。C组8只小鼠,其他各组每个时相点各8只小鼠。C组小鼠不予烧伤,其他3组小鼠烧伤前禁食12 h,1%戊巴比妥钠(40 mg/kg)腹腔麻醉,背部电推剃毛,称质量后置剃毛区于80℃,水浴20 s,造成30%体表面Ⅲ度烧伤。伤后按40 mL/kg腹腔注入复方乳酸钠抗休克。创面涂2%碘酊抗感染,每天2次,伤后给予标准动物颗粒饲料喂养,自由饮水。
1.1.2 药物来源及给药方式 rhITF来源于本课题组的前期制备,采用毕赤酵母重组表达发酵,获得的rhITF经验证与理论值完全相符,毒理学实验已证实该重组蛋白毒副作用非常轻微。IG组小鼠在伤后2 h开始rhITF灌胃,剂量为1.0 mg/kg,每次灌胃容量为0.5 mL,每天分2次给药;在SC组小鼠颈部皮下注射等剂量的rhITF,每次注射容量为0.1 mL,每天2次。
1.2 检测指标
1.2.1 肠黏膜通透性测定 采用核素标记蛋白法,经尾静脉注入锝99标记的二乙三胺五乙酸螯合的人血清蛋白(99Tcm-diethylene triamine pentaacetic acid-human serum albumin,DTPA-HAS),剂量为1 480 kBq/kg,30 min后断头处死小鼠,测定肠腔灌洗液的放射性每分钟计数值,以正常小鼠肠黏膜通量为1,用烧伤后各时相的放射性每分钟计数值与之的比值来反映肠黏膜通透性的改变。由于99Tcm半衰期仅6 h,实验中要设衰变对照,校正所测放射性每分钟计数值。
1.2.2 肠上皮细胞增殖指数测定 采用流式细胞检测技术,分离肠上皮细胞,调节细胞数为1×105个,75%乙醇固定,弃固定剂,PBS洗2次,加5 mg/mL的RNA酶0.5 mL,混匀,37℃水浴30 min,加50μg/mL的碘化丙啶染色液0.5 mL,摇匀,避光冷藏30 min,上机检测,每份标本分析1万个细胞。据G1、S、G2及M各期细胞所占百分比,计算增殖指数(S+G2+M)。
1.2.3 血浆二胺氧化酶(diamine oxidase,DAO)活性测定 采用分光光度法,具体操作如下:每管中加入0.1 mol/L PBS 1.5 mL(p H 7.2),50μL辣根过氧化物酶(2μg),50μL邻联茴香胺(250μg),250μL血浆,最后加50μL尸胺(87.5μg),充分混匀后置37℃水浴30 min。测定波长为436 nm。以上试剂除辣根过氧化物酶由深圳晶美公司提供外,其余均购自Sigma公司。
1.2.4 病理形态学检查 取所需时相点动物部分回肠(距回盲部10 cm),置10%甲醛液中固定。常规石蜡包埋切片HE染色。用Olympus显微镜观察病理切片。
1.2.4.1 黏膜损害指数评价标准 采用Ogura记分法,0分:肠黏膜绒毛正常;1分:绒毛顶端上皮下出现囊状间隙,并伴有毛细血管充血;2分:上皮下间隙扩大,中度固有层水肿,中央乳糜管扩张;3分:固有层明显水肿,肠黏膜上皮层细胞变性、坏死,少数绒毛顶端脱落;4分:上皮细胞层变性、坏死、脱落,部分绒毛脱落,固有层裸露,毛细血管扩张、充血;5分:绒毛脱落,固有层崩解,出血或溃疡形成。光镜下每只小鼠肠道标本随机计数10个视野,取平均值。
1.2.4.2 肠黏膜厚度测定 采用目镜测微器测定法,在40倍光镜下每张切片随机测定6个视野黏膜厚度,取平均值作为小鼠肠黏膜厚度。
1.3 统计学处理 应用SPSS13.0统计软件进行数据分析,计量资料以±s表示,组间比较采用多因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
4组小鼠肠黏膜损伤指数、肠黏膜通透性、血浆DAO活性、肠黏膜细胞增殖指数和黏膜厚度见表1~5。
表1 C组及烧伤后小鼠不同时相点肠黏膜损伤指数比较(±s)
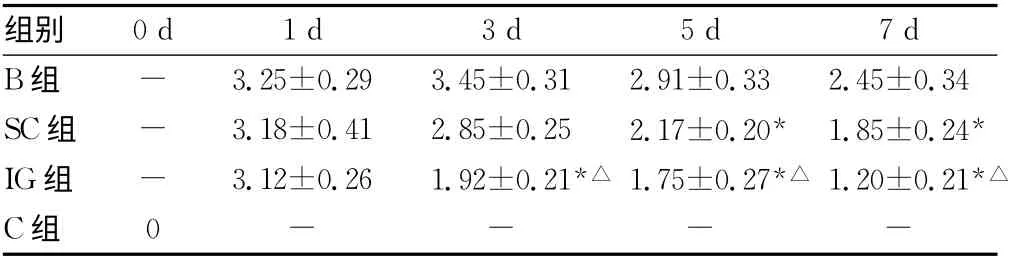
表1 C组及烧伤后小鼠不同时相点肠黏膜损伤指数比较(±s)
*:P<0.05,与B组比较;△:P<0.05,与SC组同一时相点比较;-:表示无数据。
?
表2 C组及烧伤后小鼠不同时相点肠黏膜通透性变化比较(±s)
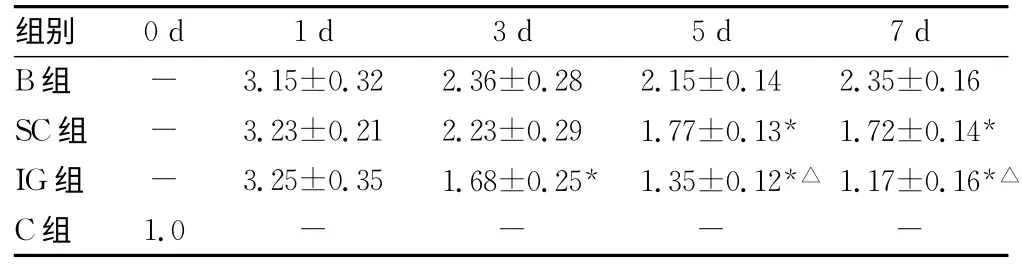
表2 C组及烧伤后小鼠不同时相点肠黏膜通透性变化比较(±s)
*:P<0.05,与B组同一时相点比较;△:P<0.05,与SC组同一时相点比较;-:表示无数据。
组别0d 1 d 3 d 5 d 7 d B组-3.15±0.32 2.36±0.28 2.15±0.14 2.35±0.16 SC组-3.23±0.21 2.23±0.29 1.77±0.13*1.72±0.14*IG组-3.25±0.35 1.68±0.25*1.35±0.12*△1.17±0.16*C组1.0----△
表3 C组及烧伤后小鼠不同时相点血浆DAO活性变化比较(±s,U/mL)

表3 C组及烧伤后小鼠不同时相点血浆DAO活性变化比较(±s,U/mL)
*:P<0.05,与B组同一时相点比较;△:P<0.05,与SC组同一时相点比较;-:表示无数据。
组别0d 1 d 3 d 5 d 7 d B组-1.88±0.32 1.73±0.19 1.43±0.17 0.98±0.12 SC组-1.75±0.28 1.59±0.22 1.12±0.16*0.62±0.10*IG组-1.92±0.20 1.45±0.16*0.95±0.12*△0.58±0.08*△C组0.42±0.02----
表4 C组及烧伤后小鼠不同时相点肠黏膜细胞增殖指数的变化(±s,%)

表4 C组及烧伤后小鼠不同时相点肠黏膜细胞增殖指数的变化(±s,%)
-:表示无数据。
组别0d 1 d 3 d 5 d 7 d B组-41.23±8.96 37.25±8.50 46.48±9.25 49.45±7.80 SC组-42.58±11.24 38.24±9.25 47.59±7.50 52.48±9.55 IG组-44.20±12.25 42.23±8.90 52.45±8.82 55.25±9.40 C组61.34±6.82----
表5 C组及小鼠烧伤后不同时相点肠黏膜厚度比较(±s,μm)

表5 C组及小鼠烧伤后不同时相点肠黏膜厚度比较(±s,μm)
*:P<0.05,与B组同一时相点比较;△:P<0.05,与SC组同一时相点比较;-:表示无数据。
组别0d 1 d 3 d 5 d 7 d B组-323.56±22.40 310.50±20.40 239.44±22.15 195.26±18.80 SC组-346.25±25.46 323.45±25.68 276.78±20.10*252.45±21.15*IG组-339.50±28.18 345.66±12.80 308.40±21.50*△332.10±22.50*△C组366.67±31.02----
3 讨 论
肠道是烧伤后缺血、缺氧性损害的主要靶器官之一,被誉为外科应激的中心器官。烧伤后受损肠道的修复机制比较复杂,涉及肠上皮细胞增殖和移行等多个环节。生长因子在肠道损伤修复过程中发挥了重要作用,在众多生长因子中,ITF似乎更具有特异性。首先ITF是肠道杯状细胞特异分泌的小分子多肽,其他部位少见;其次,ITF具有特殊的“三叶草型”空间结构,使之具备了蛋白酶消化抗性和酸碱稳定性,使其能在胃肠道复杂的环境中不被破坏,保持生物活性[3];此外,ITF空间结构中的一些特殊位点还能同黏蛋白中的寡聚糖或多糖的侧链相连,维护肠黏膜屏障[5]。因此,ITF被誉为胃肠道的“超级保护因子”。
实验结果显示,烧伤可导致肠道组织结构受损,通透性增加,修复能力降低,黏膜萎缩。rhITF能显著降低烧伤后肠道受损程度,SC组和IG组小鼠肠道损伤指数和血浆DAO活性明显低于B组。与之对应,肠黏膜通透性明显下降,肠道萎缩程度也有所减轻,说明rhITF具有较强的生物活性,能有效降低烧伤后肠道受损程度,减轻黏膜萎缩,降低肠黏膜通透性。实验结果还显示,ITF促进肠道修复的机制与细胞增殖无关,无论是灌胃还是皮下注射rhITF对烧伤后肠上皮细胞增殖受抑均无明显疗效,说明ITF通过其他途径促进受损肠道修复。体外实验证实,ITF对细胞增殖活性影响不大,但能明显促进细胞移行[6],本实验再次证实ITF对细胞增殖无效。增殖和移行是肠黏膜修复的主要方式,在受损肠道的修复中起重要作用,其中,细胞移行不涉及细胞DNA复制和蛋白合成,是肠黏膜的快速修复机制[7],越来越受到重视。ITF主要通过促进细胞移行加快损伤黏膜的修复,而对细胞增殖能力影响不明显,降低了使用生长因子不当造成的细胞过度增生,甚至发生癌变的风险,较之其他生长因子安全性更高,具有成为胃肠黏膜特异保护药物的潜质,值得重点研究和开发。
实验结果还显示,无论哪种途径给予rhITF对减轻烧伤后肠道损伤,维护肠黏膜屏障都有积极意义。相对而言,通过灌胃方式给药的疗效更佳,这可能与胃肠道直接给药有利于维护肠黏膜屏障有关。ITF的空间结构中有与黏蛋白中糖链结合的特异位点,能增加黏蛋白的稳定性,能稳定肠黏液层,减轻烧伤后肠道损伤,促进黏膜修复[3]。此外,肠上皮细胞膜上具有ITF特异受体[8],通过胃肠道给药可能有利于ITF与其受体结合,启动肠道细胞保护机制,促进受损肠道修复,但其内在的信号机制目前尚不甚清楚,有待进一步研究。
总之,给予外源性ITF能有效减轻烧伤后肠道损伤,维护肠黏膜屏障,在没有绝对口服用药禁忌的情况下,应优先考虑通过胃肠道给药。
[1]Mashkoor AC,Shadab NR,Michael JK,et al.Impaired intestinal immunity and barrier function:a cause for enhanced bacterial translocation in alcohol intoxication and burn injury[J].Alcohol,2004,33(3):199-208.
[2]Takeuchi LK,Tarnawshi A.Gastric mucosal defense and cytoprotection:bench to bedside[J].Gastroenterology,2008,135(1):41-60.
[3]Kjellev S.The trefoil factor family-small peptides with multiple functionalities[J].Cell and Mol Life Sci,2009,66(7):1350-1369.
[4]Teng X,Xu LF,Zhou P,et al.Effects of trefoil peptide 3 on expression of TNF-α,TLR4,and NF-κB in trinitrobenzene sulphonic acid induced colitis mice[J].Inflammation,2009,32(2):120-129.
[5]Hoffmann W.Trefoil factor family(TFF)peptides and chemokine receptors:a promising relationship[J].J Med Chem,2009,52(21):6505-6510.
[6]王焕,吴修文,万千雪,等.肠三叶因子和黏蛋白对烧伤血清所致肠上皮细胞增殖移行能力变化的影响[J].中华烧伤杂志,2011,27(5):347-352.
[7]Neal MD,Richardson WM,Sodhi CP,et al.Intestinal stem cells and their roles during mucosal injury and repair[J].J Surg Res,2010,33(1):1-8.
[8]Ottoa WR,ThimL.Trefoil factor family-interacting proteins[J].Cell Mol Life Sci,2005,62(12):2939-2946.

