猪原环病毒2型衣壳蛋白含量与抗原滴度的相关性研究
朱莹莹,荣 俊 (长江大学生命科学学院,湖北 荆州 434025)
匡红艳 (长江大学临床医学院,湖北 荆州 434000)
猪原环病毒2型衣壳蛋白含量与抗原滴度的相关性研究
朱莹莹,荣 俊 (长江大学生命科学学院,湖北 荆州 434025)
匡红艳 (长江大学临床医学院,湖北 荆州 434000)
将猪圆环病毒2型衣壳蛋白原核表达工程菌用PBS溶解破碎后,经2次50%饱和度硫酸铵沉淀,用Brodford法分别测定不同稀释度的原核表达菌破菌液中的蛋白含量,同时进行琼脂双向免疫扩散试验(AGP),48h观察免疫沉淀线,以出现免疫沉淀线的表达产物最高稀释倍数为该抗原的滴度,并由此探讨猪圆环病毒2型衣壳蛋白(PCV2-CAP)原核表达产物中总蛋白含量与抗原滴度之间的相关关系。结果表明,AGP最小检出值为0.255mg(蛋白)/ml,表达产物总蛋白含量在0.255~0.857mg/ml与以0.5为底的AGP滴度的对数成正相关关系(R2=0.9938)。当总蛋白含量超过0.857mg/ml时抗原滴度变化不再相关联。可见, AGP能检出表达产物中总蛋白的最低值为0.255mg/ml,最高值为0.857 mg/ml,在此区间内蛋白含量与AGP滴度成正相关关系,可以通过测定蛋白含量估算抗原滴度。
猪圆环病毒2型;蛋白含量;滴度;琼脂双向免疫扩散试验
猪圆环病毒2型(Porcine circovirus 2,PCV2)由Clark等于1997年从加拿大西部患有断奶仔猪多系统衰竭综合征的猪群中分离得到。该病毒是一种致病性的DNA单链病毒,与猪皮炎、肾病综合征、先天性震颤、后期流产和渗出性皮炎等疾病密切相关[1],已对全球养猪业造成严重的经济损失,因此对该病毒疫苗的研究具有极其重要的现实意义。疫苗制备过程中抗原含量的确定是保证免疫效果、防止疫苗本身副反应的关键环节,而采用免疫学方法进行抗原滴度的检测需要较长的时间或专门的实验设备和试剂,不便于及时掌握抗原的含量。为此,本研究采用Brodford法测量表达产物中蛋白含量,探讨了蛋白含量与抗原滴度的相关性,以期采用蛋白含量估算抗原滴度,为疫苗配制过程中抗原量的调配提供依据。
1 材料与方法
1.1 材料
抗血清:由试验猪免疫获得;猪圆环病毒衣壳表达蛋白:经实验诱导获得;考马斯亮蓝G250;标准蛋白BSA 1mg/ml。
1.2 方法
1.2.1 标准曲线的制作
取18支试管分成6组编号,每组3个重复。将各组试管按表1依次加入不同浓度标准蛋白和G250混匀,放置5min后,在595nm波长下测定各管光密度。每组以3个重复的测定值的平均值作为该组蛋白的光密度。以蛋白浓度为横坐标,以光密度为纵坐标绘制标准曲线[2-5],得其标准曲线方程为y=1.1056x+0.5397(R2= 0.9902,图1)。

表1 各试剂加入量与蛋白浓度

图1 蛋白浓度与光密度的标准曲线
1.2.2硫酸铵粗纯化蛋白液的配制
将收集到的原核表达猪圆环病毒衣壳蛋白(目的蛋白约含30%)用PBS按重量体积比1∶30溶解,加入固体硫酸铵,饱和度为50%,4℃放置1h,10000r/min离心30min,弃上清,蛋白沉淀用原体积PBS溶解,再次用50%硫酸铵沉淀,PBS复溶蛋白沉淀(纯度约50%)。
1.2.3不同稀释度蛋白液的光密度测定与蛋白浓度计算
采用Brodford法测量蛋白含量。先将硫酸铵粗纯化蛋白液分别用PBS按照8∶2,6∶4,4∶6,2∶8,1∶9,1∶19的比例稀释,分别记为:原稀释度蛋白液、80%稀释度蛋白液、60%稀释度蛋白液、40%稀释度蛋白液、20%稀释度蛋白液、10%稀释度蛋白液、5%稀释度蛋白液,随后分别测量其光密度值,并代入标准曲线方程,计算出各稀释度蛋白液的蛋白浓度。
1.2.4不同稀释度蛋白液的抗原滴度检测
将上述各稀释度蛋白液采用PBS等倍稀释,分别从原倍稀释至1/16后进行琼脂扩散试验[6-8]。其中周围孔依次加满等倍稀释蛋白液和一个阴性对照,中间孔加满抗血清,37℃温育24~48h,观察结果。
1.3 蛋白浓度与抗原滴度相关性分析
将上述不同稀释度蛋白液的蛋白浓度与所测定的对应的抗原滴度结合,分析其相关性。
2 结果与分析

表2 不同稀释度蛋白液的光密度与蛋白浓度
2.1 不同稀释度蛋白液的蛋白浓度
将稀释的蛋白液分别测定其光密度,求出平均值,依据标准曲线计算出蛋白浓度,结果见表2。
2.2 不同稀释度蛋白液的抗原滴度
琼脂扩散试验结果见表3。由表3可知,原稀释度蛋白和80%稀释度蛋白的滴度相同,为1∶8,但前者沉淀线颜色较深(图2-A、B),反应更充分;10%稀释度蛋白以后无沉淀线形成,蛋白浓度偏低。

表3 不同稀释度蛋白液的抗原滴度

A.原稀释度蛋白液;B.80%稀释度蛋白液;C.60%稀释度蛋白液;D.40%稀释度蛋白液;E.20%稀释度蛋白液
2.3 琼脂扩散滴度与不同稀释度的蛋白浓度相关性
综合上述蛋白浓度与抗原滴度的数据来看,当蛋白浓度在0.255~0.857mg/ml范围内,蛋白浓度每减少0.2mg/ml,其滴度降低1/2,高于0.857mg/ml抗原滴度上升不再明显,低于0.255mg/ml则检测不到抗原(表4)。
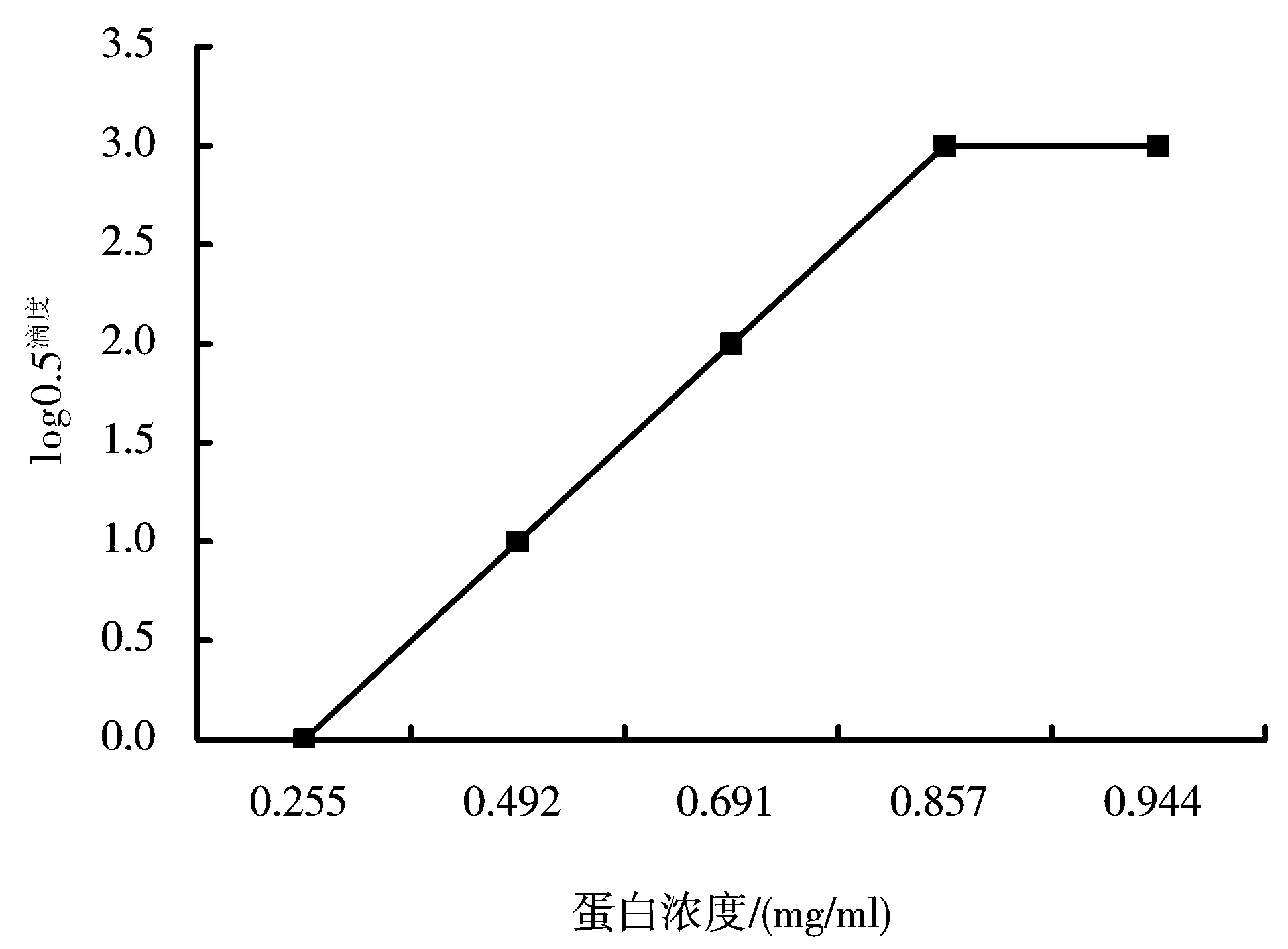
图3 抗原滴度与蛋白浓度关系
表4不同稀释度蛋白液的蛋白浓度与抗原滴度
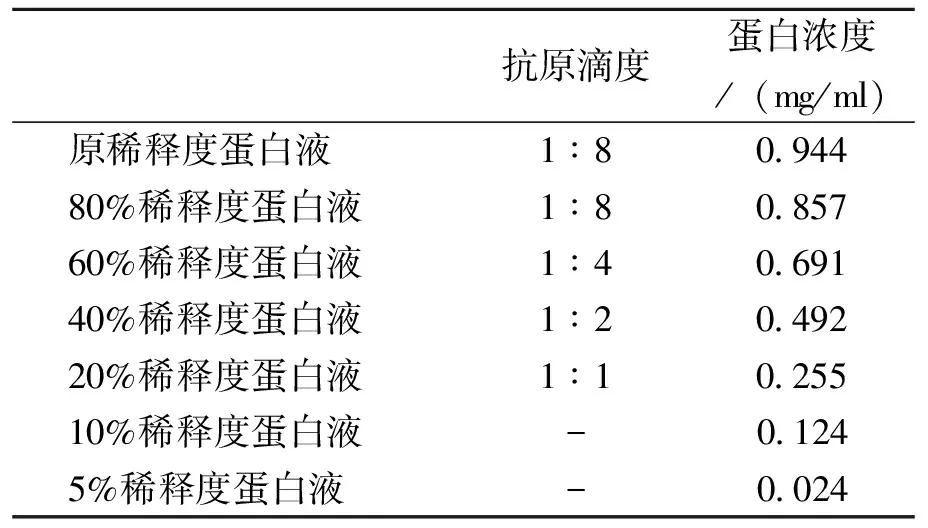
抗原滴度蛋白浓度/(mg/ml)原稀释度蛋白液1∶80 94480%稀释度蛋白液1∶80 85760%稀释度蛋白液1∶40 69140%稀释度蛋白液1∶20 49220%稀释度蛋白液1∶10 25510%稀释度蛋白液-0 1245%稀释度蛋白液-0 024
以蛋白浓度为横坐标,以log0.5滴度为纵坐标作出折线图(图3)。由图3可以看出,蛋白浓度在0.255~0.857mg/ml范围时两者成正相关,相关方程为y=4.9564x-1.3437(R2=0.9938);含量超过0.857mg/ml后滴度达到上限。
3 讨论与小结
为探讨采用蛋白浓度估算抗原滴度的可行性,本研究采用Brodford法,通过测定不同稀释度蛋白液的光密度求得其蛋白浓度,并通过琼脂扩散试验测定了不同稀释度蛋白液的抗原滴度,分析了蛋白浓度与抗原滴度的相关性。结果表明,当蛋白浓度在0.255~0.857mg/ml范围时,两者成正相关,相关方程为y=4.9564x-1.3437(R2=0.9938),相关性较好,可以以蛋白浓度估算抗原滴度。而当浓度达到0.857mg/ml时抗原滴度变化不再明显,可能原因是抗原浓度过高,需要进一步稀释。
琼脂扩散试验虽是一种操作简单的抗体抗原检测方法,当抗原和抗体呈特异性的结合且比例适当时,将会形成抗原抗体复合物的沉淀,在琼脂中呈现一条不透明的白色沉淀线,但结果的判定也需要至24h才能得出,而Brodford法测定蛋白含量数分钟就能测出,因此建立这种线性关系,即在同样的血清条件下通过试验得出抗原滴度与抗原蛋白的含量能够快速预测抗原滴度,为疫苗及时准确配制提供了依据。
[1]Mark A O’Dea,Andrew P Hughes,Linda J Davies,et al.Thermal stability of porcine circovirus type2 in cell culture[J].Journal of Virological Methods,2008,147:61-66.
[2]张龙翔,张庭芳,李令媛,等.生化实验方法和技术[M].北京:高等教育出版社,1981:164-169.
[3]李 娟,张耀庭,曾 伟,等.应用考马斯亮蓝法测定总蛋白含量[J].中国生物制品学杂志,2000,13(2):118-120.
[4]王孝平,邢树礼.考马斯亮蓝法测定蛋白含量的研究[J].天津化工,2009,23(3):40-41.
[5]陈晓梅,刘雅文,程 熠,等.考马斯亮蓝法蛋白定量标准曲线稳定性观察[J].中国公共卫生,2006,22(3):380-381.
[6]陈茂盛,寇改霞.应用琼脂扩散试验检测牛血清BvD/MD抗体[J].中国兽医杂志,1994,20(1):25.
[7]李维义,李 媛.应用琼脂扩散试验检测新城疫抗原[J].中国畜禽传染病,1998,20(3):165-167.
[8]朱杰青,吉传义,陆承平.脱脂奶溶蛋白琼脂扩散试验检测AhECP[J].微生物学通报,2000,27(4):286-304.
10.3969/j.issn.1673-1409(S).2012.04.010
Q939.91
A
1673-1409(2012)04-S037-04
2012-03-11
朱莹莹(1986-),女,湖北武汉人,硕士生,研究方向为猪圆环病毒疫苗。
荣 俊,E-mailrongjun59626@gmail.com。

