核磷蛋白小分子抑制剂NSC348884对肝癌细胞HepG2的体外抑制作用
张 洁,赵浩亮,贺杰峰,李辉宇
山西医科大学第一医院普通外科,太原030001
原发性肝癌是世界上最高发的癌症之一,早期诊断率低,术后复发率高,一经发现多为晚期[1-2],因此寻求新型有效的抗肝癌药物具有重要意义。NSC348884是Qi等[3]于2008年首次报道的一种核磷蛋白 (nucleophosmin,NPM)小分子抑制剂。它能特异性破坏NPM氨基末端的疏水口袋结构,从而抑制NPM寡聚物的形成,破坏其在癌细胞中的异常功能。该研究表明NSC348884可在多种癌细胞系中抑制细胞的增殖,包括前列腺癌、结肠癌、乳腺癌、肺癌、淋巴癌。因此,NSC348884将可能成为抗癌治疗的新型药物。最新研究表明,NPM在肝细胞癌(hepatocellular carcinoma,HCC)中呈高表达,可能是潜在的HCC标志物[4]。NPM将可能成为肝癌治疗的新靶点,而关于NSC348884对肝癌细胞的作用尚少有报道。本研究旨在观察NSC348884对肝癌细胞HepG2体外生长的抑制效应,并探讨其作用机制。
材料和方法
细胞培养HepG2肝癌细胞株 (购自中国科学院)培养于含10%胎牛血清的RPMI1640培养基(另加入青霉素50 U/ml和链霉素60 μg/ml)中,温度37℃,含5%的CO2,选用对数生长期的细胞进行实验。
噻唑蓝检测细胞增殖HepG2细胞以5×104/ml的浓度接种于96孔板中,每孔200 μl,设3个复孔。培养24 h后更换NSC348884(美国Sigma公司)终浓度为0、0.01、0.1、1、2、5、10、40、50 μmol/L 的10%胎牛血清培养液。培养4 d后,加入噻唑蓝(methyl thiazolyl tetrazolium,MTT),4 h后,弃培养液,加入二甲基亚砜100 μl,培育5 min,用酶标仪于490 nm波长处测定吸光度。实验组按下列公式计算细胞存活率:存活率 (%)=加药细胞平均吸光度值/对照细胞平均吸光度值×100%,绘制细胞增殖曲线图。
免疫印迹法检测寡聚物及单体的表达变化0 μmol/L(空白对照)、2 μmol/L NSC348884 分别处理肝癌细胞HepG2,24 h后胰酶消化,收集细胞。按核蛋白提取试剂盒方法提取核蛋白。Bradford法进行蛋白质定量。取50 μg蛋白质分别做浓度为15%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)及非变性聚丙烯酰胺凝胶电泳 (native polyacrylamide gel electrophoresis,native PAGE),电泳完毕将蛋白转移至聚偏二氟乙烯膜上,小牛血清封闭2 h,兔抗人NPM一抗 (CST公司)1∶1000室温孵育过夜,辣根过氧化物酶标记的二抗 (美国Santa Cruz Biotechnology公司)室温孵育1 h,最后使用二氨基联苯胺试剂显色 (美国DAKO公司)。
流式细胞术检测细胞凋亡率0、1、2 μmol/L的NSC348884处理细胞,培养24 h后收集细胞,冷磷酸盐缓冲液洗涤,重悬于4℃、70%酒精中固定过夜,离心后加入200 μg/ml RNA酶400 μl 37℃处理30 min,再加入 15 μg/ml碘化丙啶 100 μl 4℃避光处理30 min,流式细胞仪 (美国Beckman公司)检测细胞凋亡率。
统计学处理所有实验均重复3次,使用SPSS 13.0统计软件包处理数据,采用两独立样本t检验和单因素方差分析,数据以均数±标准差表示,P<0.05认为差异有统计学意义。
结 果
NSC348884抑制HepG2细胞增殖活性MTT结果显示,NSC348884在0.01 μmol/L低浓度时吸光度与对照组比较差异无统计学意义 (P>0.05);浓度为0.1 μmol/L 和 1 μmol/L 时,细胞存活率分别为(72.333±5.774)%和 (74.667±4.163)%、二者比较差异无统计学意义 (P>0.05);当浓度在1~10 μmol/L之间时,明显抑制了细胞的生长,浓度为2、5、10 μmol/L时存活率分别为(35.333±4.041)%、(17.667±2.082)%、(22.333±2.887)%,与对照组比较差异有统计学意义 (P<0.05);NSC348884浓度为 40、50 μmol/L时,存活率分别为 (26.333±1.528)%、(28.000±1.732)%、二者比较差异无统计学意义 (P>0.05)。NSC348884对肝癌细胞HepG2的半数抑制浓度 (50%inhibiting concentration,IC50)为 1.4 μmol/L。
NSC348884破坏HepG2细胞NPM寡聚物结构0 μmol/L 及2 μmol/L NSC348884 处理 HepG2 细胞24 h后,与0 μmol/L组相比,2 μmol/L组的NPM寡聚物表达量明显降低,而单体的表达量增高 (图1)。图像分析结果显示,2 μmol/L组寡聚物蛋白条带灰度比值 (0.289±0.035)明显低于0 μmol/L组寡聚物蛋白条带灰度比值 (1.443±0.041)(P<0.05);而2 μmol/L组单体蛋白条带灰度比值(1.781±0.101)明显高于0 μmol/L组单体蛋白条带灰度比值 (1.122±0.007)(P<0.05)。

图1 NSC348884特异性破坏NPM寡聚物结构Fig 1 NSC348884 specifically disrupts NPM oligomer
NSC348884诱导HepG2细胞的凋亡0、1、2 μmol/L NSC348884处理HepG2细胞24 h后,凋亡率分别为 (6.950±0.207)%、(13.770±0.335)%、(19.021±0.237)%。处理组与对照组比较,差异有统计学意义 (P <0.05);2 μmol/L与1 μmol/L处理组比较,差异有统计学意义 (P<0.05)(图2)。
讨 论
HCC一经发现多为晚期,对不宜手术者,化疗是主要的治疗方法。化疗药物的作用机制很多,而蛋白-蛋白相互作用位点是强有力的干预靶点,是发展抗癌药物的热点,目前以蛋白-蛋白相互作用位点为靶点的化疗药物的应用已经成为现实[5]。
NPM是主要的核仁磷酸化蛋白,其结构特征包括一个氨基末端保守的寡聚化区[6-7],NPM的寡聚化可能是调节NPM多种功能的必要步骤[8]。研究表明,NPM在多种实体肿瘤中存在高表达,被认为是结肠癌、胃癌、卵巢癌和前列腺癌的肿瘤标志物之一[9]。此外,有研究表明Rev蛋白的一个肽与NPM结合使Ras转化的NIH-3T3细胞产生细胞毒性,从而抑制裸鼠模型中肿瘤的生长[10]。这是关于抑制NPM后产生抗肿瘤作用的首次报道。
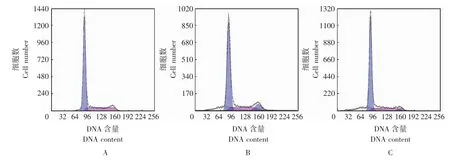
图2 NSC348884诱导肝癌细胞HepG2凋亡Fig 2 NSC348884 induces the apoptosis of hepatocellular carcinoma cell line HepG2
基于上述研究,Qi等[3]通过对NPM分子模型三维结构的研究,确定影响其寡聚物形成的药效基团,然后经计算机筛选以及相互作用而确定了一种NPM的小分子抑制剂——NSC348884。他们的研究表明NSC348884以1.7~4.0 μmol/L的IC50在多种癌细胞系中抑制了细胞的增殖。Yun等[4]的最新研究证实,NPM在HCC中呈高表达,且显著高于非癌肝组织;NPM在HCC中的高表达与增殖细胞核抗原水平以及血清甲胎蛋白、肝硬化等临床预后参数相关;NPM可能是潜在的HCC标志物。因此,NPM可能是一个潜在的原癌基因,将可能成为肝癌治疗的新靶点。
本研究应用MTT比色法测定NSC348884对HepG2细胞存活率的影响,结果显示NSC348884对肝癌细胞HepG2生长有抑制作用,药物浓度在1~10 μmol/L之间时,对细胞的抑制作用最明显,随药物浓度增加,细胞的存活率降低,呈剂量-效应关系。NSC348884的IC50为1.4 μmol/L。随后通过对不同浓度NSC348884处理组进行Native PAGE、SDSPAGE免疫印迹检测,结果表明NSC348884能特异性破坏肝癌细胞HepG2中NPM寡聚物结构,促使其寡聚物转化为单体,这是NSC348884发挥抗肿瘤作用的分子基础。
研究表明,NSC348884通过上调p53(增加15位丝氨酸的磷酸化),以剂量依赖方式诱导多种肿瘤细胞的凋亡[3]。本研究用流式细胞术检测细胞凋亡,结果显示NSC348884以剂量依赖方式诱导了肝癌细胞HepG2凋亡的发生,而有关诱导肝癌细胞凋亡的具体机制尚需进一步研究。
综上所述,本研究显示NSC348884通过促使肝癌细胞HepG2中NPM寡聚物转化为单体,从而抑制HepG2细胞的体外增殖,并且可以诱导肝癌细胞凋亡,而其诱导肝癌细胞凋亡的机制尚需进一步研究。
[1]Takigawa Y,Brown AM.Wnt signaling in liver cancer[J].Curr Drug Targets,2008,9(11):1013-1024.
[2]Lewis RR,Gregory JG.Emerging drugs for hepatocellular carcinoma [J].Expert Opin Emerg Drugs,2006,11(3):469-487.
[3]Qi W,Shakalya K,Stejskal A,et al.NSC348884,a nucleophosmin inhibitor disrupts oligomer formation and induces apoptosis in human cancer cells [J].Oncogene,2008,27(30):4210-4220.
[4]Yun JP,Miao J,Chen GG,et al.Increased expression of nucleophosmin/B23 in hepatocellular carcinoma and correlation with clinicopathological parameters [J].Br J Cancer,2007,96(3):477-484.
[5]Arkin MR,Wells JA.Small-molecule inhibitors of proteinprotein interactions:progressing towards the dream [J].Nat Rev Drug Discov,2004,3(4):301-317.
[6]Wang D,Umekawa H,Olson MO.Expression and subcellular locations of two forms of nucleolar protein B23 in rat tissues and cells[J].Cell Mol Biol Res,1993,39(1):33-42.
[7]Wang W,Budhu A,Forgues M,et al.Temporal and spatial control of nucleophosmin by the Ran-Crm1 complex in centrosome duplication [J].Nat Cell Biol,2005,7(8):823-830.
[8]Lim MJ,Wang XW.Nucleophosmin and human cancer[J].Cancer Detect Prev,2006,30(6):481-490.
[9]Grisendi S,Mecucci C,Falini B,et al.Nucleophosmin and cancer [J].Nat Rev Cancer,2006,6(7):493-505.
[10]Chan HJ,Weng JJ,Yung BY.Nucleophosmin/B23-binding peptide inhibits tumor growth and up-regulates transcriptional activity of p53 [J].Biochem Biophys Res Commun,2005,333(2):396-403.

