羟基脲增强肿瘤坏死因子相关凋亡诱导配体诱导的K562细胞凋亡及其分子机制
武瑶珉,张亚玺,史 娟,刘士廉,刘彦信,郑德先
中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室,北京100005
肿瘤坏死因子相关凋亡诱导配体 (tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)能够选择性地诱导多种肿瘤细胞的凋亡,而对大多数正常细胞无毒害,所以,自从其被发现以来,人们一直在试图将TRAIL用于肿瘤治疗[1-2]。临床试验结果证实,重组可溶性TRAIL(recombinant soluble tumor necrosis factor-related apoptosis-inducing ligand,rsTRAIL)对一些类型的白血病患者治疗效果非常显著。慢性髓细胞性白血病 (chronic myelogenous leukemia,CML)来源的K562细胞能抵抗rsTRAIL引起的凋亡,并且对多种化疗药物的细胞毒作用不敏感[3-4]。K562细胞在CML中发挥了肿瘤干细胞的角色,是癌症的复发和转移的主要原因,成为癌症治疗的靶向目标[5]。本研究探讨人重组可溶性TRAIL与羟基脲(hydroxyurea,HU)对K562细胞的协同性毒性作用,旨在证明其具体的分子机制,为CML的治疗提供理论支持,具有一定的应用前景。
材料和方法
试剂羟基脲购自Sigma公司,rsTRAIL由本实验室纯化制备。抗体分别购自Santa Cruz公司 (FLIP sc-7108,c-IAP1 sc-7943)和 Cell Signaling公司 [Ras抗体 #3965,phospho-SAPK/JNK抗体 #9251,SAPK/JNK抗体 #9252,phospho-p44/42 MAPK(Erk 1/2)抗体 #9101,p44/42 MAPK(Erk 1/2)抗体 #9102,phospho-MEK 1/2抗体 #9121,MEK 1/2抗体 #9122]。
细胞株及培养K562和SVT-35细胞株购自美国模式培养物集存库。两种细胞均在37℃、5%CO2、恒温、饱和湿度的培养箱中培养,两种细胞的生长培养基为含10%胎牛血清的RPMI 1640培养基,48h传代1次,选用对数生长期细胞进行实验。
四唑氮盐法检测细胞生长抑制率
单独用药:取对数生长期的K562、SVT-35细胞接种于96孔平底培养板,每孔100 μl,使细胞悬液的终浓度为2.5×105/ml。分别各自加入终浓度为0.25、0.50、1、2 μg/ml 的 rsTRAIL 和 50、100、200和400 μg/ml的HU,对照组细胞加等量培养基,每个浓度接种3个复孔,培养24 h后加入20 μl四唑氮盐+吩嗪硫酸甲酯,培养2~4 h,酶标仪492 nm测光密度值 (optical density,OD),计算细胞生长抑制率[细胞生长抑制率=(1-OD处理组/OD对照组)×100%]。根据 TRAIL敏感性定义,即:用100 ng/ml的TRAIL处理细胞,多于60%的细胞死亡为敏感;少于25%的细胞死亡为不敏感,二者之间为中度敏感。
联合用药:分别加入终浓度为0.25、0.50、1、2 μg/ml的HU,然后每个HU组分别加入终浓度为250、500、1000、2000和 4000 ng/ml的 rsTRAIL,每个浓度接种3个复孔,孵育24 h后测定细胞生长抑制率,计算方法同上。
判断两种药物是否产生协同作用,标准有以下两种:(1)作图法:将两种药物单独处理的凋亡率(细胞存活抑制率)叠加,与联合应用的凋亡率在柱状图中作比较,若前者明显小于后者,则对两组原始数据进行t检验,P<0.05为差异具有统计学意义; (2)采用国内金 (正均)氏公式,Q=EA+B/(EA+EB-EAEB)。EA为A药 (rsTRAIL)单独处理的细胞生长抑制率,EB为B药 (各种化疗药物)单独处理的细胞生长抑制率,EA+B为两种药物联合处理的细胞生长抑制率。Q值介于0.85~1.15为单纯相加,介于1.15~2.0为联合作用有所增强,大于2.0为明显增强,介于0.85~0.55为二者存在拮抗作用,小于0.55为明显拮抗[6]。
细胞裂解K562细胞经特定的处理后,在4℃、1000×g离心5 min,收集细胞,用冰预冷的PBS洗两次。用添加了蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液重悬细胞,使细胞悬液的终浓度为5.0×104/ml。冰上裂解30 min,4℃、15 000×g离心去除细胞核和细胞碎片,备用。
Western blot检测蛋白质含量或磷酸化水平用BCA法检测细胞裂解液中蛋白质浓度,并且根据测定的数值制备蛋白质凝胶电泳样品,每个样品含60 μg总蛋白,经8%的聚丙烯酰胺凝胶电泳分离蛋白质,用半干电转法将凝胶中的蛋白质转移到PVDF膜上,进行免疫印迹实验。用5%的脱脂奶粉封闭1 h,加入封闭液稀释的一抗,室温孵育1.5 h或4℃过夜,经TBST洗涤3遍后,加入封闭液稀释的相应的二抗,室温孵育1.5 h,经TBST洗涤3遍后,ECL显色液中避光反应1 min,X-光胶片显影。
统计学处理用方差分析比较不同实验组中数据差异的统计学意义,两组间比较采用t检验。P<0.05为差异具有统计学意义。
结 果
K562细胞对rsTRAIL的细胞毒作用选择用rsTRAIL同时处理K562细胞和对rsTRAIL凋亡作用相对敏感的细胞株SVT-35。细胞存活率测定结果显示,当 rsTRAIL处理浓度为 0.5、1和 2 μg/ml时,SVT-35细胞存活率分别为55%、32%和24%,K562细胞的存活率分别为98%、93%和82%。K562细胞对rsTRAIL不敏感 (图1)。
rsTRAIL和HU联合作用对K562细胞的影响用rsTRAIL和HU分别单独处理和联合处理K562细胞,结果显示在 rsTRAIL(0.25、0.5、1 μg/ml)和 HU(50、100、200和400 μg/ml)不同浓度下,联合处理组对K562细胞生长的抑制率高于两种药物单独处理对该细胞生长的抑制率之和 (P<0.05,P<0.01),rsTRAIL与HU在多种处理条件下存在着协同作用(图2)。
金 (正均)氏公式分析结果显示,在不同浓度的rsTRAIL与HU联合处理的所有条件下,两者均存在着协同作用 (Q值均大于1.15)(表1)。
rsTRAIL和HU对K562细胞的协同作用机制在联合处理组的不同处理时间均检测到Ras的活化受到抑制,rsTRAIL与 HU联合处理4和24h能引起MEK1/2活性的下调,即Ras-Raf-MEK1/2信号通路参与调节了K562细胞对rsTRAIL和HU联合处理的细胞凋亡变化 (图3A);与对照组相比,JNK的磷酸化水平在联合处理1和4h的样品中明显升高,与K562细胞表现出的对药物引起的凋亡敏感性一致 (图3B)。
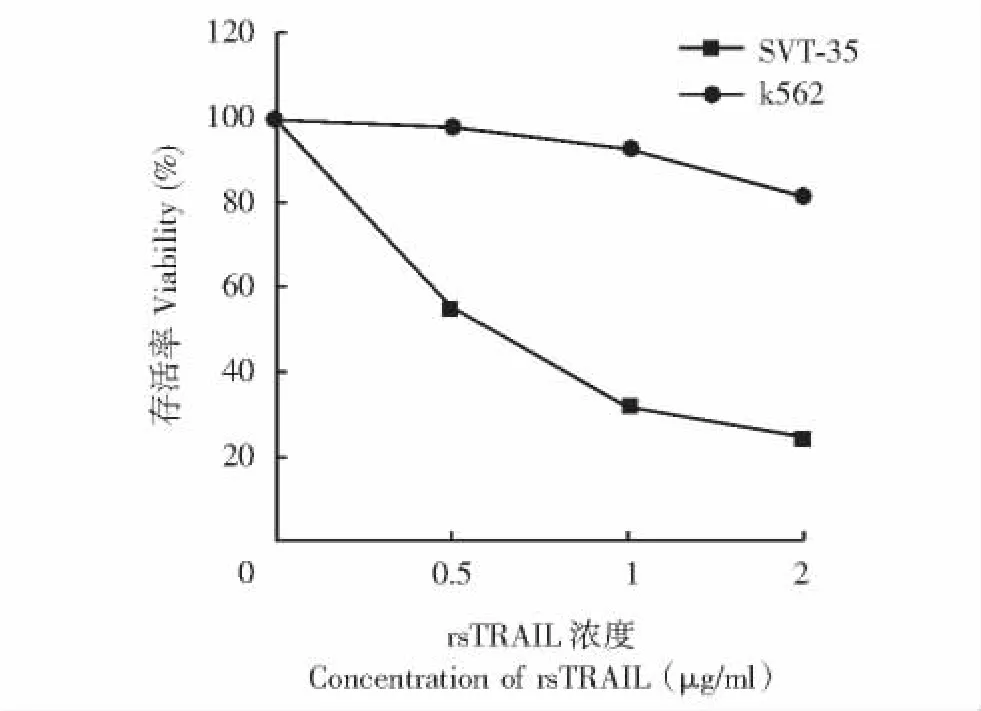
图1 rsTRAIL处理后K562和SVT-35细胞的存活曲线Fig 1 Viability curve of K562 and SVT-35 cells treated with rsTRAIL
rsTRAIL和HU联合处理K562细胞对细胞凋亡抑制蛋白1(cellular inhibitor of apoptosis protein-1,c-IAP1)和细胞型Fas相关死亡区域样白介素-1β转换酶抑制蛋白(cellular Fas associated death domain protein-like interleukin-1 beta-convening enzyme inhibitory protein,c-FLIP)表达的影响rsTRAIL和HU联合处理K562细胞,cFLIP和cIAP1的表达在两种药物联合处理1、4及24 h后均受到不同程度的抑制(图4)。
讨 论
TRAIL能够选择性地诱导多种肿瘤细胞的凋亡,而对大部分正常细胞无毒副作用。TRAIL通过与其分布于细胞表面的两种死亡受体DR4和DR5结合诱导凋亡,它激活的是外源性细胞凋亡通路[7]。化疗药物与TRAIL不同的是,它通过引发细胞损伤,激活p53基因,通过内在凋亡通路介导细胞凋亡[8]。许多癌细胞具有p53基因突变,导致它们能抵抗化疗药物诱导的细胞凋亡[9]。有报道TRAIL诱导的外源性凋亡通路产生的促凋亡信号有可能逾越这种抵抗作用[10]。
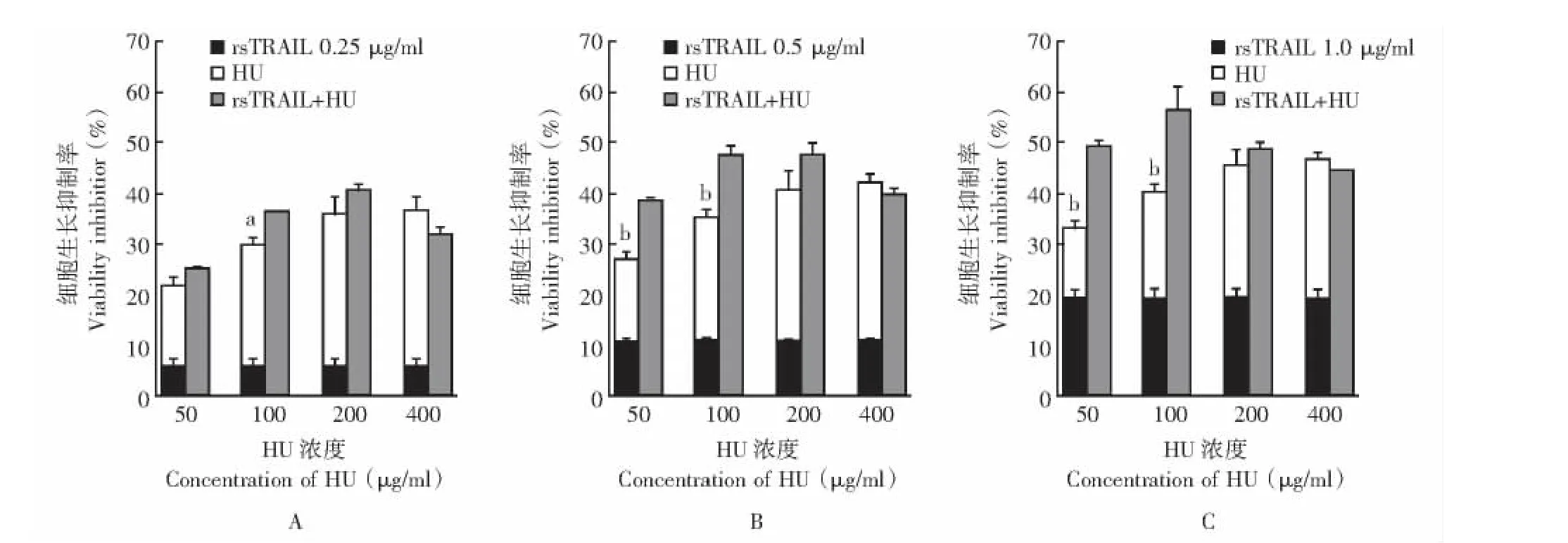
图2 HU和rsTRAIL联合处理K562细胞后的生长抑制率Fig 2 Effects of HU and rsTRAIL on the viability of K562 cells

表1 金 (正均)氏公式表示rsTRAIL和HU的协同作用Table 1 Synergistic effects of rsTRAIL in combination with HU are judged by King's formula
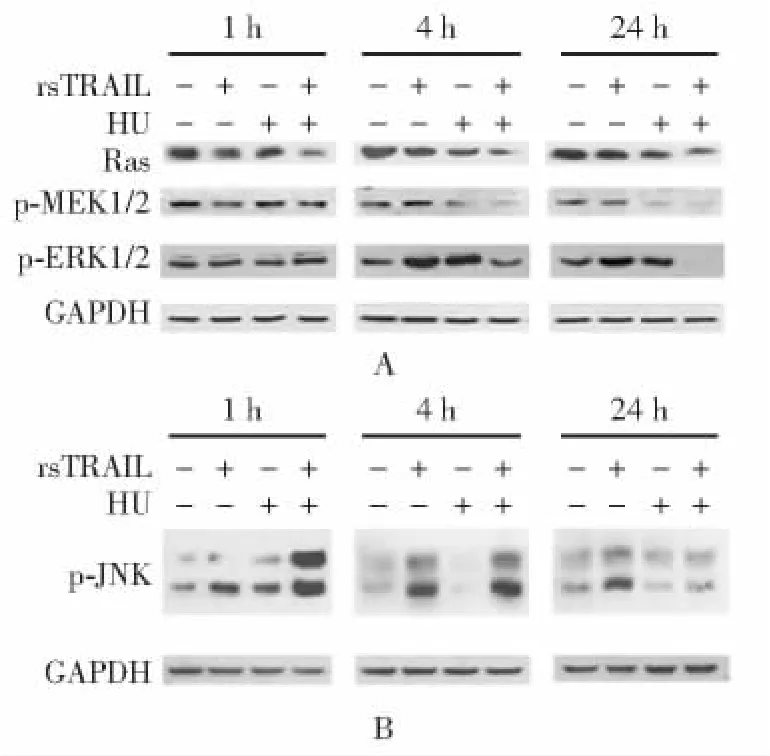
图3 rsTRAIL与HU联合处理抑制K562细胞的Ras-Raf-MEK信号通路Fig 3 Combination of rsTRAIL with HU results in the inhibition of Ras-Raf-MEK signaling pathway
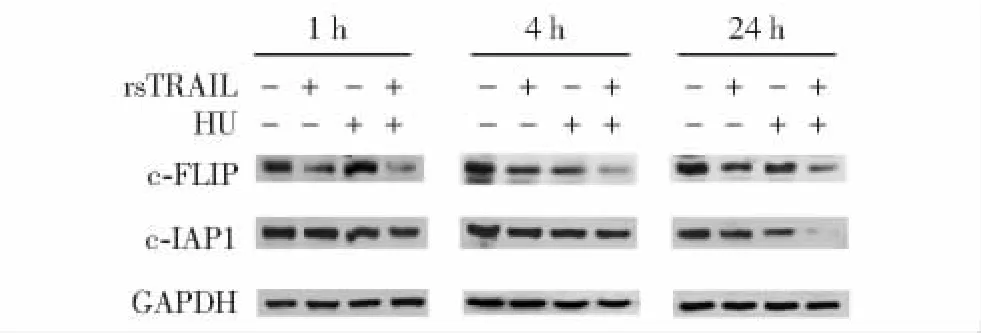
图4 Western blot显示HU和rsTRAIL联合处理K562细胞,其凋亡抑制蛋白的变化Fig 4 Expression of apoptosis inhibitor in K562 cells treated with the combination of rsTRAIL and HU under Western blot
CML是白血病的一种,产生于造血干细胞的恶性转化,其特点是在9和22号染色体中发生平衡易位,产生融合基因bcr-abl,编码的蛋白质酪氨酸激酶具有异常增高的酪氨酸激酶活性,是CML的关键致病原因[11-12]。突变导致在bcr-abl转化的细胞中多种信号通路被激活,赋予多能造血祖细胞的特性,使之远高于正常细胞的生长和生存优势,减少生长因子的依赖性和凋亡[4]。BCR-ABL使细胞色素C从线粒体向胞浆释放受阻,阻断半胱氨酸-天冬氨酸蛋白酶9和3的活化,抑制凋亡发生。临床试验和研究结果表明,CML患者和CML来源的细胞都具有抵抗TRAIL细胞毒作用的能力。本研究使用的一株CML来源的K562细胞,不仅具有抵抗TRAIL细胞毒作用的能力,而且是p53缺陷型[13],能抵抗多种化疗药物诱导的细胞凋亡。目前针对CML的常规治疗为化疗药物治疗,方法单一,副作用大,易复发和转移[14]。研究可应用于CML的临床治疗方案是本研究的目的。本研究使用的rsTRAIL与天然TRAIL蛋白具有相同的生物学活性[15]。本研究首先检测K562细胞对rsTRAIL的敏感性,发现其对rsTRAIL极不敏感。接着选取了作用机制和类型不同的多种化疗药物,与rsTRAIL联合处理K562细胞,筛选到了一种能与rsTRAIL产生协同作用的化疗药物:HU。
HU是一种抗代谢类的化疗药物,是核苷二磷酸还原酶抑制剂,可阻止核苷酸还原为脱氧核苷酸,干扰嘌呤及嘧啶碱基生物合成,选择性地阻碍DNA合成,对RNA及蛋白质合成无阻断作用[16],有致白细胞和血小板减少、引发胃肠道反应、中枢神经系统症状和脱发等不良反应[17]。与TRAIL联用,可明显降低使用剂量,减少对机体的毒副反应。本研究报道了对TRAIL和许多化疗药都不敏感的K562细胞株经rsTRAIL和HU联合处理,在增进细胞凋亡方面能产生协同作用。
具有组成性活性的酪氨酸激酶BCR-ABL能作用于其他与凋亡、增殖以及分化相关的激酶[18-19]。TRAIL能通过其受体激活细胞内JNK,一旦JNK被激活,JNK蛋白就会进入到细胞核内,磷酸化激活c-Jun,增进基因的表达,从而促进细胞凋亡的发生。丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)是一类能对细胞外多种刺激作出相应反应的丝/苏氨酸蛋白激酶,MEK1/2是MAPKs的一个成员,在细胞的生长分化和凋亡方面发挥作用,抑制MEK1/2的活性能提高肿瘤细胞对细胞毒性药物的敏感性。Ras(GTP结合蛋白)活化[20],可以诱导下游事件:Raf(MAPKKK)活化,导致MEK1/2(MAPKK)活化,继续活化MAPK,进入细胞核激活其他激酶或基因调控蛋白 (转录因子)。本研究显示HU和rsTRAIL产生的协同凋亡作用能引起 Ras、MEK、ERK等分子活性下降,提示参与了K562细胞敏感性的变化。本研究报道了rsTRAIL和HU联合处理K562细胞,在增强细胞敏感性方面产生的协同作用是通过抑制Ras-Raf-MEK1/2通路而实现的。本研究发现的如上一些激酶参与调控了K562细胞的增敏过程,但究竟是如何发挥作用的,目前尚不明确,有待于进一步的实验证明。
凋亡途径有两条:包括外源性通路和内在凋亡通路。TRAIL能引起肿瘤细胞经外源性通路发生凋亡。c-FLIP可干扰半胱氨酸-天冬氨酸蛋白酶8的活性,是凋亡信号通路中的抑制蛋白。c-IAP1是存在于细胞质中的抗凋亡蛋白,有泛素蛋白连接酶活性,能与半胱氨酸-天冬氨酸蛋白酶3特异性结合,通过抑制半胱氨酸-天冬氨酸蛋白酶3的切割抑制细胞的凋亡。而化疗药物通过引发细胞损伤,由此激活p53基因,从而激活内在凋亡通路。本研究外源性途径中的凋亡抑制蛋白c-FLIP、c-IAP1参与其中[21],这两种半胱氨酸-天冬氨酸蛋白酶的抑制蛋白的表达水平经药物联合处理后均下降,提示cFLIP和cIAP1在rsTRAIL和HU联合诱导K562细胞凋亡时发挥重要作用,提示外源性凋亡途径在协同作用中发挥了主要作用。
由于无一种癌症是单因素导致的,在特定的药物处理后,细胞内发生变化的分子开关也不只一个,所以要达到治疗癌症的目的,需要尽量全面地研究癌症的发生、维持以及对药物的敏感性发挥作用的所有分子,才能更好更全面地把握癌症相关的各个方面。
由于K562细胞是CML来源的淋巴祖细胞,在CML疾病的发生发展过程中充当了肿瘤干细胞的角色,这赋予了本研究更为深刻的意义。肿瘤干细胞在肿瘤中长期存在,因为能产生新的肿瘤,所以是导致癌症复发和转移的主要原因[22]。CML是由白血病干细胞维持的,与其已经分化的子细胞相比,对特异性的化疗药物有更强的抗性。因此,尽可能多地消除癌干细胞在肿瘤治疗中具有极大挑战性。本研究旨在针对CML来源的K562细胞对多种细胞毒性药物存在抵抗能力,联合常规化疗药物与rsTRAIL,扭转该细胞的抗性,使其敏感性增强,并探讨敏感性改变的机制,为提出新的治疗方法并应用于临床奠定基础。
综上,本研究显示对TRAIL和许多化疗药都不敏感的K562细胞株中,用rsTRAIL和HU联合处理,在增进细胞凋亡方面能产生协同作用。通过抑制Ras-Raf-MEK1/2通路增强该细胞的敏感性,促使细胞通过外源性途径发生凋亡,凋亡抑制蛋白c-FLIP、c-IAP1参与外源性凋亡途径的调控。
[1]Wiley SR,Schooley K,Smolak PJ,et al.Identification and characterization of a new member of the TNF family that induces apoptosis [J].Immunity,1995,3(6):673-682.
[2]Walczak H,Miller RE,Ariail K,et al.Tumoricidal activity of tumor necrosis factor-related apoptosis-inducing ligand in vivo [J].Nat Med,1999,5(2):157-163.
[3]Cortez D,Kadlec L,Pendergast AM,et al.Structural and signaling requirements for BCR-ABL-mediated transformation and inhibition of apoptosis [J].Mol Cell Biol,1995,15(10):5531-5541.
[4]Holtz MS,Forman SJ,Bhatia R,et al.Nonproliferating CML CD34+progenitors are resistant to apoptosis induced by a wide range of proapoptotic stimuli [J].Leukemia,2005,19(6):1034-1041.
[5]Zhang M,Rosen JM.Stem cells in the etiology and treatment of cancer[J].Curr Opin Genet Dev,2006,16(1):60-64.
[6]金正均.合并用药中的相加 [J].中国药理学通报,1980,1(1):70-76.
[7]Wu X,Shi J,Wu Y,et al.Arsenic trioxide-mediated growth inhibition of myeloma cells is associated with an extrinsic or intrinsic signaling pathway through activation of TRAIL or TRAIL receptor 2 [J].Cancer Biol Ther,2010,10(11):1201-1214.
[8]Guchelaar HJ,Vermes A,Vermes I,et al.Apoptosis:molecular mechanisms and implications for cancer chemotherapy [J].Pharm World Sci,1997,19(3):119-125.
[9]Fujita Y,Kato I,Iwai S,et al.Role of p53 mutation in the effect of boron neutron capture therapy on oral squamous cell carcinoma [J].Radiat Oncol,2009,4(1):63.
[10]Wissink EH,Verbrugge I,Vink SR,et al.TRAIL enhances efficacy of radiotherapy in a p53 mutant,Bcl-2 overexpressing lymphoid malignancy [J].Radiother Oncol,2006,80(2):214-222.
[11]王国蓉,于珍,赵耀中,等.慢性髓系白血病实时定量PCR检测的Bcr-Abl水平与临床状态关系的分析 [J].中国实验血液学杂志,2009,17(4):861-865.
[12]Daley GQ,Van Etten RA,Baltimore D,et al.Induction of chronic myelogenous leukemia in mice by the P210bcr/abl gene of the Philadelphia chromosome [J].Science,1990,247(4944):824-830.
[13]Law JC,Ritke MK,Yalowich JC,et al.Mutational inactivation of the p53 gene in the human erythroid leukemic K562 cell line [J].Leuk Res,1993,17(12):1045-1050.
[14]Breccia M,Gentilini F,Cannella L,et al.Ocular side effects in chronic myeloid leukemia patients treated with imatinib [J].Leuk Res,2008,32(7):1022-1025.
[15]史娟,张锦春,畅晓燕,等.重组可溶性 TRAIL的表达与生物学活性 [J].中国生物工程杂志,2003,23(6):46-49.
[16]Nyholm S,Mann GJ,Johansson AG,et al.Role of ribonucleotide reductase in inhibition of mammalian cell growth by potent iron chelators[J].J Biol Chem,1993,268(35):26200-26205.
[17]Maserati R.Hydroxyurea in the treatment of HIV-1 infection:toxicity and side effects[J].J Biol Regul Homeost A-gents,1999,13(3):181-185.
[18]Steelman LS,Pohnert SC,Shelton JG,et al.JAK/STAT,Raf/MEK/ERK,PI3K/Akt and BCR-ABL in cell cycle progression and leukemogenesis [J].Leukemia,2004,18(2):189-218.
[19]Yu C,Krystal G,Varticovksi L,et al.Pharmacologic mitogen-activated protein/extracellular signal-regulated kinase kinase/mitogen-activated protein kinase inhibitors interact synergistically with STI571 to induce apoptosis in Bcr/Abl-expressing human leukemia cells [J].Cancer Res,2002,62(1):188-199.
[20]Raimondi F,Portella G,Orozco M,et al.Nucleotide binding switches the information flow in ras GTPases[J].PLoS Comput Biol,2011,7(3):e1001098.
[21]Bernal-Mizrachi L,Lovly CM,Ratner L,et al.The role of NF-{kappa}B-1 and NF-{kappa}B-2-mediated resistance to apoptosis in lymphomas[J].Proc Natl Acad Sci U S A,2006,103(24):9220-9225.
[22]Bhattacharyya S,Khanduja KL.New hope in the horizon:cancer stem cells [J].Acta Biochim Biophys Sin(Shanghai),2010,42(4):237-242.

