染料高效脱色光合细菌的分离与分析
李彦芹,昌艳萍,李春青,陈涵茜,康现江
(河北大学 生命科学学院,河北 保定 071002)
染料高效脱色光合细菌的分离与分析
李彦芹,昌艳萍,李春青,陈涵茜,康现江
(河北大学 生命科学学院,河北 保定 071002)
为增强染料废水的生物处理,从印染厂的污泥中分离筛选出1株高效脱色光合细菌HL.对其在不同p H、碳源和氮源的条件下对5种染料的脱色效果进行了研究.结果表明,菌株HL菌落呈鲜红色,圆形、光滑、湿润、稍突起、边缘整齐,直径0.5~2.0 mm;个体呈螺旋状,单根极生鞭毛,革兰氏染色为阴性,含有细菌叶绿素a,可进行光合作用.对活性艳红和直接胡兰的脱色效果显著,特别是对直接胡兰在24 h内脱色率达到100%.菌株HL在中性环境下,分别以葡萄糖和氯化铵作为脱色培养基的碳源和氮源时,对直接胡兰的脱色率和降解率分别达到100%和98.67%.
光合细菌;印染废水;脱色率;降解率
印染和染料工业是现代工业中对环境污染比较严重的行业,其产品在生产和使用过程中大约有10%~20%的染料会直接随废水进入环境中[1].染料脱色是印染废水处理过程中关键的环节之一[2],用常规生化处理技术难以达到有效脱色的目的.光合细菌可以有效地利用水中过剩的有机物作为自身繁殖的营养源,迅速分解水中氨、硫化氢、酸类等有害物质,大幅度降低水体的污染指标,在污水处理、水体净化等方面得到广泛关注[3-9].
本实验从保定某印染厂所排放的污泥中分离得到1株具有高效脱色能力的光合细菌,为光合细菌应用于实际印染工业废水的脱色提供借鉴.
1 材料
1.1 分离样品来源
样品采自保定某印染厂含有染料的污泥和污水.
1.2 染料
酸性黑NG、活性艳红、活性艳兰、直接胡兰、直接翠兰,它们的最大吸收波长分别为607,520,599,616,620 nm.将5种染料在无菌操作下分别配制成质量浓度为10 mg/m L的染料溶液备用.
1.3 培养基
富集分离培养基(g/L):NH4Cl 1.0,MgCl20.1,醋酸钠3.0,CaCl20.1,KH2PO40.6,K2HPO40.4,酵母膏0.1,水1 L,p H 7.2,121℃ 灭菌30 min.
斜面培养基(g/L):酵母膏10,MgSO4·7H2O 0.5,K2HPO41.0,琼脂20,蒸馏水1 L,p H 7.0,121℃灭菌30 min.
染料培养基:添加染料的富集分离培养基.
2 方法
2.1 光合细菌的富集与分离
在无菌条件下,将采集的印染污泥和废水以体积比1∶1混合,再与富集培养基按体积比1∶5混匀装入三角瓶中,再加入配好的染料溶液,使染料最终质量浓度达到0.4 mg/m L,并加入已灭菌的液体石蜡(高约2 cm)形成厌氧环境,放入光照培养箱中,28~30℃,3 000 lx,培养7~15 d,待液体培养物呈现红色或红棕色后,取适量的富集液移至新配制的富集培养基中,进行2次富集培养(每换1次富集培养基,染料质量浓度增加1倍),重复2~3次.
采用染料固体培养基稀释涂布法和平板划线法进行分离,应用焦性没食子酸法除氧[10-11],在28~30℃,光照厌氧培养7~10 d,分离筛选具有脱色能力的菌株,转接到斜面培养基备用.
2.2 菌株形态观察
将分离得到的菌株转接到未加染料的培养基上,在28~30℃,光照厌氧培养,观察菌落形态,进行革兰氏染色,鞭毛染色,菌体形态观察.
2.3 菌体活细胞吸收光谱的测定
采用液体培养基,28~30℃,光照厌氧培养5 d,培养物经离心生理盐水洗涤,将菌体悬浮于600 g/L的蔗糖溶液中,于UV 2802S紫外可见分光光度计在300~1 000 nm连续扫描[12].
2.4 脱色率和降解率测定
脱色率的测定[13]:取适量培养液经5 000 r/min离心20 min后取上清液,以未加染料的液体培养基做空白,未接种菌体的染料培养基做对照,用722型可见光分光光度计在染料最大吸收波长下测其吸光度值,计算该菌的脱色率.

式中,A表示未接种染料培养基的最大吸光度,B表示脱色后染料培养液的最大吸光度,以脱色率表示该菌的脱色能力.
降解率的测定:用乙醇抽提法将菌体吸附的染料洗脱下来,以未加染料只加乙醇的培养基为空白,以染料培养基为对照,用722型可见光分光光度计在染料最大吸收波长测吸光度值,计算降解率.

式中,C表示加入等体积乙醇的未接种染料培养基的最大吸光光度值;D表示用乙醇洗脱后的培养液的最大吸光光度值.根据降解率大小来判断菌株对染料的降解能力.
2.5 染料脱色后产物光谱分析
将培养液以5 000 r/min离心20 min取上层清液,以染料培养基为对照,不加染料的培养基为空白,利用UV 2802S紫外可见分光光度计在300~700 nm扫描,对染料的降解产物进行光谱分析.
2.6 p H、碳源和氮源对脱色效果的影响
在探索某因素对光合细菌脱色的影响时,采取单因素实验法,固定其他因素条件不变,在一定范围内改变该因素的值,30℃,3 000 lx光照厌氧培养,培养一定时间,以未接菌的染料培养基为对照,未加染料的培养基为空白,测定脱色率及降解率.
3 结果和讨论
3.1 菌株形态
经过富集培养,稀释涂布法和划线分离法得到一株具有脱色能力的菌株HL,其菌落呈鲜红色,圆形、光滑、湿润、稍突起、边缘整齐,直径0.5~2.0 mm.革兰氏染色为阴性,个体呈螺旋状,单根极生鞭毛.
菌体活细胞吸收光谱测定,结果如图1,在580,802,862 nm处都有吸收峰出现,与细菌叶绿素a的吸收波长相符,由此可表明分离出的菌株HL含有细菌叶绿素a,可进行光合作用,属光合细菌.

图1 HL菌株活细胞全波长扫描图谱Fig.1 Absorption spectrum of live cell suspension of strain HL
3.2 菌株HL对几种染料的脱色效果
将菌株HL种子液,接种到质量浓度为0.4 mg/m L的不同染料培养基中,光照厌氧培养24,48 h取样测吸光度值,根据公式(1)计算脱色率,结果如表1.
由表1可知,菌株HL对以上5种染料都有脱色能力,其中对活性艳红和直接胡兰的脱色效果最显著,特别是对直接胡兰,在24 h内脱色率达到100%,HL对活性艳兰和直接翠兰的脱色效果分别只有52.43%和42.40%,酸性黑的脱色效果为69.85%.
用乙醇抽提法将菌体吸附的染料洗脱下来,根据公式(2)计算降解率,结果如表2.

表1 HL菌株对几种染料的脱色率Tab.1 Several dye decolorization rate of strain HL
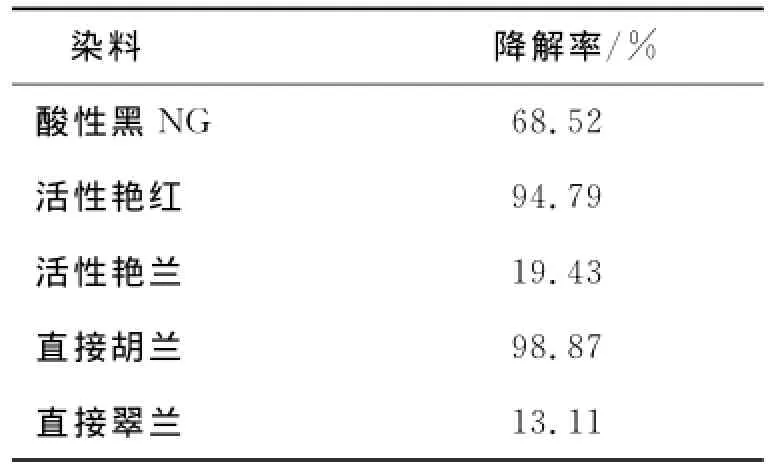
表2 HL菌株对几种染料的降解率Tab.2 Several dye degradation rate of strain HL
由表2可知,光合细菌HL对活性艳红和直接胡兰有脱色能力可能是HL菌株在脱色的过程中产生某种物质与活性艳红和直接胡兰发生作用,改变其化学结构,使其降解.反之,活性艳兰和直接翠兰的降解率分别只有19.43%和13.11%,可能是被菌株HL吸附,所以很容易被乙醇洗脱下来.
3.3 代谢产物光谱分析
由脱色前后全波长扫描图(图2~5)可知,活性艳红、直接胡兰和酸性黑之所以能被菌株HL脱去颜色,是因为菌株HL在脱色过程中,破坏染料分子其原来的化学结构,本来在脱色前最大吸收波长处有峰,但是脱色后吸收峰消失了,染料被降解了.直接翠兰不管脱色前还是脱色后最大吸收波长处都有吸收峰出现,根据图5可得出结论,菌株HL之所以对直接翠兰有脱色效果是吸附作用的结果.另一方面,染料被降解后可能会产生新的物质,影响到脱色率和降解率测定的准确性,将脱色前后的全波长扫描图与表1和表2相结合可以说明染料被降解不会影响脱色率和降解率测定的结果.

图2 活性艳红脱色前、后的紫外-可见光谱Fig.2 Ultraviolet-visible spectrum of activity liquor before decolorization and after decolorization
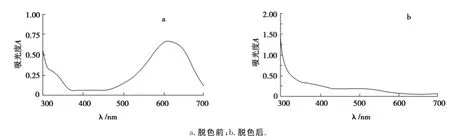
图3 直接胡兰脱色前、后的紫外-可见光谱Fig.3 Ultraviolet-visible spectrum of directly Hulan before decolorization and after decolorization

图4 酸性黑脱色前、后的紫外-可见光谱Fig.4 Ultraviolet-visible spectrum of acid black before decolorization and after decolorization
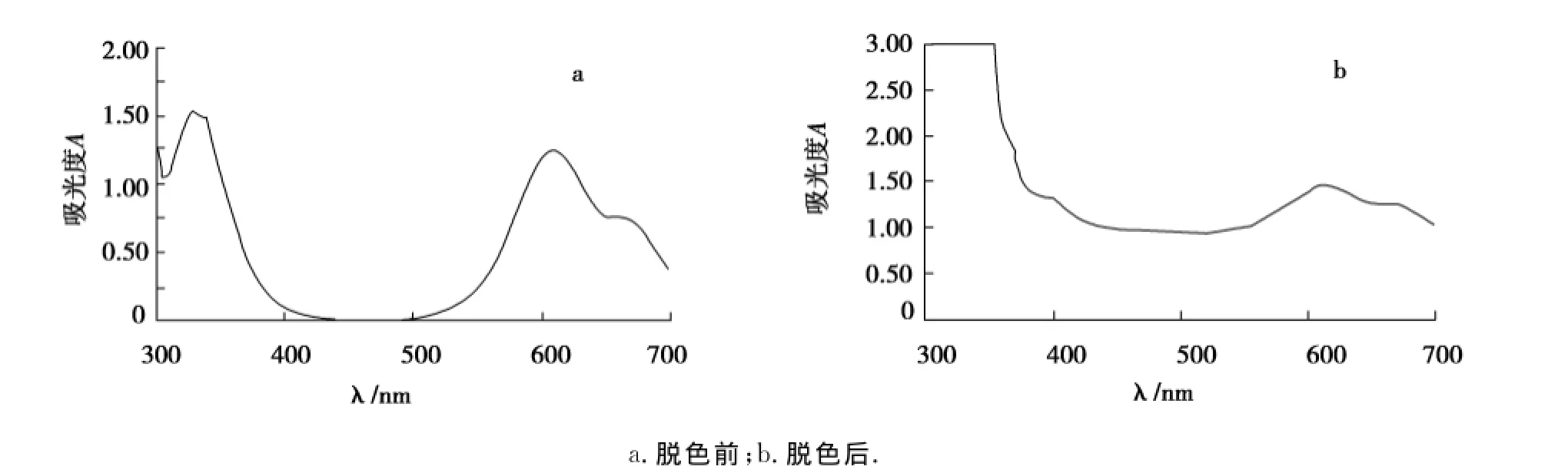
图5 直接翠兰脱色前、后的紫外-可见光谱Fig.5 Ultraviolet-visible spectrum of direct Cuilan before decolorization and after decolorization
3.4 p H、碳源和氮源对脱色效果的影响
3.4.1 p H对菌株脱色能力的影响
以直接胡兰做脱色染料,将菌株HL转接到不同p H的染料培养基中培养48 h,同时以未接菌的染料培养基为对照,未接种的培养基为空白,测定脱色率和降解率的结果见图6.

图6 p H对菌株HL脱色能力的影响Fig.6 Effect of initial p H on decolorization
由图6可知,菌株HL在p H<4时对直接胡兰的脱色效果不明显.在p H 7时,菌株HL脱色率和降解率都很高,分别是91.34%和94.69%,而且随着p H的增大或减小,菌株对染料的脱色率和降解率也随之下降.由此表明,光合细菌HL在p H 7时,其对直接胡兰的脱色效果最好.
3.4.2 氮源对菌株脱色能力的影响
以直接胡兰做脱色染料,将菌株HL转接到不同氮源的染料培养基中培养48 h,测定脱色率和降解率的结果如表3所示.3种替代氮源都可以被菌株HL利用,各种氮源对脱色率和降解率的影响为:氯化铵>蛋白胨>尿素>硝酸钠.由此可知,菌株HL以氯化铵作为氮源对染料的脱色率和降解率最优,确定无机氮源氯化铵为菌体生长及脱色降解染料的最适氮源.
3.4.3 碳源对菌株脱色能力的影响
以直接胡兰做脱色染料,将菌株HL转接到不同碳源的染料培养基中培养48 h,同时以未接菌的染料培养基为对照,未接种的培养基为空白,测定脱色率和降解率的结果如表3.葡萄糖、甘露醇和醋酸钠很容易被光合细菌HL利用,丁二酸钠很难被菌体利用,所以菌体很难生长导致脱色率和降解率都很低.各种碳源对脱色率和降解率的影响为:葡萄糖>甘露醇>醋酸钠>丁二酸钠.由此可知,菌株HL以葡萄糖作为碳源对染料进行脱色时测得的脱色率和降解率最优,说明这4种碳源中葡萄糖最容易被菌体HL利用.

表3 氮源、碳源对脱色率和降解率的影响Tab.3 Effect of different nitrogen and carbon sources on decolorization rate and degradation rate
4 结论
本实验筛选出1株光合细菌HL,其菌落呈鲜红色,革兰氏染色为阴性,菌体为螺旋状,含有细菌叶绿素a.
菌株HL对活性艳红和直接胡兰的脱色效果显著,特别是对直接胡兰的脱色能力在24 h内达到100%,是一株对直接胡兰具有高效脱色能力的光合细菌.
菌株HL的脱色能力与生长同步,在中性环境下,分别以葡萄糖和氯化铵作为脱色培养基的碳源和氮源时,对直接胡兰的脱色率和降解率分别达到100%和98.67%.
[1] 吴楚,王慧,郑天凌.一株苯胺蓝降解菌的分离鉴定及其降解特性[J].华侨大学学报:自然科学版,2008,29(1):38-41.
WU Chu,WANG Hui,ZHENG Tianling.A aniline degradation bacteria isolation identification and degradation characteristics[J].Journal of Huaqiao University:Natural Science Edition,2008,29(1):38-41.
[2] 李可,张肇铭,曹养宪.沼泽红假单胞菌对活性紫KBR脱色的研究[J].中国环境科学,2004,24(3):299-302.
LI Ke,ZHANG Zhaoming,CAO Yangxian.Studies on decolorization of reactive violet KBR byRhodopseudomonaspalustris[J].China Environmental Science,2004,24(3):299-302
[3] 赵亮,李兰生,刘金雷.海洋光合细菌对五种活性染料的脱色研究[J].海洋湖沼通报,2006(3):73-78.
ZHAO Liang,LI Lansheng,LIU Jinlei.Study on the decolorization of five dyes by ocean photosynthetic bacteria[J].Transactions of Oceanology and Limnology,2006(3):73-78.
[4] 徐文东,文湘华.微生物在含染料废水处理中的应用[J].环境污染治理技术与设备,2000,1(2):9-16.
XU Wendong,WEN Xianghua.Functions of microorganisms in dyeing wastewater treatment[J].Techniques and Equipment for Environmental Pollution Control,2000,1(2):9-16.
[5] 乐毅全,朱核光,王士芬.高效染料脱色菌的分离鉴定及其脱色特性[J].上海环境科学,2003,22(8):556-558.
LE Yiquan,ZHU Heguang,WANG Shifen.Isolation and identification on a strain of high-efficient dye decolorizing bacte-ria and their characteristics of decolorization[J].Shanghai Environmental Sciences,2003,22(8):556-558.
[6] TAKENO K,YAMAOKA Y,SASAKI K.Treatment of oil-containing sewage wastewater using immobilized photosynthetic bacteria[J].World Journal of Microbiology and Biotechnology,2005,21:1385-1391.
[7] NAGADOMI H,KITAMURA T,WATANABE M,et al.Simultaneous removal of chemical oxygen demand(COD),phosphate,nitrate and H2S in the synthetic sewage wastewater using porous ceramic immobilized photosynthetic bacteria[J].Biotechnology Letters,2000,22:1369-1374.
[8] NAGADOMI H,TAKAHASI T,SASAKI K,et al.Simultaneous removal of chemical oxygen demand and nitrate in aerobic treatment of sewage wastewater using an immobilized photosynthetic bacterium of porous ceramic plates[J].World Journal of Microbiology and Biotechnology,2000,16:57-62.
[9] KHANNA P,RAJKUMAR B,JOTHIKUMAR N.Microbial recovery of sulfur from thiosulfate-bearing wastewater with phototrophic and sulfur-reducing bacteria[J].Current Microbiology,1996,32:33-37.
[10] 刘如林,刁虎欣,梁凤来,等.光合细菌及其应用[M].北京:中国农业科技出版社,1991:79-88.
LIU Rulin,DIAO Huxin,LIANG Fenglai,et al.Photosynthetic bacteria and its application[M].Beijing:Agricultural Science and Technology Press,1991:79-88.
[11] 杨素萍,张肇铭,赵春贵.绿色红假单胞菌和绿硫红假单胞菌的分离与鉴定[J].微生物学报,1995,35(2):91-96.
YANG Suping,ZHANG Zhaoming,ZHAO Chungui.Isolation and identification ofRhodopseudomonasviridisandRhodopseudomonassulfoviridis[J].Acta Microbiologica Sinica,1995,35(2):91-96.
[12] 李彦芹,张涛,李凤超,等.对虾养殖池底泥中光合细菌分离及其生物学特性[J].河北大学学报:自然科学版,2006,26(1):61-65.
LI Yanqin,ZHANG Tao,LI Fengchao,et al.Isolation and identification of photosynthetic bacteria from the breeding shrimp pond[J].Journal of Hebei University:Natural Science Edition,2006,26(1):61-65.
[13] 张金平,阚振荣,梁利华.拟内孢霉对3种偶氮染料的脱色研究[J].河北大学学报:自然科学版,2006,26(3):283-288.
ZHANG Jinping,KAN Zhenrong,LIANG Lihua.Decolorization of three azo dyes byEndomycopsi.sp[J].Journal of Hebei University:Natural Science Edition,2006,26(3):283-288.
(责任编辑:赵藏赏)
Separation and analysis of photosynthetic bacteria of high efficiency decolorization
LI Yan-qin,CHANG Yan-ping,LI Chun-qing,CHEN Han-xi,KANG Xian-jiang
(College of Life Sciences,Hebei University,Baoding 071002,China)
In order to enhance the biological treatment of dyestuff wastewater,a strain HL of photosynthetic bacteria with high efficiency on the dye decoloring ability were separated and analyzed.The effects of the strain HL on decolourization of five dyes under different conditions such as the choice of p H,carbon source and nitrogen source were studied.Results showed that the strain HL colony was bright red,circular,moist,smooth,slightly protuberant,edge tidy,diameter 0.5-2.0 mm,individual assume spiral-shaped,single extremely born flagellum,gram's staining for negative,contain bacteria chlorophyll-a for photosynthesis.And the decoloring ability were determined on the five types of dye,including on the active liquor and direct Hulan of decolorization optimal,especially for the treatment of ability within 24 h on direct Hulan was 100%.Strain HL in a neutral environment,respectively with glucose and ammonium chloride as decoloring medium carbon source and nitrogen source,the decolored rate and degradation rate of direct Hulan were 100%and 98.67%respectively.
photosynthetic bacteria;printing and dyeing wastewater;decolorization rate;degradation rate
Q939.9
A
1000-1565(2012)04-0399-07
2011-09-26
河北省自然科学基金资助项目(C2011201028)
李彦芹(1965-),女,河北满城人,河北大学副教授,主要从事微生物和免疫学研究.E-mail:Liyanqin88@yahoo.com.cn

