栗疫病病原菌致病性及生长特性研究
何秀娟,徐育海,杨晓平 (湖北省农业科学院果树茶叶研究所,湖北 武汉 430209)
谷 超 (长江大学园艺园林学院,湖北 荆州 434025)
栗疫病病原菌致病性及生长特性研究
何秀娟,徐育海,杨晓平 (湖北省农业科学院果树茶叶研究所,湖北 武汉 430209)
谷 超 (长江大学园艺园林学院,湖北 荆州 434025)
从湖北大别山板栗产区受栗疫病侵染栗园中分离出栗疫病病原菌4株,对各菌株的致病性和生长特性进行了研究。结果表明:不同菌株的致病性存在显著差异,其中C菌株致病力最强,接种到板栗枝条15d发病率达100%,病斑面积显著大于其他菌株;不同菌株在不同碳源营养和氮源营养条件下生长特性亦不相同:在PDA培养基上,C菌株菌丝生长最快;在以酵母膏为氮源的培养基上各菌株生长良好,以甘氨酸和尿素为氮源则无法生长;在以葡萄糖、蔗糖、乳糖、麦芽糖为碳源的培养基上各菌株均能迅速生长,以可溶性淀粉为碳源则生长缓慢且菌丝稀薄。
栗疫病;致病性;氮源;碳源
栗疫病是由子囊菌亚门的栗疫病菌即寄生隐丛赤壳菌[Cryphonectriaparasitica(Murr.)Barr]引起的一种真菌性病害,是世界上最著名的森林病害,20世纪初几乎完全毁灭了美洲栗[1],欧洲各国的欧洲栗生产也蒙受巨大损失。中国板栗一直被认为是对栗疫病抗性最强的一个种[2],但不同的品种资源抗性不同。我国学者早已在国内多个省市发现此病[3-4],且已造成了不同程度的危害,部分地区发病率高达60%,被害板栗树轻则树势衰弱,影响产量,重则树干溃烂,全株死亡。由此,栗疫病的防治研究亦成为我国板栗产业健康发展所不容忽视的问题。本研究从湖北省大别山板栗产区受栗疫病侵染栗园分离出栗疫病病原菌4株,研究其致病性和在不同碳源营养和氮源营养条件下生长特性,以期为栗疫病的防治研究奠定基础。
1 材料与方法
1.1 材料
栗疫病病原菌采自湖北省罗田县受栗疫病侵染的板栗园,选择具有典型栗疫病症状的枝干,刮取病斑树皮装入样品袋,带回实验室供病原菌分离。供病菌接种用的健康板栗枝条采自湖北省农科院果树茶叶研究所板栗资源圃内,品种为‘金栗王’,选取二年生枝条,直径8mm左右。培养基为PDA培养基和查氏培养基(Czapek’s medium)[5]。
1.2 病原菌的分离
按常规组织分离法,从自然发病的栗疫病树皮中进行组织分离,单孢纯化,培养保存。对分离出的菌株,根据柯赫氏法则,回接到健康的板栗枝条上,观察能否产生典型的栗疫病病斑,并从新的病斑处重新分离致病菌,确认致病菌与原菌株特征一致。
1.3 分离菌株在PDA平板上的生长特性观察
将病原菌株接种于PDA平板上,25℃光照培养7d后,在菌落边缘用6mm打孔器打取幼嫩菌丝块,置于新鲜的PDA平板上25℃光照培养。每天同一时间采用十字交叉法测量菌落直径,并观察和记载菌落颜色及厚度。培养2周后,在平板上倒入20ml无菌水于25℃浸泡30min,过滤,血球计数板测量产孢量。每处理重复3次。
1.4 不同菌株致病力的比较
试验品种为‘金栗王’,将采集的枝条杀菌消毒后晾干,用5mm打孔器在枝条上打孔,深至木质部,取出树皮,将5mm菌丝块接种于板栗枝条孔内,于25℃光照保湿培养,7d后移除菌丝块,从第10d开始观察各处理枝条发病特征、发病率,记录病斑纵横径,以椭圆面积公式计算出病斑面积,每5d记录1次,直至4周。以空白琼脂块为对照,每处理重复3次。
Characteristics of Rossby wave packets in non-ENSO years and their possible impacts on severe precipitation
1.5 不同氮源对病原菌菌丝生长和产孢量的影响
以查氏培养基为基础。以葡萄糖30g/L为碳源,分别加入尿素、硝酸钙、蛋白胨、硝酸铵、酵母膏、甘氨酸、硝酸钾、硫酸铵等2g/L为氮源,以不加氮源的查氏培养基为对照。取6mm菌丝块移植于不同氮源培养基上,25℃恒温光照培养,逐日测量菌落直径并观察和记载菌落颜色及厚度,培养2周后测量产孢量。每处理重复3次。
1.6 不同碳源对病原菌菌丝生长和产孢量的影响
以查氏培养基为基础。以2g/L酵母膏为氮源,分别加入葡萄糖、蔗糖、乳糖、麦芽糖、淀粉等30g/L为碳源,不加碳源的查氏培养基作为对照。实验方法同1.5。
采用SAS 8.0统计软件对试验数据进行统计分析。
2 结果与分析
2.1 病原菌的分离

Ι为自然侵染栗疫病症状;Π为C菌株接种后发病症状;Ш为D菌株接种后发病症状; IV为F菌株接种后发病症状;V为I菌株接种后发病症状。
2.2 不同菌株在PDA平板上的生长特性
不同菌株在PDA平板上培养,菌落直径、日生长速率、产孢量、菌落颜色以及菌落厚度差异明显。C菌株菌丝生长速率显著高于其他菌株,菌丝白色,且菌落较厚,产孢慢,到第20d时方能看到少许孢子,平板反面黄色;D菌株菌丝生长速率较慢,边缘菌丝为白色,中心为橙黄色,菌落较C菌株薄,产孢快,第7d能检测到大量孢子,平板反面黄色;F菌株菌丝生长速率在C菌株和D菌株之间,菌丝黄色,菌落较D菌株略厚,产孢快,培养第7天能检测到孢子产生,平板反面黄色;I菌株菌丝生长速率最小,菌丝黄色,菌落较薄,产孢快,第7d时测得产孢量显著高于其他菌株,平板反面黄色。
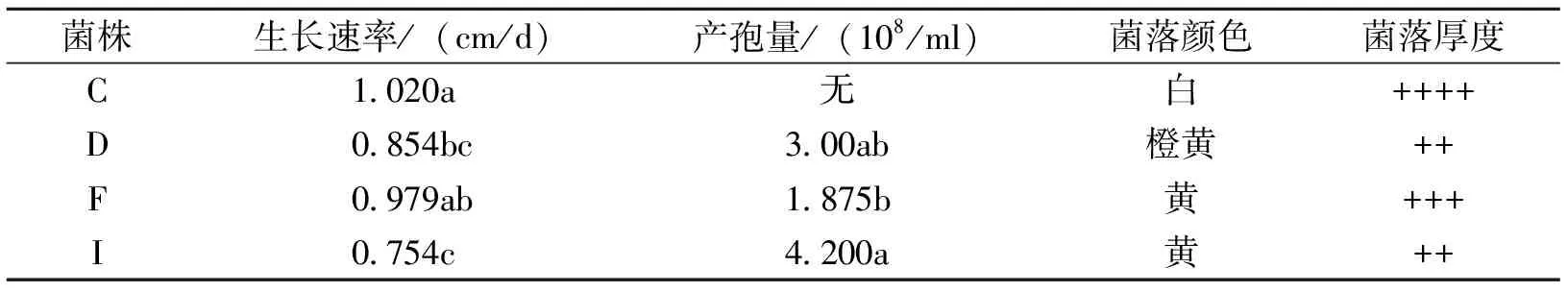
表1 不同菌株PDA培养第7d生长特性
2.3 不同菌株的致病力
不同菌株在‘金栗王’品种枝条上致病力有显著差异。菌株C接种病菌后,7d时伤口周围出现凹陷病斑,橙红色,边缘清晰,表皮病斑扩散快,伤口长出菌丝初为白色,逐渐变厚转为黄色,15d病斑处着生大量突起,新长出黄色菌丝;菌株D接种10d伤口周围开始出现褐色凹陷病斑,并可见稀薄黄色菌丝,菌丝慢慢变厚,但厚度小于菌株C,褐色病斑扩散较慢,病斑处表皮逐渐转为锈红色;菌株F接种后15d伤口周围开始出现褐色凹陷病斑,病斑在表皮扩散慢,除去表皮能看到韧皮部转为褐色,20d伤口处见少量黄色菌丝,病斑变为褐红色,病斑周围出现少量突起;菌株I接种后15d伤口周围出现病斑,20d伤口周围有凹陷病斑,褐红色,扩散慢,伤口处菌丝深黄色,菌丝较菌株F厚。病菌接种后培养第20d比较各菌株发病特征,菌株C的发病率和病斑直径显著高于其他菌株(表2)。

表2 不同菌株接种枝条20d后发病特征
2.4 不同氮源对病原菌菌丝生长和产孢量的影响
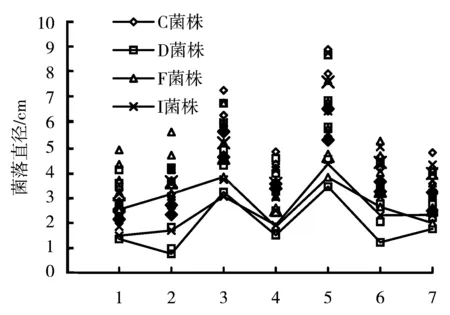
横坐标轴中,1为无氮源,2为硝酸钙,3为蛋白胨,4为硝酸铵,5为酵母膏,6为硝酸钾,7为硫酸铵;各氮源处理对应的散点中,符号一致的散点自下而上分别表示同一菌株在该氮源培养基上生长第4d、5d、6d、7d和第8d时的菌落直径。
将4个菌株在不同氮源培养基上生长4~8d之间的菌落直径作散点图(图2),菌株的产孢量和菌落特征见表3。菌落生长检测结果表明,各菌株能利用多种氮源,在无氮条件下也能生长,但在尿素和甘氨酸为氮源的培养基上均不能生长;酵母膏是最有利的氮源,菌丝生长速率和菌落厚度显著高于其他氮源;各菌株在无机氮源培养基上生长缓慢且菌丝稀薄。C菌株产孢慢,第15d时黄色子座稀少,仅在酵母膏为氮源的培养基上测得少量孢子产生;D菌株在酵母膏培养基中产生大量孢子,在其他处理中产孢稀少;F菌株和I菌株在以酵母膏为氮源培养基上产孢量最大,其他氮源与无氮培养基产孢量无明显差异,或检测不到孢子。
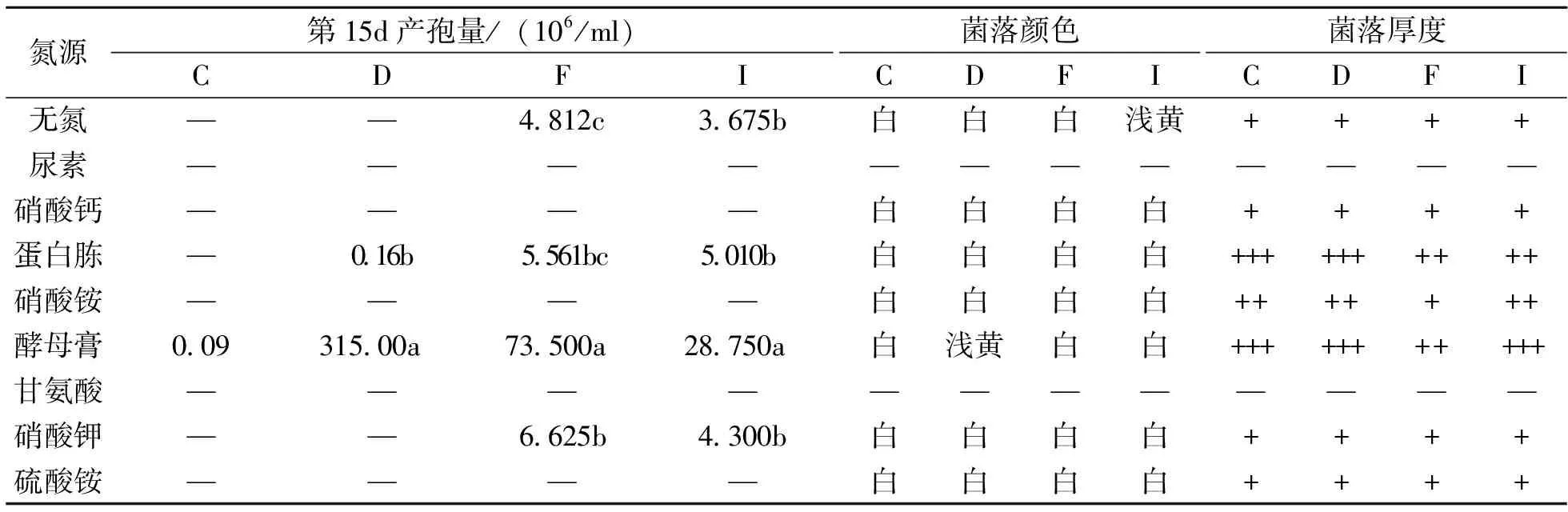
表3 不同氮源对各病原菌株生长的影响
2.5 不同碳源对病原菌菌丝生长和产孢量的影响
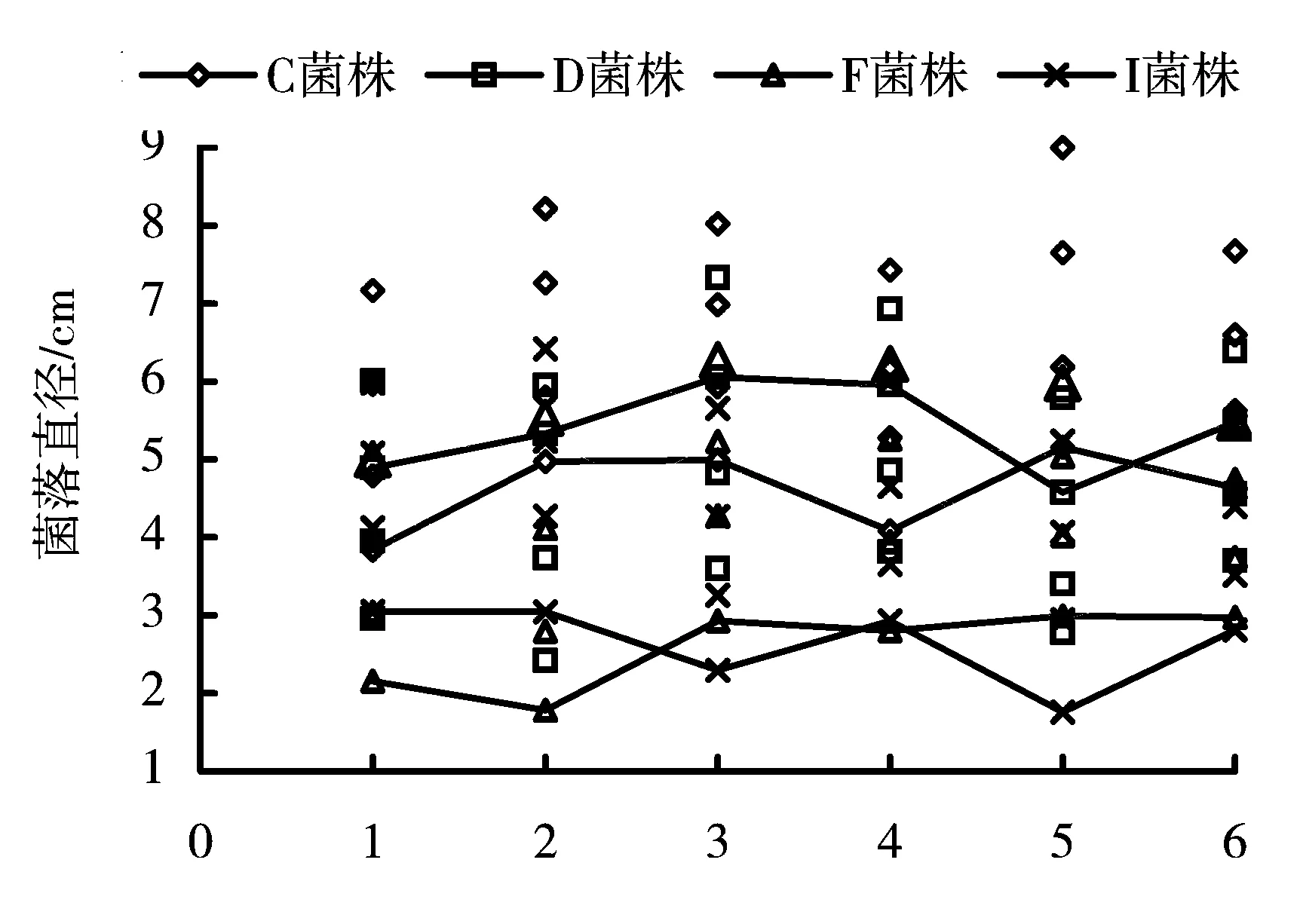
横坐标轴中,1为无碳源,2为葡萄糖,3为蔗糖,4为乳糖,5为麦芽糖,6为可溶性淀粉;各碳源处理对应的散点中,符号一致的散点自下而上分别表示同一菌株在该氮源培养基上生长第4d、5d、6d和第7d时的菌落直径。
以酵母膏为氮源,4个菌株在不同碳源培养基上生长4~7d的菌落直径作散点图(图3),菌株产孢量和菌落特性见表4。菌落生长检测结果表明,4个菌株能有效利用多种碳源,在不同碳源和无碳处理中都能生长,在可溶性淀粉和无碳培养基上生长菌丝极为稀薄。不同菌株对不同碳源的利用存在差异,C菌株在不同碳源上均能迅速生长且生长速率较其他菌株最快,菌落厚,对麦芽糖和葡萄糖的利用好于其他碳源;不同碳源培养基上,D菌株在蔗糖和乳糖培养基上菌落生长较快,生长速率和菌落厚度仅次于C菌株;F菌株对可溶性淀粉的利用最差,略低于无碳处理;I菌株对葡萄糖的利用好于其他碳源,可溶性淀粉处理和无碳处理无差异。菌株C在不同碳源培养基上产孢时间较其他菌株晚,到第15d时未能测出孢子,不同碳源对各菌株产孢量的影响与菌丝生长相似。
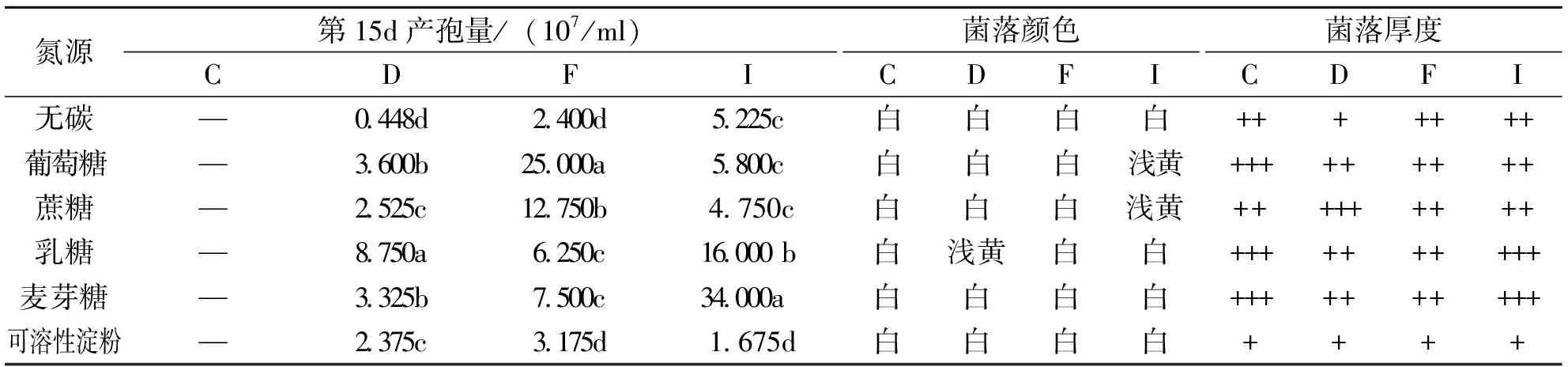
表4 不同碳源对各病原菌株生长的影响
3 讨论
本研究结果表明,4个栗疫病病原菌株在PDA上的生长速率、菌落颜色、菌落厚度及产孢量均存在显著差异,接种到‘金栗王’板栗枝条上发病率和病斑扩散速率也不相同。进一步印证了栗疫病菌存在丰富的遗传多样性和致病力多样性。其中C菌株致病力最强,发病率达100%且病斑扩散迅速,在PDA培养基上C菌株菌丝白色,生长迅速,菌落厚。
碳源和氮源利用研究表明,栗疫病病原菌生存能力强,能有效利用多种氮源和碳源,在无碳或无氮条件下也能生长。从本研究结果看,最佳氮源是酵母膏。在氮源利用实验中,4个菌株对无机氮源的利用不理想,菌丝稀薄且产孢量明显降低,因此碳源筛选实验设计建议以酵母膏作为基础氮源。碳源利用实验表明,可溶性淀粉不是理想的碳源,由此,可溶性淀粉不宜作为栗疫病菌生长的碳源。
有研究表明甘氨酸和尿素都具有不同程度的抗菌作用[6-8],本研究中,各菌株在甘氨酸和尿素为氮源的培养基上均不能生长,与无氮源处理相比,甘氨酸和尿素对菌株的生长存在明显的抑制作用,推测这2种物质可能对栗疫病具有一定的防治效果。
在本研究初步研究了培养条件对病原菌培养特征造成的差异,对研究病原菌的生长变化和防治措施具有指导作用,对抑菌物质的筛选有待于进一步研究。
[1]Burnham C R,Rutter P A,French D W.Breeding blight-resistant chestnut [J].Plant Breed Rev,1986,4:363-371.
[2]Anagnostakis S L.Measuring resistance of chestnut trees to chestnut blight [J].Canadian Journal of Forest Research,1992,22:568-571.
[3]周而勋,王克荣,陆家云.中国东部11省(市)栗疫病的发生条件[J].南京农业大学学报,1993,16(3):44-49.
[4]闫伯前,秦 岭,李作洲,等.中国栗疫病菌群体遗传结构的空间自相关性分析[J].武汉植物学研究,2003,21(3):238-244.
[5]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986:200-205.
[6]熊国华,杨哲民,侯 鹿.甘氨酸及其衍生物的抗菌作用[J].氨基酸和生物资源,1994,(4):31-34.
[7]练 森,李保华,董向丽.福星和尿素对梨黑星病病菌假囊壳形成的影响[J].中国果树,2007,(2):30-32.
[8]Mondal S N,Timmer L W.Effect of urea,CaCO3and dolomite on peseudothecial development and ascospore production ofMycosphaerellacitri[J].Plant Disease,2003,87:478-483.
10.3969/j.issn.1673-1409(S).2012.01.001
S436.64
A
1673-1409(2012)01-S001-04
2012-01-05
湖北省自然科学基金重点项目(2010CDA052)。
何秀娟(1982-),女,湖北天门人,硕士,助理研究员,主要从事板栗栽培育种及病虫害防治工作。
徐育海,E-mailxuyuhai2003@163.com。

